Геморрой является одним из самых распространенных заболеваний человека и остается наиболее частой причиной обращения к врачу-колопроктологу. Его распространенность достигает 145 случаев на 1000 взрослого населения, а удельный вес в структуре проктологических заболеваний колеблется в пределах 34–41%, с одинаковой встречаемостью у мужчин и женщин [1–3]. К застою кровообращения в малом тазу и возрастанию заболеваемости геморроем ведет образ жизни современного человека [4]. Операцией выбора в странах Европы при декомпенсированных стадиях геморроя остается открытая геморроидэктомия по Миллигану–Моргану в различных модификациях [5, 6], особенно при сочетании геморроя с наличием других заболеваний анального канала, таких как анальная трещина или полип [7, 8]. В странах Американского континента (в основном США и Канаде) более широкое распространение получила закрытая геморроидэктомия – операция Фергюссона [9–11], которая является одной из вариаций предыдущей методики, поскольку геморроидальные коллекторы удаляются в обоих случаях в радиальном направлении с оставлением между операционными ранами кожно-слизистых «мостиков». К недостаткам геморроидэктомии типа методики Миллигана–Моргана относят: 1) достаточно интенсивный болевой синдром в послеоперационном периоде (в 23–41% случаев); 2) кровотечения в раннем послеоперационном периоде (от 2% до 4% больных); 3) воспалительные осложнения (также у 2–4% пациентов); 4) дизурия (у 15–26% прооперированных). Уже только эти особенности в значительной мере удлиняют сроки реабилитации после традиционной геморроидэктомии. Не добавляют оптимизма развивающиеся в отдаленные сроки послеоперационные стриктуры анального канала (встречающиеся в 6–9% наблюдений) и в то же время – недостаточность анального жома (у 1,8–4% больных). При этом рецидивы геморроидальной болезни в отдаленный период после операции (10–12 лет) возникают у 8,3–30% пациентов, подвергшихся геморроидэктомии [1]. Достижение радикализма операции Миллигана–Моргана в этих условиях часто невозможно из-за опасности развития рубцового стеноза ануса [12]. В этой ситуации становится понятен возврат интереса хирургов и колопроктологов к такому ранее считавшемуся порочному вмешательству, как операция Уайтхеда (или различных ее модификаций), особенно при циркулярном расположении геморроидальных узлов, а также при сочетании хронического геморроя III–IV стадий с другими заболеваниями анального канала [13, 14]. Эта операция в качестве радикального вмешательства используется в модифицированном современном виде для лечения распространенных форм хронического геморроя IV стадии. Имеются сообщения о сочетании классических оперативных вмешательств при геморрое III–IV стадий с современными, малоинвазивными методиками, такими как дезартеризация, субмукозные инъекции склерозантов в сочетании с ультразвуковой кавитацией, подслизистая диатермокоагуляция кавернозной ткани [15, 17].
В последние годы произошло бурное развитие так называемых малоинвазивных методик лечения хронического геморроя (как правило, применяющихся амбулаторно), в основном являющихся прерогативой частных медицинских структурных подразделений, работающих в режиме хирургии «одного дня». К таким вмешательствам относятся: склерозирование геморроидальных узлов, лигирование геморроидальных узлов латексными кольцами, инфракрасная фотокоагуляция, дезартеризация геморроидальных узлов под контролем ультразвуковой допплерометрии. Большинство этих методов показаны при I–II стадиях геморроя [18–20]. Альтернативой геморроидэктомии по Миллигану–Моргану при III–IV стадиях хронического геморроя может быть использование метода трансанальной дезартеризации внутренних геморроидальных узлов под контролем УЗ-допплерометрии в сочетании с субмукозной лазерной деструкцией, что позволяет сократить время оперативного вмешательства и сроки социальной реабилитации пациентов [21, 22]. Но достаточно высокая стоимость оборудования и расходных материалов ограничивает возможности многих муниципальных бюджетных медицинских учреждений нашей страны. [15]. Также, несмотря на видимые преимущества данного метода, не ясна его надежность в плане отдаленных результатов, о чем свидетельствует отсутствие публикаций, посвященных данному вопросу. К тому же финансирование государственных бюджетных учреждений здравоохранения периферийного звена не предусматривает повсеместного укомплектования больниц современной высокотехнологичной наукоемкой хирургической аппаратурой, работающей на новых принципах, таких как LigaSure, Harmonica, Biolitec и пр. Все вышеизложенное побудило нас поделиться опытом лечения больных с хроническим осложненным геморроем III–IV стадий, прооперированных за последние 6 лет, с точки зрения эволюции воззрений на выбор метода операции в каждом индивидуальном случае, с учетом максимального количества возможных в наших условиях факторов.
Цель работы – провести сравнительный анализ различных способов хирургического лечения геморроя III–IV стадий и оптимизировать выбор метода операции при декомпенсированных стадиях геморроя с учетом: неравномерности стадий выпадения; тотально-сливного характера геморроя; сочетания хронического геморроя с другой аноректальной патологией.
Материал и методы исследования. В основу нашего исследования лег анализ лечения 254 больных с хроническим комбинированным геморроем III–IV стадий, оперированных в 2014–2019 гг. на базе хирургического отделения ГБУЗ РК «Симферопольская ГКБ № 7», являющегося клинической базой кафедры общей хирургии ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского, Медицинская академия им. С.И. Георгиевского». Среди них было 143 (56,3%) женщин и 111 (43,7%) мужчин в возрасте от 18 до 82 лет. Пациентов в возрасте 18–30 лет было 36 человек (14,2%), 31–60 лет – 194 (76,4%), 61–82 лет – 24 (9,4%). Таким образом, большинство пациентов с хроническим геморроем III–IV стадий – 230 человек (90,6%) – лица трудоспособного возраста (18–60 лет).
За период 2014–2016 гг. ко всем больным с III–IV стадиями хронического геморроя (138 человек – мужчин 64 (46,4%), женщин 74 (53,6%)) применялся стандартизированный подход – всем этим пациентам выполнялась геморроидэктомия по Миллигану–Моргану во 2-й модификации НИИ проктологии МЗ России (с ушиванием послеоперационных ран наглухо). В этот промежуток времени не учитывались такие критерии, как: 1) разная стадия выпадения внутренних геморроидальных узлов у одного и того же больного; 2) нередко встречающийся сливной характер геморроидальных комплексов; 3) наличие сопутствующей патологии анального канала (полипа, трещины).
С 2017 г. для пациентов с хроническим геморроем III–IV стадий был пересмотрен подход к выбору оперативных методик лечения этого заболевания. Он предусматривал индивидуально подобранное оперативное вмешательство с учетом следующих факторов: 1) неравномерность стадий выпадения узлов у одного и того же больного; 2) тотально-сливной характер геморроя; 3) сочетание хронического геморроя с другой аноректальной патологией.
За период 2017–2019 гг. различными методиками прооперированы 116 человек: 47 (40,5%) мужчин и 69 (59,5%) женщин.
Все пациенты были обследованы амбулаторно в полном объеме: клинически, лабораторно и эндоскопически. Перед эндоскопическими методами производилось обязательное пальцевое ректальное исследование, которое проводилось у пациентов не только в коленно-локтевой позиции, но и в литотомическом положении. В случае затруднений при определении стадии выпадения внутренних геморроидальных коллекторов пальцевое исследование производилось и сразу после натуживания, в естественном для акта дефекации положении (сидя на корточках). Состояние всех порций наружного, а также внутреннего анального сфинктера (фоновый тонус и волевое напряжение) оценивалось также при пальцевом ректальном исследовании. В исследованиях последних лет [23, 24] показано, что в патогенезе геморроидальной болезни, как и в развитии и поддержании хронической анальной трещины, существенную роль играют сфинктероспазм и особенно гипертонус внутреннего сфинктера, препятствующий нормальному венозному оттоку от внутренних геморроидальных сплетений [25, 26].
Правильному стадированию геморроя способствует обязательная аноскопия как начальный этап эндоскопических методов, при этом предпочтение отдавалось инструменту со скошенным или боковым дистальным окном. Больным до 40 лет с целью обязательного предоперационного обследования проводилась ректороманоскопия, а больным старше 40 лет – фиброколоноскопия.
Ведущей жалобой у всех 254 (100%) пациентов было выпадение внутренних геморроидальных узлов. При этом у 221 человека (87,0%) было выпадение внутренних геморроидальных узлов (или хотя бы одного внутреннего узла), не вправляющихся в анальный канал (IV стадия), а у 33 пациентов (13,0%) наблюдалось периодическое выпадение внутренних геморроидальных узлов, требующее ручного вправления (III стадия хронического геморроя). Также одним из основных симптомов было ректальное кровотечение в виде капель или струйки крови алого цвета поверх каловых масс, наблюдавшееся у 239 человек (93,3%): у 221 пациента с IV стадией и у 18 – с III стадией хронического геморроя. При этом у 23 пациентов (этих же 18 человек с III и у 5 больных с IV стадией хронического геморроя) диагностирована постгеморрагическая анемия с Hb<90 г/л, потребовавшая гемотрансфузий и назначения железосодержащих препаратов. У 58 пациентов (22,8%) в качестве сопутствующей проктологической патологии выявлена хроническая анальная трещина задней (6-часовой) локализации. Из них 17 человек – больные с III стадией, 41 пациент – с IV стадией хронического геморроя. Все 58 человек, помимо выпадения геморроидальных узлов, отметили в качестве ведущей жалобы боли в анальной области, возникающие в конце акта дефекации и сохраняющиеся не менее получаса после него. Из них 15 больных, т.е. каждый четвертый (5,9% от общего числа пациентов) с хроническим геморроем III стадии в сочетании с анальной трещиной, не отметили в числе ведущих жалоб ректальное кровотечение. Трещина у них локализовалась выше аноперинеального перехода и достигала 0,8–1,0 см в диаметре. В то же время 43 пациента, помимо жалоб на выпадение узлов и боли в анальной области после дефекации, в числе ведущих симптомов указали на примесь алой крови к каловым массам. У этих пациентов трещина локализовалась в проекции анокутанного перехода, ее размеры не превышали 0,5–0,6 см в диаметре. В 18 случаях (7,1%), помимо хронического геморроя IV стадии, выявлены крупные полипы анального канала (d>1,0 см), выпадающие за пределы анального кольца. У 23 человек (9,0%) при предоперационном эндоскопическом исследовании выявлены полипы ампулярного или ректосигмоидного отдела (в 17 случаях – одиночные, в 6 наблюдениях – 3 полипа и более, т.е. множественные полипы). 19 пациентам выполнена электроэксцизия полипов с последующей гистологической верификацией (у 15 – аденоматозных полипов, у 4 – тубулярно-ворсинчатых аденом). Итого сочетание хронического геморроя, осложненного выпадениями внутренних узлов III–IV стадий, с другими проктологическими заболеваниями аноректальной зоны выявлено у 99 пациентов (39,0%), а у 76 человек (29,9%) имелось сочетание геморроя с хронической анальной трещиной, а также полипами анального канала, что повлияло на выбор метода оперативного вмешательства.
Результаты исследования и их обсуждение. У 9 (6,5%) пациентов из 138 (за период 2014–2016 гг., когда всем больным производилась геморроидэктомия по Миллигану–Моргану) развился послеоперационный тромбоз остаточной кавернозной ткани. Послеоперационный тромбоз располагался в проекции кожно-анодермальных мостиков (как правило, на 5–6 часах и 12-м – 1-м часу по условному циферблату) и потребовал дополнительных лечебных мер. 4 пациентов (2,9%) в дальнейшем (в сроки от 8 месяцев до 2 лет после геморроидэктомии) пришлось оперировать повторно ввиду эстетического дискомфорта и неоднократных тромбозов остаточной кавернозной ткани. При этом производилось ее иссечение вместе с избытком перианальной кожи и сегментом анодермы. У всех этих 9 человек (6,5%) наблюдался сливной характер выпавших геморроидальных комплексов, несколько менее выраженный по размеру в вышеуказанных промежутках (на 12-м –1-м часу и на 5–6 часах).
У 17 человек (12,3%) из 138 прооперированных в 2014–2016 гг. геморроидэктомией по Миллигану–Моргану наблюдалось отчетливое превалирование размеров одного (в 7 случаях) или двух (в 10 наблюдениях) выпавших геморроидальных комплексов, расцененных как IV стадия хронического геморроя. Оставшиеся два (или один) внутренних геморроидальных узла были значительно меньших размеров и удерживались в просвете прямой кишки после самопроизвольного вправления или пальцевого пособия. Но, поскольку диагноз «хронический геморрой IV стадии» ставился по наиболее увеличенному узлу, превосходящему остальные по стадии выпадения, всем пациентам также выполнялась традиционная геморроидэктомия с глухим швом ран (методика Миллигана–Моргана во 2-й модификации НИИ проктологии МЗ России). При этом у 12 пациентов (8,7%) отмечались стойкий сфинктероспазм и выраженный болевой синдром в течение 4–5 суток из-за раннего прорезывания швов анодермы. Возможно, это осложнение было вызвано избыточным по площади удалением слизисто-анодермальных сегментов вместе с кавернозной тканью, как правило, в проекции геморроидальных узлов стадийностью менее IV стадии (т.е. там, где был сохранен, хотя бы частично, связочный аппарат геморроидальных узлов). Полное заживление ран анодермы происходило у них вторичным натяжением и, как правило, на 10–14 дней позднее, чем у больных, которым был применен индивидуальный подход к выбору метода операции. Восстановление нормального акта дефекации также наступало в среднем на 2 недели позднее.
У 34 пациентов из 138, оперированных в 2014–2016 гг. (24,6%), выявлена сопутствующая патология анального канала: хроническая анальная трещина – у 26 (18,8%) и полип анального канала – у 8 (5,9%) пациентов. Трещины и полипы удалялись у них из отдельных окаймляющих разрезов, проводимых в пределах визуально не измененных тканей. При этом образовавшиеся слизисто-анодермальные раны предпочтительно ушивались в поперечном направлении (по отношению к оси анального канала и прямой кишки). У 7 (5,1%) человек отмечены прорезывание швов и частичная или полная ретракция слизистой с последующим формированием стриктуры в 5 случаях (3,6%), разрешившиеся консервативно (путем многократных пальцевых бужирований), а у 2 пациентов (1,4%) потребовалось повторное оперативное вмешательство – стриктуропластика. У 6 из этих 7 человек до этого были синхронная геморроидэктомия и фиссурэктомия, у 1 – удаление крупного полипа анального канала, локализовавшегося на 5 часах.
Учитывая вышеперечисленные осложнения и принимая во внимание наличие сопутствующей аноректальной патологии, неравномерную стадийность геморроя у одного и того же больного, а также нередко встречающийся сливной характер выпавших геморроидальных комплексов (рис. 1, 2), с целью оптимизации результатов лечения больных с хроническим геморроем нами с 2017 г. был изменен подход к выбору оперативных методик лечения этого заболевания. Учет вышеизложенных факторов предусматривает возможное сочетание видов оперативных вмешательств (таких как закрытая или открытая геморроидэктомия на IV стадийном узле и шовная дезартеризация в сочетании с подслизистой диатермокоагуляцией кавернозной ткани одного или двух узлов, имеющих II стадию заболевания) в течение одного хирургического вмешательства.
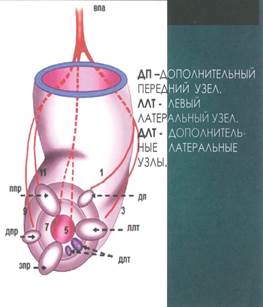
|
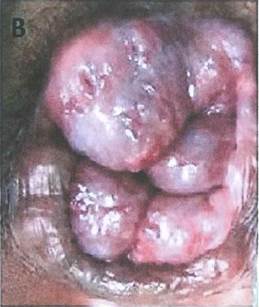
Рис. 1. Анатомическое обоснование добавочных (промежуточных) геморроидальных узлов |
Рис. 2. Внешний вид перианальной области при развитых добавочных геморроидальных узлах |
За период 2017–2019 гг. различными методиками прооперированы 116 человек: 47 (40,5%) мужчин и 69 (59,5%) женщин. Геморроидальные комплексы без четко определяемых границ между узлами наблюдались у 7 (6,0%) человек. При этом у 5 пациентов такая особенность группировки узлов была выражена не тотально, а основной массив выпавшей кавернозной ткани был выражен в сливном виде в промежутке с 3 до 9 часов по условному циферблату. 11-часовой внутренний узел у них был определен на II стадию. Этим больным произведены операция по Уайтхеду в модификации Г. Мухашаврия [23, 24] с 2 сторон с формированием Т-образных послеоперационных ран на 4 и на 8 часах и подслизистая диатермокоагуляция кавернозной ткани внутреннего 11-часового узла после его шовной дезартеризации и лифтинга слизистой (рис. 3, 4) [4].

Рис. 3. Начальный момент геморроидэктомии по Уайтхеду в модификации Г. Мухашаврия
Отсепаровка кавернозных тканей геморроидального узла от подлежащих волокон сфинктера

Рис. 4. Окончательный вид операционной раны после геморроидэктомии по Уайтхеду в модификации Г. Мухашаврия
2 пациентам с тотально-сливным расположением геморроидальных узлов по всему периметру ануса произведена модифицированная операция Уайтхеда в циркулярном варианте с последовательно выполненной отсепаровкой правого и левого анодермально-слизистых лоскутов, подслизистым прецизионным удалением кавернозной ткани узлов с лигированием питающей артерии в глубине раны и безнатяжным укладыванием отсепарованных лоскутов, освобожденных от кавернозных структур, на прежнее место с подшиванием их к перианальной коже отдельными швами (рис. 5, 6). Особенностью данной модификации геморроидэктомии является оставление нетронутыми кожно-слизистых «мостиков» до 1,5 см шириной на 12 и на 6 часах в проекции фасциальных узлов промежности [26].
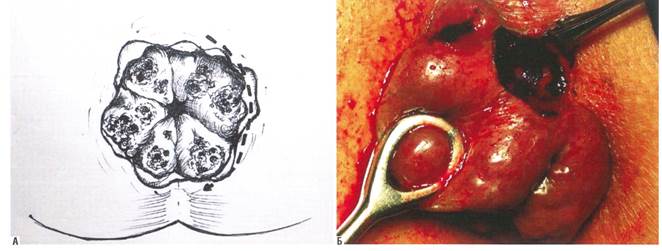
Рис. 5. Начало отсепаровки полуокружности анодермы с геморроидальными комплексами по Уайтхеду в модификации С.Я. Ивануса
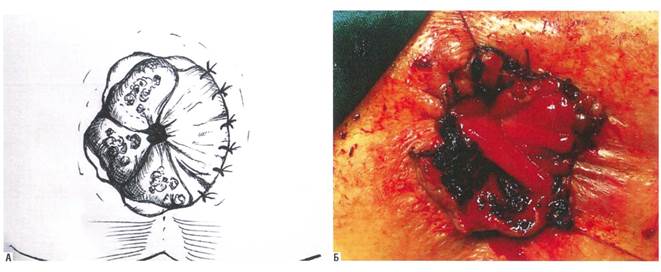
Рис. 6. Подшивание лоскута анодермы, освобожденной от кавернозной ткани, к перианальной коже (геморроидэктомия по Уайтхеду в модификации С.Я. Ивануса)
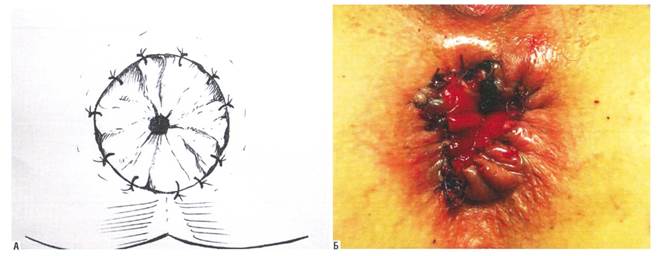
Рис. 7. Финальный вид операционной раны геморроидэктомии по Уайтхеду в модификации С.Я. Ивануса
Выбор данных методик у больных со сливным характером геморроидальных комплексов позволил избежать послеоперационного тромбоза ввиду максимально возможного удаления кавернозной ткани. Также не был выражен перианальный отек и имел значительно меньшую интенсивность по сравнению с методикой Миллигана–Моргана послеоперационный болевой синдром, что объясняется циркулярно-перианальным, а не радиарным расположением операционных разрезов при вышеуказанных методиках операции Уайтхеда, в основном по анокутанной линии (рис. 7). Данное обстоятельство сводит к минимуму возможность механической травматизации швов при дефекации и снижает риск инфицирования послеоперационных ран.
У 42 (36,2%) из 116 пациентов, прооперированных в 2017–2019 гг., выявлена сочетанная с хроническим геморроем патология анального канала: у 10 человек (8,6%) – крупные анальные полипы, у 32 больных (27,6%) – хроническая анальная трещина. Во всех случаях как полипы анального канала, так и трещины сочетались с «классическим», сгруппированным сообразно 3, 7 и 11 часам по условному циферблату характером расположения геморроидальных комплексов. При этом у 4 из 10 пациентов полип удален вместе с «7-часовым» узлом единым блоком, а в 6 случаях потребовалось отдельное от геморроидэктомии иссечение полипа с сектором визуально не измененной анодермы. Также с «7-часовым узлом» удалена трещина анального канала у 7 из 32 больных с сочетанием задней анальной трещины и хронического геморроя. У 6 пациентов с сочетанием: геморрой + анальный полип и у 25 больных с сочетанием: геморрой + трещина для закрытия обширного раневого дефекта передней или задней стенки анального канала использовался выкроенный из избыточной кожи 7- или 11-часового наружного геморроидального узла фрагмент треугольной формы на питающей кожно-подкожно-жировой ножке, перемещенный верхушкой в анальный канал (рис. 8). Следование данной методике позволило избежать натяжения тканей, сужения заднего прохода и, в дальнейшем, образования стриктуры, поскольку операция предполагает достаточную мобилизацию и безнатяжную фиксацию встречных лоскутов: кожного и слизисто-анодермального.
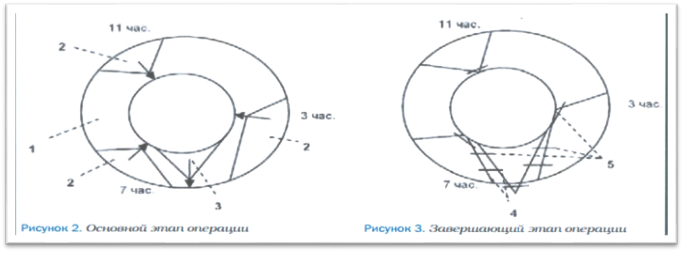
Рис. 8. Геморроидэктомия при сочетании хронического геморроя III–IV стадий с крупным полипом анального канала или хронической анальной трещиной [12]
19 человек из 116 (16,4%) имели разную стадийность выпадения внутренних геморроидальных узлов, но при этом их «классическую» 3-лепестковую компоновку на 3, 7 и 11 часах по условному циферблату. У 4 пациентов IV стадии выпадения соответствовал только один геморроидальный комплекс (во всех этих случаях – «11-часовой»). У 15 человек IV стадия выпадения пришлась на комбинацию узлов 3 и 7 часов (6 пациентов) и 7 и 11 часов (9 больных). В этих случаях оставшиеся 1 или 2 узла имели стадию выпадения II во всех 19 наблюдениях. Традиционная закрытая геморроидэктомия, произведенная на IV- стадийных узлах (2-я модификация НИИ проктологии РФ методики Миллигана–Моргана) у данных пациентов сочеталась с шовным лигированием – дезартеризацией 1 или 2 узлов, имеющих II стадию выпадения, и подслизистой диатермокоагуляцией кавернозной ткани этих же узлов через микропрокол кожи (до 0,3 см в диаметре), произведенный на уровне ано-перинеального перехода. Кровотечение из прокола кожи после электродеструкции кавернозной ткани предупреждалось трансмукозным наложением 1–2 Х-образных швов на проекцию этого узла.
Такое сочетание методик оперативного воздействия при неравномерной стадийности выпадения внутренних геморроидальных узлов позволило избежать избыточного по площади иссечения анодермы при удалении внутреннего узла с еще сохраненными (пусть и частично) связочными структурами. При этом не страдала радикальность операции, но был минимизирован послеоперационный болевой синдром, значительно уменьшена операционная травма за счет сокращения площади раневых дефектов. Исключено натяжение тканей ввиду оставления нетронутой не задействованной в декомпенсированном выпадении узлов анодермы, что привело к снижению риска прорезывания швов и ретракции слизистой. Ни одного случая несостоятельности и расхождения слизисто-анодермальных швов, а также развития послеоперационных стриктур в результате ретракции слизистой с формированием длительно незаживающих ран, вынужденно заживающих вторичным натяжением, у этих 19 пациентов мы не наблюдали.
Таким образом, при выборе метода хирургического лечения геморроя у каждого конкретного пациента должны учитываться преимущества и недостатки того или иного способа оперативного вмешательства и местные клинико-анатомические особенности процесса.
Выводы
1. В структуре пациентов с хроническим геморроем, обратившихся за стационарной хирургической помощью, преобладают больные с IV стадией геморроя (87% в нашем наблюдении), что диктует необходимость максимально радикального удаления кавернозной ткани и, по возможности, восстановления разрушенных связочных структур геморроидальных сплетений. Геморроидэктомия по Фергюссону (или Миллигану–Моргану во 2-й модификации НИИ проктологии МЗ России) при ее классическом исполнении на всех 3 коллекторах, без учета целого ряда факторов (таких как разная стадийность внутренних узлов у одного и того же пациента, сливной характер геморроидальных сплетений, наличие сопутствующей патологии анального канала) не всегда сочетает радикализм с полноценным функциональным результатом.
2. При неравномерно выраженной стадийности внутренних геморроидальных узлов (1 или 2 узла IV, а остальные – III или II стадии) целесообразно выполнение геморроидэктомии по Фергюссону (или Миллигану–Моргану во 2-й модификации НИИ проктологии МЗ России) на IV-стадийном узле и шовного лигирования (дезартеризации) в сочетании с подслизистой диатермокоагуляцией кавернозной ткани оставшихся 1 или 2 узлов с меньшей стадийностью (поскольку хотя бы частично сохранены связочные структуры этих узлов).
3. При сливном характере выпавших геморроидальных комплексов для достижения радикальности оперативного вмешательства допустимо применение современной модификации операции Уайтхеда. Так, при односторонней группировке внутренних узлов выполняется операция «геми»-Уайтхеда–Мухашаврия (2001 г.) с формированием T-образных операционных ран и подслизистой диатермокоагуляцией отдельно расположенного узла. При 2-сторонней тотально-сливной локализации геморроидальных узлов показана модификация геморроидэктомии по Уайтхеду–Ивануса (С.Д. Ивануса с соавт., 2014 г.) с оставлением нетронутыми 2 кожно-слизистых «мостиков» до 1,5 см шириной на 12 и 6 часах по условному циферблату.
4. Наличие у пациентов сочетанной с хронических геморроем патологии анального канала (в нашем наблюдении – анального полипа или хронической трещины) в случае одномоментной геморроидэктомии и удаления анального полипа или трещины ведет к увеличению операционной травмы. Для закрытия обширного раневого дефекта анального канала возможно использование треугольного лоскута на питающей кожно-подкожно-жировой ножке, выкроенного из избыточной кожи 7- или 11-часового геморроидального узла [12].



