Ежегодно отмечается увеличение детского травматизма. Так, по данным ВОЗ, количество регистрируемых случаев с черепно-мозговой травмой (ЧМТ) растет на 1–2%. Несмотря на все достижения медицины, улучшение качества оказания медицинской помощи, на сегодняшний день ЧМТ является важной проблемой из-за своей распространенности, высокой частоты летальности и инвалидизации пострадавших [1]. Частота переломов костей черепа составляет около 27%, причем 2/3 из них – закрытая ЧМТ [2–4].
На сегодняшний день вдавленные переломы черепа у детей, требующие хирургической обработки, представляют наибольший интерес для практикующих нейрохирургов. Вдавленный перелом черепа – это нарушение его целостности вследствие травматического воздействия, вызывающее его деформацию и смещение осколков, что оказывает очаговое объемное воздействие на структуры мозга. Около половины вдавленных переломов приходится на детский возраст [5, 6]. Вдавленные переломы не относятся к самостоятельной клинической форме ЧМТ, тем не менее, необходимы правильный выбор диагностической тактики, а также адекватно спланированное своевременное лечение.
Некоторые вдавленные переломы сопровождаются повреждением кожных покровов, создавая высокий риск развития инфекционного процесса [7]. Следовательно, необходимо выполнить обработку вдавленного перелома как можно раньше, до 48 ч, с целью минимизации риска развития гнойных осложнений [7]. При проведении оперативной коррекции в указанный срок риск развития инфекционных осложнений не превышает 5% [7].
Необходимо учитывать, что, помимо характера перелома, на тяжесть состояния ребенка и исходы лечения влияют:
1) возраст пострадавшего (чем меньше возраст ребенка, тем тяжелее протекает ушиб головного мозга; у детей младшего возраста зарегистрирована высокая летальность) [8];
2) локализация зоны повреждения (на исходы неврологического дефицита влияют повреждения функционально значимых зон головного мозга);
3) глубина, размеры распространения осколков перелома черепа, степень сдавления паренхимы головного мозга осколками;
4) повреждение крупных сосудов твердой мозговой оболочки (чаще опасность несет повреждение средней менингеальной артерии, которое приводит к развитию эпидуральной гематомы) и/или корковых сосудов головного мозга (опасность повреждения в зоне Сильвиевой щели, в области синуса, парасинусных лакун, повреждения дренирующих крупных поверхностных вен Лаббе и Троларда);
5) первичное состояние больного, уровень сознания, наличие травматического шока.
Рассматривая диагностику черепно-мозговой травмы, сопровождающейся наличием вдавленного перелома черепа, необходимо сказать, что не все переломы четко визуализируются на краниограммах: они могут выглядеть на рентгенограммах как линейные переломы. Золотым стандартом в диагностике данного вида травмы является компьютерная томография. По результатам проведенного РКТ-исследования можно спланировать тактику оперативной коррекции, определить наличие кровотечения, исключить/подтвердить сочетанное повреждение головного мозга при вдавленных переломах (травматическое САК, очаги ушиба и т.д.), выявить в полости черепа инородные тела.
Суть хирургической техники в лечении вдавленного перелома черепа заключается в устранении сдавления костными отломками паренхимы головного мозга [9]. Показаниями к хирургической коррекции вдавленного перелома являются углубление в полость черепа осколков на глубину 5,0–10,0 мм, а также наличие выраженного косметического дефекта (в проекции лобной кости).
Цель работы: улучшить результаты лечения пациентов с черепно-мозговой травмой путем разработки нового способа обработки вдавленного перелома черепа у детей.
Материал и методы исследования. С 2015 по 2020 гг. в ГБУ РО «Областная детская клиническая больница» г. Ростова-на-Дону в нейрохирургическом отделении выполнялось оперативное лечение по поводу приобретенных нарушений целостности костей черепа 80 пациентам.
Оперированные дети разделены на 2 группы.
1-я группа – 30 пациентов, которым проводилась оперативная коррекция вдавленных переломов костей свода черепа по разработанной методике (патент № 2017143056 от 12.08.2017 г.).
2-я группа (группа сравнения) – коррекция выполнялась в отдаленном периоде черепно-мозговой травмы, проводилась краниопластика костного дефекта как второй этап хирургического лечения. В качестве материала для замещения дефекта использовалась титановая пластина. Первым этапом в остром периоде черепно-мозговой травмы пострадавшим ранее по медицинским показаниям выполнялась декомпрессивная/резекционная краниотомия. Общее число пациентов, вошедших в данную группу, составило 50 детей.
В данной статье будет рассматриваться только первая группа пациентов, имеющих вдавленный перелом костей свода черепа.
Анатомически локализация повреждений свода черепа составила: 12 пациентов (40%) – теменная кость, 8 (26,6%) – височная кость, 8 (26,6%) – лобная, 2 (6,8%) – затылочная кость (рис. 1).
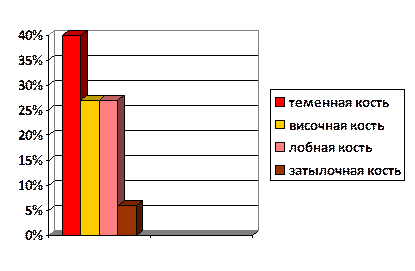
Рис. 1. Анатомическая локализация повреждений свода черепа
Средний возраст пациентов составил 8,5 года. По характеру повреждений: закрытая черепно-мозговая травма была выявлена у 5 пациентов (16,6%), открытая непроникающая ЧМТ – у 18 (60%), открытая проникающая ЧМТ – у 7 (23,4%) (рис. 2).

Рис. 2. Распределение пациентов по характеру повреждений свода черепа
Преобладающей причиной формирования ЧМТ, а именно вдавленного перелома, служила бытовая травма – 27 (90%), результат ДТП – у 3 пациентов (10%).
У всех больных наблюдалась выраженная общемозговая симптоматика, уровень сознания оценивался по шкале Глазго: 15 баллов, ясное сознание наблюдалось у 5 больных; 13–14 баллов, оглушение I степени – у 21 пострадавшего; 11–12 баллов, оглушение II степени – у 4 детей.
Наибольший костный дефект, который был прооперирован по разработанной методике, составил вдавленный перелом размерами 6,5х5,5 см, наименьший – 2,0х3,0 см.
Всем пострадавшим в качестве верификации диагноза проводилось РКТ-исследование головы (рис. 3).




Рис. 3. РКТ-исследование до хирургической коррекции вдавленного перелома. Указателем показан оскольчатый вдавленный перелом теменной кости справа, визуализировано выраженное сдавление осколками паренхимы головного мозга
Показаниями к оперативному лечению были: углубление в полость черепа осколков на глубину от 5,0 до 10,0 мм, косметический дефект. Хирургическое вмешательство всем детям проводилось не позднее 48 ч с момента получения травмы.
Все статистические процедуры проводили с использованием пакета прикладных программ Stаtisticа 10.0 (StаtSоft, США), Excel 8,0. Сравнение количественных данных выполнено с помощью t-критерия Стьюдента (для независимых выборок) и критерия Манна–Уитни (при работе с малыми величинами). При сравнении качественных показателей использовали точный критерий Фишера. Статистически значимыми считали различия при p<0,05.
Результаты исследования и их обсуждение. На сегодняшний день в литературе можно встретить неоднозначные решения проблемы вдавленных переломов. Одни авторы разделяют оперативное вмешательство на этапы. Первым этапом удаляют костные отломки, осуществляют хирургическую обработку перелома. Второй этап, после стабилизации состояния, заключается в выполнении краниопластики костного дефекта. В медицинской литературе встречается описание методики одновременного проведения хирургического пособия в виде удаления осколков с последующим замещением костного дефекта (аутотрансплантатом/аллотрансплантатом) [9]. Удаление костных отломков в отсутствие проведения одномоментной пластики поврежденного участка костного фрагмента черепа в дальнейшем приводит к формированию у пациента синдрома «трепанированного черепа» [10]. Указанный синдром включает в себя наличие головных болей, возникающих и/или усиливающихся при изменении атмосферного давления, температуры окружающей среды, появление тошноты, сопровождающейся рвотой, пролабированием содержимого черепа в дефект при физическом напряжении, при кашле и т.п. Помимо данного синдрома, у больных высок риск развития эпиприступов, а также развития в детском возрасте чувства неполноценности за счет выраженного косметического дефекта.
С целью снижения риска вышеописанных ситуаций костный дефект необходимо заместить, т.е. закрыть и восстановить целостность черепной коробки. В литературе широко представлены положительные и отрицательные стороны каждого материала, используемого для проведения краниопластики. Так, например, в настоящее время приобрело наибольший интерес применение гидроксиапатита как материала для краниопластики. Его преимуществом считается уникальный состав, который включает кальций и фосфат, что делает материал наиболее биологически совместимым с организмом [12]. Однако хрупкость, сложность обработки и моделирования являются главными причинами ограничения показаний к его использованию [13]. Известны способы краниопластики с использованием металлических имплантов. Наибольшее распространение получил титан, обладающий прочностью и хорошей моделируемостью. К недостаткам материала можно отнести высокую стоимость, отсутствие адекватной фиксации у детей с небольшой толщиной кости, сложность моделирования у детей дошкольного возраста; продолженный рост черепа может потребовать замены титановой пластины, что приведет к повторной оперативной коррекции [14, 15].
Всем необходимым требованиям (биосовместимость, минимальный риск инфекционных осложнений, пластичность, совместимость с методами нейровизуализации, устойчивость к механическим нагрузкам, низкий уровень тепло- и электропроводности, приемлемая стоимость, отсутствие канцерогенного эффекта) соответствует только способ, основанный на аутотрансплантации.
Пациенты основной группы прооперированы предлагаемым нами способом (патент РФ № 2683067 от 26.03.2019 г.). Методика заключается в следующем: выполняется дугообразный (подковообразный) кожный разрез, производится отсепаровка мягких тканей (по нейрохирургическому стандарту). На расстоянии 0,5 см от выявленной зоны вдавления в безопасной зоне (вдали от синусных стоков, пазух и т.д.) производится фрезевое отверстие диаметром 0,7 см, полученная костная стружка сохраняется. С помощью костных кусачек проводится резекция кости до области вдавленного перелома. Такой способ выполнялся с целью минимизировать риск ятрогенного повреждения структур головного мозга при непосредственном первоначальном устранении зоны вдавления. После этого с помощью костных кусачек выполняется поэтапное устранение импрессии путем удаления костных фрагментов травмированного участка свода черепа. Все костные фрагменты независимо от размеров сохраняются, помещаются в емкость с физиологическим раствором. Мелкие костные фрагменты и костная стружка выкладываются на влажную салфетку, предварительно смоченную в физиологическом растворе. В области полученного костного дефекта (трепанационного отверстия) тщательно проводится гемостаз: дефект высушивается аспиратором и марлевыми салфетками. Далее по размеру трепанационного отверстия формируют подходящий размер гемостатической губки «Тахокомб»; если костный дефект получился большим, используют несколько губок. Гемостатическая губка орошается физиологическим раствором либо свежезамороженной плазмой, после этого равномерно распределяется целиком в сформированном костном ложе, желтой поверхностью к твердой мозговой оболочке. С помощью сухой салфетки губку осушают до полного высыхания, достигая ее прочной фиксации с твердой мозговой оболочкой. Следующим этапом по всей поверхности первой гемостатической губки «Тахокомб» равномерно распределяют ранее удаленные костные фрагменты отломков, предварительно просушенные сухой салфеткой (вначале крупные фрагменты, а потом мелкие). Закрытие всей поверхности костного дефекта завершают покрытием костной стружкой (рис. 4).

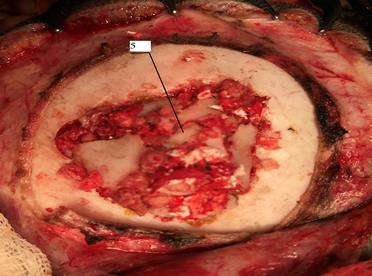
Рис. 4. На ранее наложенную гемостатическую губку «Тахокомб» укладывают сохраненные костные отломки, равномерно покрывая образованный костный дефект (см. указатель)
Далее берется вторая гемостатическая губка, ее размеры определяются таким образом, чтобы края перекрывали костный дефект на 0,5 см. Она также орошается и накладывается уже во влажном состоянии желтой поверхностью на костные фрагменты. После этого губка высушивается (рис. 5).
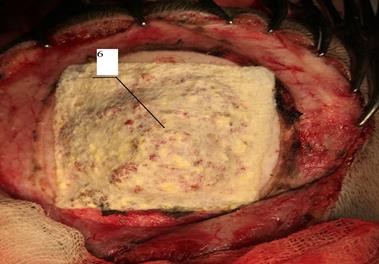
Рис. 5. Поверх костной стружки укладывают вторую гемостатическую губку «Тахокомб»
Послойно ушивают операционную рану. Накладывают асептическую повязку. У всех прооперированных детей основной группы отмечалось удовлетворительное заживление послеоперационной раны. Признаков пиемических реакций не отмечалось ни в раннем, ни в позднем послеоперационных периодах. Все пациенты выписаны в удовлетворительном состоянии, без неврологического дефицита. В ходе динамического исследования (РКТ-контроля) отмечается восстановление целостности свода черепа (рис. 4, 5).



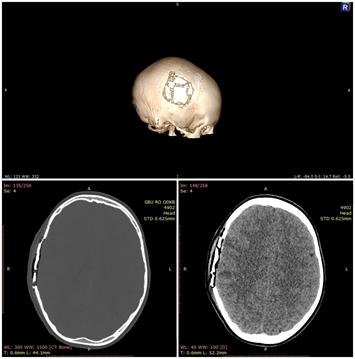
Рис. 6. РКТ-исследование через сутки с момента выполненной операции. Указатели демонстрируют тотальное устранение импрессии осколками вдавленного перелома на паренхиму головного мозга и восстановление целостности черепной коробки


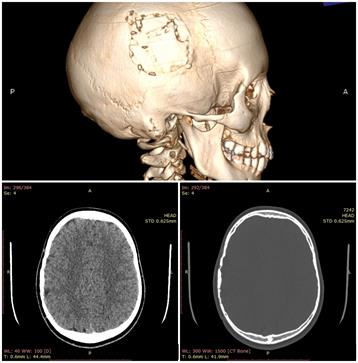
Рис. 7. РКТ-исследование через 6 месяцев. Указателем показаны восстановление целостности теменной кости, удовлетворительная консолидация осколков, сохранение анатомических изгибов черепа
Среди пациентов второй (контрольной) группы пиэмическая реакция отмечалась у 1 больного (3%), формирование пролежня в области импланта – у 4 пациентов (13%). Срок госпитализации составил 13 дней. Все дети выписаны в удовлетворительном состоянии.
Достаточная фиксация костных отломков в предлагаемой нами методике осуществляется за счет активных веществ гемостатической губки «Тахокомб», а именно фибриногена и тромбина, благодаря которым данный материал обладает мощными клеящими свойствами. За счет сохранения целостности твердой мозговой оболочки, наличия плотного кожно-мышечного лоскута и клеящих свойств губки создается дополнительный фиксирующий каркас. Гемостатическая губка «Тахокомб» не участвует, на наш взгляд, в процессе консолидации, а выступает в роли фиксирующего материала (данное утверждение пока не доказано, основано на клиническом опыте авторов). Стоит отметить, что стоимость гемостатической губки «Тахокомб», используемой во время операции, практически идентична стоимости титановой пластины. Однако при краниопластике с использованием титановых пластин в затраты также входят стоимость ее стерилизации, стоимость необходимого для ее установки оборудования, стоимость фиксирующих элементов (краниофиксов, винтов), а также стоимость общей анестезии при проведении второго этапа операции и лекарственных препаратов, используемых в послеоперационном периоде. Данные факты значительно увеличивают общую стоимость двухэтапной краниопластики с использованием титановых пластин по сравнению с разработанным нами одноэтапным методом. Период наблюдения за пациентами основной группы составлял 5 лет. При динамическом обследовании пациентов основной группы, в первую очередь, мы руководствуемся осмотром больных. Если на фоне удовлетворительных результатов КТ-граммы, выполненной ранее, пальпаторно у ребенка не определяются флюктуация, деформация в области операции, отсутствует болезненность, отмечается удовлетворительное формирование рубца, то дальнейшее выполнение компьютерной томографии, на наш взгляд, выполнять нецелесообразно из-за высокой дозы лучевой нагрузки на ребенка и отсутствия показаний для проведения исследования. Из вышеизложенного можно сделать вывод, что разработанный способ имеет ряд преимуществ: одноэтапность операции, минимальный риск пиэмических осложнений, а также удовлетворительное восстановление целостности черепной коробки больного (табл.).
Сравнительная характеристика разработанного способа (разница между группами статистически достоверна, р<0,05)
|
|
Одноэтапный метод (по разработанной методике) n=30 |
Двухэтапный метод n=50
|
|
Средний койко-день госпитализации |
10,4±0,3 |
13,6±0,4 |
|
Пиэмические осложнения |
Не было |
3 случая (6%) – удаление пластины с последующим повторным ее установлением |
|
Пролежень с кожным дефектом |
Не было |
5 случаев (10%) – что также требовало реоперации, либо замены пластины, либо проведения кожной пластики по Лимбергу |
|
Наличие артефактов, выявленных при лучевой диагностике |
Нет |
Есть |
Заключение. Разработанный способ обработки вдавленного перелома черепа у детей технически прост, не является затратным, позволяет одномоментно выполнить устранение сдавления осколками черепа паренхимы головного мозга и восстановить целостность свода черепа, не требует специализированной аппаратуры, минимизирует риск послеоперационных осложнений, что позволяет улучшить результаты лечения и качество жизни пациентов с черепно-мозговой травмой.



