Эндопротезирование – распространенный высокоэффективный метод лечения дегенеративных заболеваний крупных суставов верхних и нижних конечностей, который широко используется в стационарах РФ. Несмотря на применение современных антисептических и антибактериальных средств, усовершенствованных металлоконструкций и техники оперативного вмешательства, частота развития имплант-ассоциированной и перипротезной инфекций остается неизменной [1]. Перипротезная инфекция (ППИ) как осложнение эндопротезирования является второй по частоте причиной ревизии эндопротезов тазобедренного сустава, а ее частота составляет около 1% после первичных вмешательств и до 4% после ревизионных операций.
Представители рода Staphylococcus являются одними из основных возбудителей ортопедической инфекции с широким набором факторов патогенности. Наиболее проблемными и затратными для лечения являются инфекции, вызванные метициллин-резистентными S. aureus (MRSA). Несмотря на высокую природную чувствительность стафилококков к подавляющему большинству антибиотиков, антибактериальная терапия ППИ может представлять серьезную проблему из-за формирования биопленок на поверхности имплантатов и механизмов антибиотикорезистентности [1], именно поэтому в современных условиях необходима разработка новых альтернативных методов борьбы с инфекционными агентами. Кроме того, S. aureus характеризуются разнообразными механизмами персистенции, включая секретируемые токсины, способностью уклоняться от иммунной системы макроорганизма и развитием устойчивости к противомикробным препаратам. В результате этих высокоразвитых патогенных механизмов персистенции клинические рецидивы ортопедической инфекции, вызванной S. aureus, остаются значимой проблемой.
В профилактике развития любой имплант-ассоциированной инфекции ключевым моментом является предупреждение микробной адгезии и формирования микробного очага. При первичном эндопротезировании «первая линия обороны» – это антибактериальные препараты в качестве периоперационной антибиотикопрофилактики. Кроме того, некоторые исследователи рекомендуют применение антибиотиков в составе костного цемента, которым фиксируют компоненты эндопротеза, что, по их мнению, обеспечивает первоначальный защитный барьер против инфицирования эндопротезов.
С 1970 г. в качестве локальной антибактериальной терапии при различной ортопедической патологии используют костный цемент на основе полиметилметакрилата с добавлением гентамицина. Применение спейсеров, состоящих из костного цемента с гентамицином, в течение периода проведения локальной антибиотикотерапии в области тазобедренного сустава в большинстве случаев позволяет предупредить развитие инфекционного процесса [2, 3]. Причиной развития данного осложнения в большинстве случаев является интраоперационное инфицирование.
Для местной профилактики и лечения инфекционных осложнении? используют добавление антибиотиков группы аминогликозидов, в частности гентамицина и тобрамицина, в костный цемент, который применяют для фиксации компонентов эндопротезов у пациентов с остеопорозом, или в качестве антимикробных спейсеров для замещения дефектов костной ткани при лечении перипротезной инфекции и остеомиелита [2–4]. При этом, как правило, гентамицин является компонентом официнального костного цемента, а тобрамицин добавляют ex temporo при интраоперационном изготовлении спейсеров. Однако, несмотря на доказанную эффективность метода, возникновение ППИ остается серьезной проблемой в лечении ортопедических пациентов [5]. Для корректной локальной терапии ППИ необходимы своевременная диагностика и четкая стратегия лечения с учетом возможной резистентности возбудителя к антибактериальным препаратам.
Аминогликозиды обладают широким спектром действия, эффективны против грамположительных и грамотрицательных бактерий. Основным механизмом устойчивости у бактерий к аминогликозидам является продукция аминогликозидомодифицирующих ферментов (АМФ) [6]. Модифицированные молекулы антибиотика теряют способность связываться с рибосомами и подавлять биосинтез белка. Определенное клиническое значение имеет распространение среди грамположительных бактерий бифункционального фермента ААС(6')-APH (2''), разрушающего большинство клинически значимых аминогликозидов (кроме стрептомицина и спектиномицина) [7]. Гены АГМФ локализуются на мобильных генетических элементах, что обусловливает их быстрое распространение. Устойчивость к гентамицину является маркером наличия этого фермента у конкретного штамма, так как другие ферменты, распространенные среди грамположительных бактерий, не инактивируют этот антибиотик [7].
В литературе все чаще встречаются сообщения о повышении устойчивости грамположительных кокков к аминогликозидам и неэффективности цемента, импрегнированного аминогликозидами, при двухэтапной ревизии [8]. В свою очередь, гены устойчивости к антибиотикам, такие как mecA, vanA, blaOXA и другие, давно используются в качестве маркеров фенотипической устойчивости в анализах на основе ПЦР [9]. Аналогичные тест-системы с возможностью определения детерминант резистентности к аминогликозидам помогут клиницистам в момент выбора антибактериального препарата в составе спейсера для эффективной местной терапии ППИ.
Цель исследования – оценить наличие и распространенность генов и их ассоциаций, кодирующих аминогликозидомодифицирующие ферменты, у штаммов S. aureus с фенотипической устойчивостью к аминогликозидам, выделенных от пациентов с ортопедической инфекцией.
Материалы и методы исследования
Микробиологические методы. Выполнено исследование 268 культур S. aureus, выделенных от пациентов с имплантат-ассоциированной инфекцией, из них 59,7% (n=160) – с перипротезной инфекцией. Изоляты были извлечены из биопленок, сформированных патогенами на поверхности имплантатов, и интраоперационных тканевых биоптатов. Наличие плазмокоагулазы у тестируемых штаммов изучали с использованием сухой кроличьей плазмы («Микроген», Россия). Видовую идентификацию осуществляли на панелях Microlatest («Erba Lachema») с помощью iEMS Reader MF («Labsistems», Финляндия). Антибиотикочувствительность изолятов изучали диско-диффузионным методом, в соответствии с требованиями EUCAST [10]. Для этого взвесь суточных культур S. aureus в стационарной фазе роста наносили ватным тампоном на поверхность агара Мюллера–Хинтона (МХА) и через 5 мин вносили диски с гентамицином (нагрузка 10 мкг), амикацином (30 мкг) и тобрамицином (10 мкг) производства «Oxoid» (Великобритания). Чашки инкубировали при 35оС 18–24 ч и оценивали зону задержки роста в миллиметрах [10].
Молекулярно-генетические методы. Бактериальную ДНК выделяли с использованием набора «S-Sorb» («Синтол», Россия) и измеряли с использованием набора Qubit DNA на флуорометре «Qubit 3.0» («Thermo Fisher Scientific», США) в соответствии с инструкциями производителя. ПЦР проводили на амплификаторе «CFX96 Touch» («Bio-Rad», США) с использованием реагентов производства компании «Синтол» (Россия). Реакционный объем составлял 25 мкл. Параметры циклирования: 95ºC в течение 3 мин и 33 цикла в 3 последовательных этапа: 95ºC в течение 10 с, 55ºC в течение 15 с и 72ºC в течение 15 с. Праймеры были разработаны с использованием программного обеспечения Primer-BLAST (табл. 1). Конечные продукты ПЦР визуализировали в 1,0%-ном агарозном геле, окрашенном этидиум бромидом.
Таблица 1
Последовательности праймеров, использованных в работе
|
Ген |
Направление и последовательность праймера (5'→3') |
Размер продукта, п.н. |
|
|
aac(6’)-Ie/aph(2”) |
Прямой |
TGCCACACTATCATAACCAC |
102 |
|
Обратный |
GCCACAAATGTTAAGGCAAT |
||
|
aac |
Прямой |
CATGGCAAGCTCTAGGATT |
323 |
|
Обратный |
GGCTGAGTTTATGGAAGAAG |
||
|
ant(4’)-Ia |
Прямой |
GTTTGGGCTTCTACCGATTT |
121 |
|
Обратный |
CTCAGGTGGAATCAGATTGG |
||
|
ant1 |
Прямой |
GGTGGTTTACGCATTAACAG |
479 |
|
Обратный |
TCACCAGTAGTCACTGTTTG |
||
Статистический анализ. Данные анализировали при помощи критерия Фишера (F-тест) с использованием программного обеспечения GraphPad Prism 6.0. Статистически значимыми принимали значения p менее 0,05.
Результаты исследования и их обсуждение. В исследование были включены 268 культур, выделенных от пациентов с имплант-ассоциированной и перипротезной инфекциями, а также остеомиелитом. Из 268 изолятов S. aureus, выделенных от пациентов ортопедического профиля, 58,6% (n=157) были резистентны к цефокситину (MRSA), 41,4% (n=111) – чувствительны (MSSA).
Анализ чувствительности выделенных бактериальных культур к аминогликозидам показал, что 75,8% штаммов MRSA (n=119) демонстрировали устойчивость к гентамицину и тобрамицину, 24,2% (n=38) – чувствительность. 65,0% (n=104) и 6,3% (n=10) штаммов были устойчивыми и умеренно резистентными к амикацину соответственно. Чувствительностью к амикацину характеризовались 28,7% изолятов MRSA (n=45) (р<0,0001). Одновременная устойчивость ко всем трем антибиотикам была выявлена только у 28% штаммов MRSA (n=44). Среди штаммов MSSA только три были устойчивы к гентамицину и тобрамицину, два штамма – к амикацину.
Ранее Campoccia et al. продемонстрировали, что частота встречаемости гена aac(6’)-Ie/aph(2”) у изолятов S. epidermidis, выделенных от пациентов ортопедического профиля, составила 44% [11]. Авторы также сообщили о снижении (7%) распространенности ant (4’)-Ia среди культур, выделенных от пациентов с имплантат-ассоциированной инфекцией.
В своем исследовании B. Fatholahzadeh et al. показали, что чувствительность штаммов MRSA составила: канамицин 97%; тобрамицин 96%; энтамицин 87%; амикацин 93%. Наиболее распространенными генами аминогликозидомодифицирующих ферментов были aac(6')-Ie-aph (2'') (83%) и ph(3')-IIIa (71%). Сосуществование трех генов AMФ обнаружено в 21% случаев. Наименее часто у изолятов регистрировали ген ant(4')-Ia. Полученные результаты согласовались с результатами тестирования чувствительности данных культур MRSA к аминогликозидам диско-дифузионным методом [12].
В нашем исследовании ген aac(6’)-Ie/aph(2”) был выявлен у 45,5% штаммов S. aureus (n=122), гены aac и ant1 – у 27,2% (n=73) и 18,3% (n=49) соответственно. Ген ant(4’)-Ia обнаружен не был.
Процент изолятов, содержащих в своем геноме гены АМФ, был существенно выше среди штаммов MRSA по сравнению со штаммами MSSA: aac(6’)-Ie/aph(2”) –75,8% (n=119) против 2,7% (n=3) (p<0,0001), aac – 45,9% (n=72) против 0,9% (n=1) (p<0,0001), ant1 – 23,6% (n=37) против 10,8% (n=12) (p=0,01) соответственно (табл. 2). Высокая распространенность генов, кодирующих АМФ, может быть объяснена их ключевой ролью в резистентности к аминогликозидам [13].
Таблица 2.
Частота встречаемости генов аминогликозидомодифицирующих ферментов
среди S. aureus (%)
|
Ген АМФ |
MRSA (n=157) |
MSSА (n=111) |
p |
|
aac(6’)-Ie/aph(2”) |
75,8 |
2,7 |
<0,0001 |
|
aac |
45,9 |
0,9 |
<0,0001 |
|
ant1 |
23,6 |
10,8 |
=0,01 |
Анализ данных о присутствии генов АМФ у исследованных штаммов S. aureus в зависимости от их чувствительности к гентамицину, тобрамицину и амикацину позволил выявить сильную взаимосвязь между наличием гена aac(6’)-Ie/aph(2”) и их устойчивостью к гентамицину и тобрамицину.
Так, ген aac(6’)-Ie/aph(2”) присутствовал в геноме всех изученных S. aureus, устойчивых к гентамицину и тобрамицину, и не был детектирован ни у одной бактериальной культуры, чувствительной к данным антибиотикам. В то же время в отношении амикацина результаты для данного гена были менее однозначными: ген aac(6’)-Ie/aph(2”) был выявлен не только у 100% резистентных и умеренно резистентных к амикацину изолятов, но и у 5,2% (n=8) чувствительных. В соответствии с представленными данными, ген aac присутствовал только у изолятов S. aureus, устойчивых к гентамицину и тобрамицину (59,8%, n=73), и не был выявлен ни у одного из штаммов, чувствительных к тестируемым антибактериальным препаратам. В то же время ген aac присутствовал в геноме 3 бактериальных культур, умеренно резистентных к амикацину (рисунок).
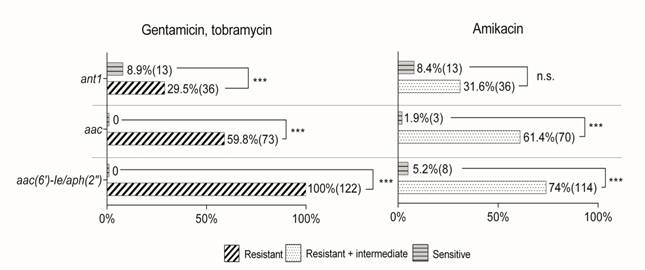
Распространенность генов аминогликозидомодифицирующих ферментов среди штаммов S. aureus в зависимости от их чувствительности к аминогликозидам
Ген ant1 выявлен у 29,5% (n=36) штаммов, устойчивых к гентамицину и тобрамицину, и у 8,9% (n=13), чувствительных к данным антибиотикам.
В свою очередь, анализ комбинаций генов аминогликозидомодифицирующих ферментов в геноме изученных штаммов S. aureus показал, что у 50% изолятов, содержащих ген aac(6’)-Ie/aph(2”), также присутствовал ген aac (n=61).
Следует отметить, что комбинация генов aac(6’)-Ie/aph(2”) и ant1 была выявлена у 20% культур (n=24), и только 10% штаммов (n=12) одновременно содержали в своем геноме все три гена.
Приведенные результаты подтверждают существенную значимость генов aac(6’)-Ie/aph(2”) и aac в формировании резистентности S. aureus к гентамицину и тобрамицину в сравнении с геном ant1 (p<0,0001).
Заключение. Ген aac(6’)-Ie/aph(2”) выявлен у 45,5% штаммов. Процент изолятов, содержащих в своем геноме гены АМФ, был существенно выше среди штаммов MRSA по сравнению со штаммами MSSA. Показана особая важность двух генов, кодирующих аминогликозидомодифицирующие ферменты, – aac(6’)-Ie/aph(2”) и aac – как детерминант устойчивости S. aureus к гентамицину и тобрамицину при ортопедической инфекции. При этом роль гена aac(6’)-Ie/aph(2”) в возникновении резистентности представляется ключевой. Детекция данного гена у изолятов S. aureus может быть рекомендована в качестве клинического скринингового теста на этапе выбора антибактериального препарата для использования в составе костного цемента при изготовлении спейсера. В перспективе для быстрой идентификации генов резистентности к аминогликозидам у штаммов S. aureus требуется разработка мультиплексных ПЦР с дальнейшей стандартизацией метода и возможностью внедрения в лаборатории.



