Рак мочевого пузыря входит в десятку самых распространенных в мире видов рака: ежегодно регистрируется около 550 000 новых случаев, и их число неуклонно увеличивается. Болезнь непропорционально поражает мужчин (соотношение 3:1) и пожилых людей: на момент обращения за медицинской помощью пик заболеваемости у мужчин приходится на 69 лет и на 71 год у женщин [1]. В России заболеваемость раком мочевого пузыря (РМП) составляет 77,1 случаев (100 0/0000) [2; 3], а в общей статистике злокачественных опухолей мочевого пузыря удельный вес пациентов с локальным опухолевым процессом, распространяющимся до мышечного слоя, составляет более 70% [3], из них 70–80% на момент диагностики являются неинвазивными – стадия Та, и около 20% имеют инвазию в собственную пластинку слизистой оболочки (lamina propria) – Т1. Успешное лечение опухоли мочевого пузыря (МП) без инвазии в мышечный слой зависит от первого этапа хирургического вмешательства – радикально и адекватно выполненной первичной трансуретральной резекции (ТУР) и точной патоморфологической диагностики. Руководства четырех урологических ассоциаций: Российской (РОУ) [4], Европейской (EAU) [5], Американской (AUA) [6], Канадской (CUA) [7], подчеркивают важность трансуретральной резекции для диагностики, определения стадии и выбора дальнейшей тактики лечения РМП. Соблюдение определенного ряда условий проведения ТУР: радикальная резекция всей опухоли (в зависимости от размера и инвазии в мышечный слой) и мышечного слоя, а также получение полноценного операционного материала для патоморфологического исследования, делает операцию высокоэффективной и конкурентоспособной.
Несмотря на прогресс в эндоуретральной хирургии, разработку и внедрение высокоэффективных лазерных технологий во многих лечебных учреждениях, стандартом эндоуретрального лечения опухолей мочевого пузыря по-прежнему продолжает оставаться монополярная трансуретральная резекция, которая входит в десятку лучших урологических процедур. С момента первой публикации о применении электрического тока для эндоуретральной резекции папиллярных опухолей МП с помощью цистоскопа прошло более ста лет. Многие положительные и нежелательные эффекты электрохирургии достаточно подробно освещены в литературе и хорошо известны оперирующим урологам [8; 9]. Одним из недостатков электрохирургических эндоуретральных методов лечения немышечно-инвазивного РМП является термическое повреждение резецированных тканей, т.е. возникновение коагуляционных артефактов, что может в дальнейшем затруднить точное гистопатологическое определение стадии, оценку глубины инвазии опухолей МП, нарушить архитектурные особенности тканей в удаленных образцах. Артефакты - это искусственные структуры на микроскопическом срезе, которые создаются из-за воздействия внешних факторов и наблюдаются во время исследования гистологических препаратов. Не способствуют выполнению адекватного гистопатологического анализа некоторые особенности техники эндоуретральной резекции МП: отсутствие перпендикулярных срезов, резекция с использованием так называемых тангенциальных (по касательной) срезов уротелиального пласта. Патологическая оценка образцов тканей, удаленных при эндоуретральной резекции, имеет первостепенное значение для соответствующего лечения, в то же время правильный морфологический анализ небольших фрагментов или сильно термически поврежденных тканей мочевого пузыря и опухоли может быть затрудненным. В некоторых случаях морфологическая оценка становится более сложной у пациентов, ранее перенесших резекции и с рубцовой трансформацией ткани МП в различных клеточных слоях, а также с наличием гнезд фон Брунна, особенно при carcinoma in situ. Определенные трудности возникают и в интерпретации наличия «мышечного слоя», последний необходим для достоверного определения градации Т.
В последние десятилетия многие урологи начали отдавать предпочтение биполярной/плазмакинетической электрохирургии в лечении РМП. Доказанными преимуществами биполярной резекции в физиологическом растворе является возможность избежать ТУР-синдрома, уменьшить кровопотерю, сократить время госпитализации и др. Несмотря на накопленный положительный опыт применения биполярной/плазмакинетической эндоуретральной резекции, имеется недостаточно данных, отражающих патоморфологические особенности и общие признаки сохранности и степень термического повреждения (термические артефакты) удаленных тканей мочевого пузыря при использовании моно- и биполярной технологии.
Цель исследования. Оценить патоморфологические особенности и качество операционного материала, предоставляемого патоморфологу после трансуретральной резекции (моно- и биполярной) немышечно-инвазивного рака мочевого пузыря, и установить степень его термического повреждения.
Материалы и методы исследования. В настоящем исследовании ретроспективно исследованы гистопатологические препараты, полученные при проведении первичного эндоуретрального оперативного лечения по поводу немышечно-инвазивного (Тa, T1, Тis) РМП у 90 пациентов, которые соответствовали критериям включения. Все пациенты оперированы в одном лечебном учреждении - в ГБУЗ «Областной онкологический диспансер», г. Иркутск. Схема клинического обследования и лечения больных с опухолями МП базировалась на федеральных стандартах медицинской помощи больным со злокачественными новообразованиями. По характеру используемого при ТУР электрохирургического воздействия полученная выборка пациентов была поделена на две группы: в первую группу вошли 46 (51,1%) пациентов, оперированных с использованием биполярной трансуретральной резекции (TURis, Olympus UES-40 Surg. Master), а во вторую - 44 (48,8%) пациента, оперированных с использованием монополярной трансуретральной резекции (TUR, Karl Storz Autocon, серии 300). Формирование контингента больных происходило методом случайной выборки. Группы были сопоставимы по клинико-морфологическим характеристикам (размерам опухоли МП, времени проведения ТУР). Рецидивирующие и не полностью удаленные опухоли, а также множественные образования и опухоли, подвергшиеся только фульгурации, были исключены из исследования. Монополярная резекция выполнялась с помощью обычного резектоскопа Fr Storz 24 с использованием водной ирригации с настройками резки и коагуляции 35–60 и 30–50 Вт соответственно. Биполярная резекция выполнялась резектоскопом 24 Fr Olympus, в качестве ирригационного раствора использовался физиологический раствор с настройками резки и коагуляции 200–280 и 140–200 Вт соответственно. Трансуретральная резекция МП при опухолях размером более 1,5-2,0 см выполнялась по общепринятой методике: вначале резецировалась экзофитная часть опухоли, далее step by step проводилось удаление оставшейся части опухоли вместе с основанием, завершалась ТУР резекцией окружающей опухоль пузырной стенки. Следует отметить, что общепринятая методика ТУР неизбежно приводит к получению фрагментированных образцов опухоли МП, что существенно снижает качество морфологического исследования. В ряде случае в зависимости от размеров (менее 1,5 см) опухоли петлю подводили под основание опухоли, отступив от края 1,0-1,5 см, и удаляли единым блоком, в том числе и с использованием стандартной монополярной резекции. После окончания электрорезекции и достижения стабильного гемостаза выполняли коагуляцию сосудов слизистой оболочки МП по границе резекции. После ТУР у всех пациентов выполнялась инстилляция химиопрепарата в полость МП. Все резецированные образцы тканей МП доставлялись в патологоанатомическое отделение в отдельных маркированных контейнерах, без предварительной фиксации. Проводили стандартное патоморфологическое исследование. Размеры выявленных одиночных образований в МП варьировали от 0,3 до 5 см и в среднем составили 2,3±1,1 см. Наибольшее количество эндоуретральных операций выполнено у больных в стадии T1 – 62,2% и со степенью дифференцировки G1 – 71,1%. Анализ гистологической структуры немышечно-инвазивных опухолей МП позволил верифицировать у 72 (80%) больных уротелиальную карциному, у 10 (11,1%) – плоскоклеточный, а у 8 (8,9%) больных – аденокарциному. Возраст пациентов колебался от 57 до 84 лет и в среднем (M±SD) составил 60,2±11,5 года. Для проведения патоморфологического исследования операционный материал был фиксирован в 10% растворе нейтрального формалина и залит в парафин. Парафиновые срезы толщиной 5-7 мкм были окрашены гематоксилин-эозином. Гистопрепараты МП в дальнейшем были подвергнуты микроскопии. Глубину опухолевой инвазии и степень дифференцировки опухоли МП оценивали в соответствии с наиболее распространенной TNM-классификацией РМП, утвержденной в 2002 г. Международным противораковым союзом, а принадлежность опухоли к определённому гистологическому типу - в соответствии с рекомендациями F. Mostofi et al. (1973) [10]. В протоколе патоморфологического заключения отмечали: гистологический тип опухоли, степень дисплазии/дифференцировки, статус краев резекции, глубину инвазии в подслизистый слой, pTNM, tumor budding, лимфоваскулярную инвазию, присутствие детрузора в образце [5]. Патоморфологи заранее не знали об используемых видах электроэнергии, дополнительно при проведении патоморфологического исследования их попросили определить наличие термического повреждения, ширину зоны и количественно оценить её степень в каждом представленном образце. Следует отметить, что в литературе отсутствует утвержденная система оценки степени термического посткоагуляционного повреждения удаленных тканей. Нами для количественной сравнительной оценки изменений резецированной опухолевой ткани, произошедших в результате моно- и биполярного электрохирургического воздействия, использовалась классификация, предложенная в 2004 году V. Wang [11]. Классификация степени посткоагуляционного повреждения тканей МП при электрокоагуляции по V. Wang et al. (2004) представлена в таблице 1.
Таблица 1
Классификация степени посткоагуляционных, термических повреждений по V. Wang et al. (2004)
|
Степень термического поражения |
Характеристика морфологических изменений |
|
0 |
Без термического повреждения, коагуляционного некроза и некробиотических изменений |
|
1 |
Низкая степень термического повреждения. Структура клеток не нарушена |
|
2 |
Средняя степень термического повреждения с нарушением ячеистой структуры клеток |
|
3 |
Высокая степень термического повреждения с отсутствием клеточных структур |
Статистический анализ проводился дифференцированно в зависимости от условий проведения исследования, целей работы, статистических характеристик обследованной выборки. Данные были проанализированы с использованием Statistica 6.0, Microsoft Excel 2003 (Microsoft Corporation, USA). При проверке гипотез использовался 5% уровень значимости.
Результаты исследования и их обсуждение. Все анализируемые образцы резецированной ткани, представленные для патоморфологического исследования, подходили для анализа. Существенных диагностических трудностей с проведением исследования не возникло, однако наличие термических артефактов различной степени выраженности было обнаружено в большинстве анализируемых гистопрепаратов. Посткоагуляционные повреждения/артефакты тканей различной степени выраженности были выявлены при выполнении анализируемых видов ТУР МП в 84,4% (n=76) случаев. Они одинаково часто присутствовали в патогистологических препаратах после проведения ТУР МП как в первой (82,6%), так и во второй (86,4%) группах. После проведения трансуретральной электрохирургической резекции только у 14 (15,6%) пациентов операционный материал был без термического повреждения резецированных тканей МП (табл. 2). Термическое повреждение резецированной ткани вызвало трудности у патоморфологов при идентификации мышечного слоя, особенно при фрагментации материала. Идентифицировать мышечные волокна в образцах резецированной опухоли удалось в 64,4% случаев (в первой – 36 (78,3%) и во второй группе 22 (82,0%) случая, p<0,01), что свидетельствовало об адекватной резекции опухоли. Кроме того, в резецированных образцах опухоли собственная пластинка осталась неизмененной в первой группе, а во второй она была подвержена термическому повреждению. Наличие собственной пластинки в патоморфологических образцах может облегчить более точную верификацию диагноза. По данным Truong M. et al., коагуляционные артефакты после ТУР (моно- и биполярной) составляли от 25-66% и могли занижать определение стадии РМП при первичной ТУР больших новообразований у 6% пациентов, но чаще оказывали влияние на определение глубины мышечной инвазии [12]. В нашем исследовании биполярная ТУР позволила получить большое количество информативного патоморфологического материала, который был отнесен к степени 0 (без термического повреждения, коагуляционного некроза и некробиотических изменений) и степени 1 (с незначительными повреждениями, без изменения клеточной структуры клеток): первая группа – 63,0%, вторая группа - 41,0%, p(χ2)=0,0017. Термические артефакты, коагуляционной некроз и некробиотические изменения в удаленных опухолях МП не возникли при проведении биполярной операции в 17,4%, а при монополярной в 13,6% (p(χ2)=0,0001) случаев. Высокая степень термического повреждения, когда в патоморфологических препаратах отсутствовали клеточные структуры, была выявлена в 3 (3,3%) случаях, только после проведения монополярной ТУР. В группе пациентов, где операцию эндоуретральной резекции опухоли МП проводили с использованием биполярной электрохирургии третьей степени, термического повреждения не отмечено (рис. 1). Средняя степень термического повреждения операционного материала чаще регистрировалась во второй группе - 52,3%, по сравнению с первой – 37,0% (p(χ2)=0,0518). Закономерным является тот факт, что при резекции опухолей МП больших размеров коагуляционных артефактов встречалось больше, чем при удалении небольших новообразований. После проведения биполярной ТУР преобладали первая (45,6%) и вторая (37,0%) степени термического повреждения тканей МП, аналогичная тенденция отмечена и во второй группе, монополярной ТУР, где на долю первой и второй степеней пришлось 27,3% и 52,3% соответственно. Различия между группами признаны статистически значимыми при первой степени термического повреждения (p(χ2)=0,0148).
Таблица 2
Степень термического повреждения операционного материала в исследуемых группах [12]
|
Степень термического повреждения |
Исследуемые группы, абс./% |
p(χ2) |
|
|
Первая группа, n=46 |
Вторая группа, n=44 |
||
|
0, n=14 |
8/17,4 |
6/13,6 |
0,0001* |
|
1, n=33 |
21/45,6 |
12/27,3 |
0,0148* |
|
2, n=40 |
17/37,0 |
23/52,3 |
0,0518 |
|
3, n=3 |
- |
3/6,8 |
- |
Примечание: * - различия статистически значимы по сравнению с группой клинического сравнения (р<0,05). Вычисление χ2 выполнялось в таблице 2х2.
Степени термического повреждения образцов резецированной опухолевой ткани МП при использовании моно- и биполярной электрохирургии представлены на рисунках 1-8. В данной работе мы не освещаем полученные результаты о влиянии степени термического поражения на определение параметров опухолевого роста.
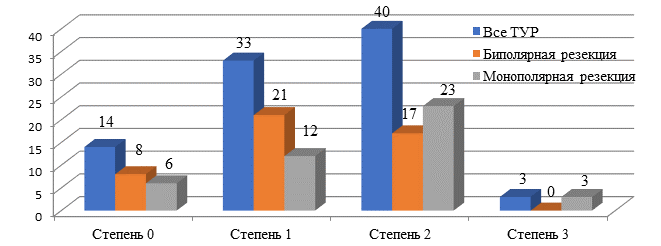
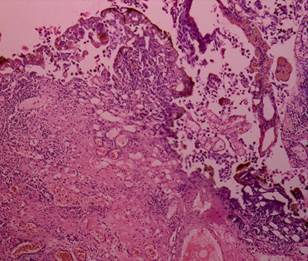
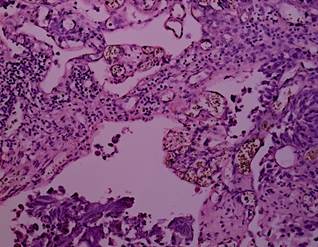
Рис. 1. Степень термического повреждения удаляемых тканей МП [13]
|
|
|
|
|
Рис. 2. Биполярная трансуретральная резекция. Уротелиальная карцинома. Степень термического повреждения 0: без термического повреждения, коагуляционного некроза и некробиотических изменений. Окраска гематоксилином и эозином. Ув. х 100 [13] |
Рис. 3. Монополярная трансуретральная резекция. Уротелиальная карцинома. Степень термического повреждения 0: без термического повреждения, коагуляционного некроза и некробиотических изменений. Окраска гематоксилином и эозином. Ув. х 100 [13] |
|
|
|
|
|
|
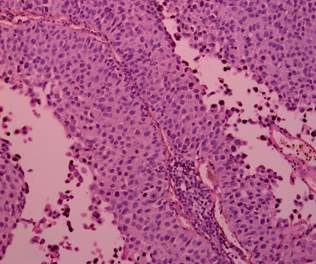
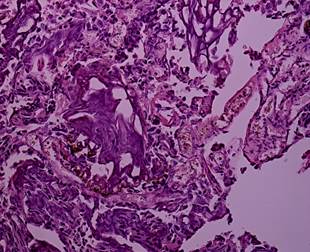
Рис. 4. Биполярная трансуретральная резекция. Уротелиальная карцинома. Степень термического повреждения 1: низкая степень термического повреждения. Структура клеток не нарушена. Окраска гематоксилином и эозином. Ув. х 200 [13] |
Рис. 5. Монополярная трансуретральная резекция. Уротелиальная карцинома. Степень термического повреждения 1: низкая степень термического повреждения. Структура клеток не нарушена. Окраска гематоксилином и эозином. Ув. х 200 [13] |
|
|
|
|
|
|
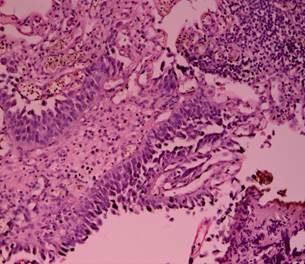
Рис. 6. Биполярная трансуретральная резекция. Уротелиальная карцинома. Степень термического повреждения 2: средняя степень термического повреждения с нарушением ячеистой структуры клеток. Окраска гематоксилином и эозином. Ув. х 200 [13] |
Рис. 7. Монополярная трансуретральная резекция. Уротелиальная карцинома. Степень термического повреждения 2: средняя степень термического повреждения с нарушением ячеистой структуры клеток. Окраска гематоксилином и эозином. Ув. х 200 [13] |
|
|
|
|
|
|
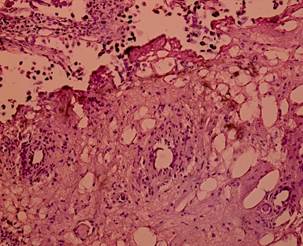
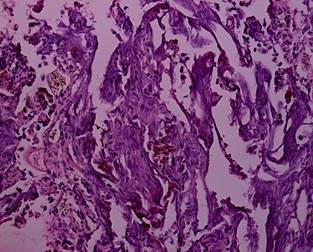
Рис. 8. Биполярная трансуретральная резекция. Уротелиальная карцинома. Степень термического повреждения 3: высокая степень термического повреждения с отсутствием клеточных структур. Окраска гематоксилином и эозином. Ув. х 200 [13] |
Рис. 9. Монополярная трансуретральная резекция. Уротелиальная карцинома. Степень термического повреждения 3: высокая степень термического повреждения с отсутствием клеточных структур. Окраска гематоксилином и эозином. Ув. х 200 [13] |
|
Выводы. На сегодняшний день электрохирургические эндоуретральные методы удаления/рассечения тканей и гемостаза продолжают оставаться неотъемлемой частью урологической практики, имеют определяющее значение для диагностики, определения стадии и выбора тактики лечения пациентов, страдающих опухолями МП без инвазии в мышечный слой. В этой связи следует отметить, что патоморфологический анализ резецированной опухоли после ТУР, наряду с инструментальными, лабораторными исследованиями, является наиболее специфичным и информативным методом в определении важнейших параметров опухолевого роста. Поскольку решение о выборе тактики лечения базируется в основном на патоморфологических результатах, то качество представляемых образцов резецируемых тканей МП имеет первостепенное значение. В представленной серии случаев термические артефакты достаточно часто встречались в большинстве микроскопических срезов после обеих видов трансуретральной электрохирургии, они оказали определенное влияние на идентификацию мышечного слоя, особенно при фрагментации материала. Существенных диагностических трудностей с проведением исследования не возникло. Использование биполярной электрохирургии в эндоуретральном лечении немышечно-инвазивного РМП способно минимизировать зону термического поражения тканей МП и создать благоприятные условия для получения большего количества информативного гистологического материала.