Высокий вклад сердечно-сосудистой патологии в общую структуру причин смертности и инвалидности населения развитых стран делает актуальными углубленное изучение и совершенствование методов лечения и профилактики сердечно-сосудистых заболеваний. Одной из основных задач исследований в этой области является точный поиск способов профилактики и лечения атеросклеротического процесса как основной причины смертности от сердечно-сосудистых заболеваний. Атеросклеротическая окклюзия сосудов, а также тромбозы и эмболии с разрывом бляшки приводят к частичной или полной ишемии пораженного бассейна, клинические последствия которой зависят от расположения и размера сосуда.
Активация провоспалительных каскадов в макрофагах и эндотелии является важным патогенетическим звеном в атерогенезе. Активированные макрофаги склонны к повышенной генерации активных форм кислорода, повышенному поглощению холестерина и секреции цитокинов/хемокинов, что приводит к большему окислению ЛПНП, активации эндотелиальных клеток, рекрутированию моноцитов и вспениванию клеток. В этом случае окислительный стресс, модифицированные липопротеины и другие факторы (биоактивные липиды, молекулярные структуры, связанные с повреждением, цитокины) стимулируют воспаление через свои собственные рецепторы [1-4].
Исходя из имеющейся информации о патогенезе атеросклероза одним из подходов к влиянию на атерогенез является использование препаратов с цитопротекторной и митохондриально-ориентированной активностью. Доклинические исследования in vitro и in vivo последних десятилетий продемонстрировали, что эндогенный стимулятор эритропоэза с массой 34 кДа эритропоэтин (ЭПО) обладает высокой цитопротекторной активностью, которая в основном связана с воздействием на митохондриальную дисфункцию и подтверждена на экспериментальных моделях ишемических и травматических поражений, в том числе эндотелия, миокарда и головного мозга [5, 6].
Более 20 лет назад для лечения анемии, связанной с хронической болезнью почек, были разрешены лекарственные средства, стимулирующие эритропоэз. Эритропоэтин (ЭПО) является основным регулятором эритропоэза. Было показано, что терапия рекомбинантным ЭПО эффективна и безопасна для лечения анемии, связанной с хронической почечной недостаточностью. Появившиеся далее экспериментальные данные указывают на то, что рецепторы ЭПО также широко распространены в сердечно-сосудистой системе, включая эндотелиальные, гладкие мышцы, кардиомиоциты и другие типы клеток, что обусловливает негематопоэтические эффекты эритропоэтина [5]. Действительно, ЭПО потенциально оказывает положительное влияние на эндотелиоциты, включая выработку оксида азота (NO), антиапоптотические эффекты, митогенную и ангиогенную активность [6]. В то же время показано, что применение ЭПО в течение одной недели снижает стимулированный ацетилхолином синтез NO, не влияет на сосудорасширяющее действие нитропруссида натрия, что указывает на то, что сосудистые защитные эффекты ЭПО критически зависят от активации eNOS [7].
Появление информации о реализации тканезащитных эффектов эритропоэтина через активацию гетерокомплекса, состоящего из рецептора ЭПО и CD131, привело исследователей к идее поиска коротких молекул, имитирующих спираль эритропоэтина B для реализации цито- и атеропротекторной активности рекомбинатного эритропоэтина. В исследовании, опубликованном Michael Brines et al., показано, что 11-членный пептид HBSP (QEQLERALNSS), не связанный в первичной последовательности с EPO, имитирует особенности трехмерной структуры спирали эритропоэтина и проявляет тканезащитные эффекты без гемопоэтической активности [8]. Также в ранее проведенных исследованиях показаны проагрегантное действие исходного пептида HBSP [9] и выраженное эндотелиопротективное действие субэритропоэтических доз рекомбинантного эритропоэтина [10, 11].
В связи с этим мы пришли к выводу, что поиск новых препаратов для лечения эндотелий-ассоциированных сердечно-сосудистых заболеваний следует продолжить среди пептидов, родственных исходному пептиду HBSP. Поиск таких соединений может быть проведен несколькими способами, включая добавление аминокислотных мотивов с заданными свойствами к аминокислотной последовательности или нахождение групп родственных пептидов исходного соединения с помощью программы BLAST. Пептиды, проанализированные в данном исследовании, были получены с применением второго подхода – скрининга с использованием программы BLAST.
Цель исследования: изучение антиагрегантного действия и антитромботических свойств следующих производных 11-членного пептида HBSP (QEQLERALNSS): EP-11-1 (UEHLERALNSS), EP-11-2 (UEQLERALNCS), EP- 11-3 (UEQLERALNTS) – in vitro и in vivo.
Материал и методы исследования
Экспериментальное исследование проведено на базе НИИ фармакологии живых систем НИУ «БелГУ». Все эксперименты были одобрены Этическим комитетом НИУ «БелГУ». Вивисекцию проводили в соответствии с этическими принципами обращения с лабораторными животными «European Convention for the Protection of Vertebral Animals Used for Experimental and Other Scientific Purposes. CETS No. 123».
До и во время выполнения исследования животные содержались в помещениях с искусственным освещением (режим 12 ч/12 ч) при температуре 21–23°С, влажности 38–50% и имели свободный доступ к корму и воде.
Исследование антиагрегантной активности и антитромботических свойств проведено в 2 этапа. На первом этапе in vitro было изучено влияние производных 11-членного пептида pHBSP (QEQLERALNSS): EP-11-1 (UEHLERALNSS), EP-11-2 (UEQLERALNCS), EP-11-3 (UEQLERALNTS) на модели АДФ-индуцированной агрегации тромбоцитов при инкубации цельной крови с изучаемыми пептидами. Определение показателей степени агрегации тромбоцитов производилось с использованием плазмы, обогащенной тромбоцитами самцов крыс линии Wistar. Кровь забирали из брюшного отдела аорты в пробирку с 3,8%-ным раствором цитрата натрия в соотношении 9:1 с последующим добавлением исследуемых полипептидов в конечной концентрации 30 мкг/мл. Инкубировали 30 мин. Затем центрифугировали при 1000 оборотов 10 мин. После этого вносили 270 мкл обогащенной тромбоцитами плазмы в кювету агрегометра объемом 0,3 мл. Спонтанную агрегационную способность тромбоцитов изучали без добавления индуктора. При изучении АДФ индуцированной агрегации в пробирку добавляли 30 мкл динатриевой соли аденозин-5-дифосфорной кислоты (АДФ) в конечной концентрации 5 мкМ. Антиагрегантную активность определяли по методу G. Born [12] в модификации З.А. Габбасова на двухканальном лазерном анализаторе агрегации тромбоцитов АЛАТ-2 «Биола» с использованием реактивов производства НПО «Ренам». Анализ проводили через 60 мин после получения крови. При графической регистрации агрегации тромбоцитов на протяжении 5 мин получали кривые, отражающие падение оптической плотности плазмы. Степень агрегации тромбоцитов оценивали по величине максимальной амплитуды агрегатограммы и времени наступления максимальной светопропускной способности и времени наступления уровня 85% от максимальной светопропускной способности.
Второй этап исследования активности 11-аминокиcлотных производных эритропоэтина, полученных с использованием BLAST скрининга, проведен на 50 самцах мышей линии C57Bl/6J. После прохождения 14-дневного карантинного режима мыши были стратифицированы по массе и рассажены по 10 особей в отдельные конвенциональные клетки в соответствии с принадлежностью к экспериментальной группе: 1) pHBSP (соединение pHBSP внутрибрюшинно 1 раз в день в дозе 2,5 мкг/100 г в течение 7 дней, суммарная доза 17,5 мкг/100 г); 2) EP-11-1 (соединение EP-11-1 внутрибрюшинно 1 раз в день в дозе 2,5 мкг/100 г в течение 7 дней, суммарная доза 17,5 мкг/100 г); 3) EP-11-2 (соединение EP-11-2 внутрибрюшинно 1 раз в день в дозе 2,5 мкг/100 г в течение 7 дней, суммарная доза 17,5 мкг/100 г); 4) EP-11-3 (соединение EP-11-3 внутрибрюшинно 1 раз в день в дозе 2,5 мкг/100 г в течение 7 дней, суммарная доза 17,5 мкг/100 г); 5) контроль (растворитель внутрибрюшинно 1 раз в день в течение 7 дней в эквивалентном объеме).
Исследуемые соединения вводили в концентрации 0,00025%, в качестве солюбилизатора использовали апирогенный раствор NaCl 0,9%.
Через 8 ч после последнего введения животных наркотизировали (золазепам 5 мг/100 г + ксилазин 2 мг/100 г внутрибрюшинно) и фиксировали к операционному столику абдоминальной поверхностью вверх. Затем выполняли разрез длиной 10 мм слева от срединной линии шеи, выделяли общую сонную артерию и аккуратно отделяли ее от окружающих тканей, не повреждая блуждающий нерв. С использованием ультразвукового допплерографа «Минимакс-Допплер» (Санкт-Петербург, Россия) на выделенной артерии определяли точку наилучшего сигнала, после чего прикладывали ватку, смоченную 50%-ным раствором FeCl3, и засекали время до полного прекращения сигнала. Для исключения влияния биоритмов животных брали в эксперимент последовательно по одному из каждой группы. Терминальный этап эксперимента с непосредственной оценкой времени FeCl3-индуцированного тромбообразования был выполнен последовательно в течение 2 дней. После окончания эксперимента животных эвтаназировали передозировкой наркоза (золетил 25 мг/100 г).
Статистическую обработку проводили с использованием программной среды вычислений R. Характер распределения признаков в статистической выборке определяли с помощью критерия Шапиро–Уилка и критерия Шпигельхальтера (библиотека normtest), оценку равенства дисперсий – с помощью критерия Левене (библиотека lawstat). В зависимости от типа распределения признаков и равенства дисперсий значимость полученных результатов оценивали с применением параметрического (ANOVA) или непараметрического (критерий Краскела–Уоллиса) однофакторного дисперсионного анализа, а в качестве post-hoc анализа для выявления различий при межгрупповых сравнениях использовали непарный t-критерий Стьюдента или критерий Манна–Уитни соответственно, с поправкой Бенджамини–Хохберга на множественную проверку гипотез. Результаты считали достоверными при p≤0,05.
Результаты исследования и их обсуждение
Добавление индуктора агрегации АДФ к плазме, обогащенной тромбоцитами группы интактных животных, приводило к снижению максимальной светопропускной способности на 123,4±3,33 с и составляло 36,9±1,79%. Инкубирование крови с исходным пептидом pHBSP приводило к усилению агрегационных свойств тромбоцитов. Это выразилось в укорочении времени наступления максимальной светопропускной способности плазмы до 105,8±2,66 с, которая составила 48,0±1,23%. Инкубирование крови с исследуемыми пептидами EP-11-1 и EP-11-3 приводило к ослаблению агрегационной способности тромбоцитов. Об этом свидетельствуют статистически значимое уменьшение максимальной светопропускной способности плазмы до 31,5±0,85% и 30,4±0,62% соответственно и отсрочивание во времени ее наступления до 132,6±2,73 с и 137,5±3,80 с соответственно (рис. 1). При этом наблюдается закономерное смещение кривой светопропускания плазмы, которая характеризует процесс агрегации тромбоцитов, вправо по отношению к группе интактных животных.
Исследуемый образец EP-11-2 на агрегационную способность тромбоцитов в проводимом эксперименте влияния не оказывал. Об этом свидетельствует отсутствие статистически достоверного отличия максимального уровня светопропускания плазмы и времени его наступления от показателей группы контрольных животных.
Закономерная тенденция наблюдается и при анализе времени наступления 85% от максимального уровня светопропускания. У образцов EP-11-1 и EP-11-3 время его наступления больше по отношению к группе интактных животных, и данное обстоятельство также способствует смещению кривой агрегационной способности тромбоцитов вправо (таблица).
Таким образом, на основании проведенного исследования выявлена антиагрегантная способность у образцов EP-11-1 и EP-11-3, о чем свидетельствуют удлинение времени агрегации тромбоцитов и снижение ее степени.
Время тромбообразования в сонной артерии у интактных самцов мышей линии C57Bl/6J от момента индукции FeCl3 до полного прекращения кровотока составило 920±43,7 с (рис. 2).
Внутрибрюшинное введение исходного пептида pHBSP приводило к укорочению времени тромбообразования до полного прекращения кровотока до 575±22,2 с, что свидетельствует о протромбогенном эффекте. Внутрибрюшинное введение исследуемых пептидов EP-11-1 и EP-11-3 приводило к статистически значимому (р<0,05) удлинению времени тромбообразования до полного прекращения кровотока до 1097±40,3 с и 1285±57,5 с соответственно. Полученные данные свидетельствуют о наличии у исследуемых пептидов антитромбогенных свойств. Внутрибрюшинное введение образца EP-11-2 не приводило к статистически значимому изменению времени тромбообразования.
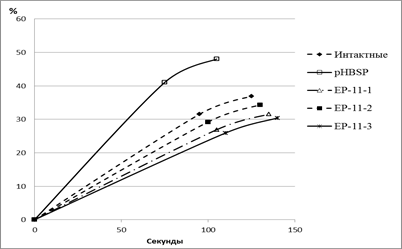
Рис. 1. Влияние исследуемых пептидов на агрегационную способность тромбоцитов
Влияние инновационных пептидов, имитирующих α-спираль B эритропоэтина, на агрегационную способность тромбоцитов (M±m, n=10)
|
Группа |
Время наступления |
Максимальный уровень светопропускания, % |
|
|
85% от максимальной, с |
Максимальная агрегация, с |
||
|
Интактные |
94,0±3,85 |
123,4±3,33 |
36,9±1,79 |
|
pHBSP |
75,0±2,11* |
105,8±2,60* |
48,0±1,23* |
|
EP-11-1 |
104,0±2,29* |
132,6±2,73* |
31,5±0,85* |
|
EP-11-2 |
98,6±3,76 |
129,9±3,69 |
34,3±0,70 |
|
EP-11-3 |
108,9±4,00* |
137,5±3,80* |
30,4±0,62* |
Примечание: * – при p<0,05 по отношению к интактным животным.
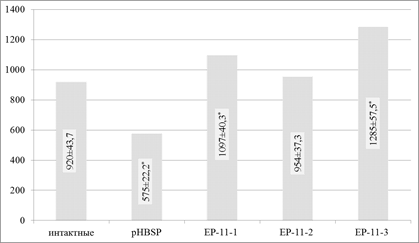
Рис. 2. Влияние исследуемых пептидов на время FeCl3-индуцированной тромботической окклюзии сонной артерии у мышей
Заключение
В результате проведенного исследовании показана антиагрегантная способность у образцов пептидов с лабораторными шифрами EP-11-1 и EP-11-3, о чем свидетельствуют удлинение времени агрегации тромбоцитов и снижение ее степени. Внутрибрюшинное введение исходного пептида HBSP приводило к укорочению времени тромбообразования до полного прекращения кровотока до 575±22,2 с, что свидетельствует о протромбогенном эффекте соединения. Внутрибрюшинное введение исследуемых пептидов EP-11-1 и EP-11-3 приводило к статистически значимому (р<0,05) удлинению времени тромбообразования до полного прекращения кровотока до 1097±40,3 с и 1285±57,5 с соответственно. Результаты проведенного исследования свидетельствуют о наличии антитромботических свойств у исследуемых пептидов с шифрами EP-11-1 и EP-11-3 и их способности снижать агрегационную способность тромбоцитов.
Исследование выполнено при поддержке гранта Президента РФ № MД-757.2020.7.



