Нейроэндокринные опухоли могут иметь различную локализацию. Чаще всего поражаются легкие, а молочная железа является наиболее редкой первичной внелегочной локализацией. Нейроэндокринная дифференцировка в опухолях молочных желез была впервые описана Feyrter и Hartmann в 1963 г. Тогда использовались гистохимические реакции серебрения для подтверждения нейроэндокринной природы. В классификациях опухолей ВОЗ первичная нейроэндокринная карцинома молочной железы (НЭРМЖ) появилась в 2003 г. [1]. Надо отметить, что гистогенез НЭРМЖ до конца не изучен.
В современном 5-м издании классификации опухолей молочной железы ВОЗ нейроэндокринные опухоли (НЭО) по аналогии с НЭО гастроэнтеропанкреатической системы делятся на высокодифференцированные нейроэндокринные опухоли низкой и умеренной степени злокачественности (НЭО G1 и НЭО G2) и низкодифференцированные нейроэндокринные карциномы высокой степени злокачественности (НЭО G3), которые, в свою очередь, подразделяются на мелкоклеточный и крупноклеточный типы [2]. Кроме того, выделяют смешанные формы, когда нейроэндокринная дифференцировка является компонентом другого гистологического типа и составляет от 10% до 90% площади.
Реально оценить частоту встречаемости НЭРМЖ достаточно сложно, так как маркеры нейроэндокринной дифференцировки опухоли молочной железы не входят в стандартную панель иммуногистохимического исследования. В научных изысканиях, проводимых в нашем учреждении, посвященных скринингу нейроэндокринной дифференцировки в карциномах пищеварительного тракта, удалось показать, что как компонент нейроэндокринная дифференцировка встречается не так уж и редко и составляет до 62% всех карцином; вероятно, что при системном иммуногистохимическом исследовании инвазивных карцином молочной железы можно выйти на схожие цифры [3, 4].
Цель исследования: проанализировать данные литературы и собственное клиническое наблюдения крайне редкого варианта злокачественной опухоли молочной железы.
Материалы и методы исследования. Больная Ч., 59 лет, обратилась консультативно-диагностическое отделение ФГБУ «НМИЦ онкологии» МЗ РФ с жалобами на сухой кашель по утрам. После обследования (МРТ головного мозга с контрастированием, СРКТ органов грудной клетки, брюшной полости, малого таза) определено единичное периферическое образование нижней доли левого легкого 1,9х1,8 см с ровными краями. Другой патологии не выявлено. Больной выполнены ВАТС слева, атипичная резекция нижней доли левого легкого. Гистологический анализ: G3 нейроэндокринный рак. Заключительный диагноз: (C34.1) Периферический рак нижней доли левого легкого, T2N2M0G3R0, IIIа стадии, клиническая группа 2. В дальнейшем больной проведена многокурсовая ПХТ препаратами платины и этопозидом в стандартных дозировках, лучевая терапия на ложе опухоли и зоны лимфооттока. Через 5 месяцев после завершения комплексного лечения при плановом осмотре выявлена опухоль левой молочной железы 1,5 см в нижне-внутреннем квадранте. Данных за поражение других органов и систем не выявлено. Выполнена трепан-биопсия опухоли. Гистологически опухоль была представлена солидными и альвеолярными структурами из достаточно мономорфных клеток с эозинофильной цитоплазмой, с очень мелкими очагами некроза с лейкоцитарной инфильтрацией и умеренной митотической активностью (рис. А). В протоколе прижизненного патологоанатомического исследования было сделано заключение: карцинома солидного строения, наиболее вероятна карцинома неспецифического типа G2. Иммуногистохимическое исследование было проведено с учетом анамнеза заболевания: Mammaglobin – отсутствие экспрессии в опухолевых клетках, ER – отсутствие экспрессии в опухолевых клетках, PR – слабая ядерная реакция в 20% опухолевых клеток (рис. Б), Ki-67 – положительная ядерная реакция в 15% опухолевых клеток (рис. В), HER2neu – отсутствие экспрессии в опухолевых клетках, Chromogranin-A – умеренно выраженная цитоплазматическая экспрессия в опухолевых клетках (рис. Г).
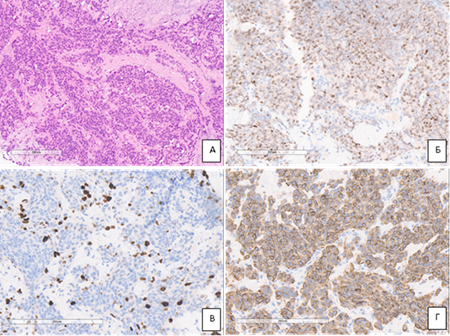
Гистологическое строение и иммунофенотип опухоли молочной железы.
А – гистологическое строение (окраска гематоксилин-эозином, ув. х 100); Б – ядерная экспрессия прогестерона в опухоли (ИГХ с антителами к рецепторам прогестерона, Ventana, ув. х 200); В – пролиферативная активность опухоли (ИГХ с антителами к Ki-67, Ventana, ув. х 200); Г – подтверждение нейроэндокринной дифференцировки (ИГХ с антителами к chromogranin A, Ventana, ув. х200)
Заключение: морфологическая картина и иммунофенотип опухолевых клеток (Chromogranin+) более характерны для нейроэндокринной крупноклеточной карциномы. Морфологическая картина и иммунофенотип опухоли молочной железы были схожи с опухолью легкого, и с учетом отсутствия опухоли молочной железы на момент резекции легкого и распространенности процесса в легком (метастазы в регионарные лимфатические узлы) было высказано суждение о метастатическом поражении ткани молочной железы нейроэндокринной карциномой легкого. Представленный пример еще раз убеждает, что клиническая и инструментальная дифференциальная диагностика первичного и метастатического характера нейроэндокринной опухоли молочной железы крайне затруднена, что отмечено и другими авторами [5].
Результаты исследования и обсуждение. Проблема как диагностики, так и лечения НЭРМЖ является крайне актуальной, что было продемонстрировано клиническим примером. Насколько часто молочные железы поражаются вторичными нейроэндокринными карциномами и карциномами с нейроэндокринной дифференцировкой, также остается неизвестным. В литературе встречаются только отдельные описания клинических случаев [6, 7]. В большинстве случаев нейроэндокринная природа опухоли молочной железы является морфологической находкой при плановом исследовании операционного материала. Конечно, ответ на вопрос, является ли опухоль в молочной железе первичной или результатом метастатического поражения, определяет тактику лечения больной. Часто ответить на этот вопрос клиницисту крайне проблематично, особенно в условиях отсутствия развернутой клинической картины. А каких-либо специфических признаков первичного НЭРМЖ по данным инструментальных методов исследования также не существует. И информация о клинико-биологических характеристиках НЭРМЖ и особенностях его течения, прогнозе и ответе опухоли на проводимую терапию крайне скудна. Объясняется это, прежде всего, редкостью патологии и сложностями морфологической диагностики. Наиболее многочисленная группа больных НЭРМЖ (n=142), проанализированная на сегодняшний день, – это группа в базе SEER. Согласно результатам анализа, НЭРМЖ значительно отличается по своим характеристикам от наиболее встречающегося варианта неспецифической инвазивной карциномы (n=5165): развивается в более старшем возрасте (63,6±14,9 года против 61,3±14,2 года, р=0,029), имеет большую степень распространенности опухолевого процесса на момент установки диагноза (размер первичной опухоли 32 мм против 23 мм, р<0,0001, 22,5% I стадии против 45,4%, р<0,05), низкую степень дифференцировки G3 (42,3% против 33,3%, р<0,0001), реже является гормонпозитивным (ER+ в 54,2% случаев против 71,9%, р<0,05 и PR+ в 37,3% случаев против 60%, р<0,05) [8].
Однако позже был опубликован анализ группы больных M.D. Anderson Cancer Center, результаты которого несколько отличались от предыдущих. Группа больных НЭРМЖ (n=74) сравнивалась по основным клинико-биологическим характеристикам с группой больных неспецифической инвазивной карциномой (n=5165). И если по таким параметрам, как «возраст больных» и «размер первичной опухоли», данные совпали, то различий по степени распространенности опухолевого процесса на момент установления диагноза не отмечено. Более того, НЭРМЖ уже имел лучшие биологические характеристики: подавляющее большинство из них было гормонпозитивными (ER+ в 91,89% случаев против 71,56%, р<0,0001 и PR в 68,92% случаев против 57,12%, р=0,036) и умеренно дифференцированными G2 (77,03% против 39,59%, р<0,0001). [8] Аналогичные данные были получены и позднее на группе из 36 больных [9].
Если данные по клинико-биологическим характеристиками НЭРМЖ противоречивы, то согласно представленным исследованиям прогноз заболевания независимо от стадии заболевания при НЭРМЖ однозначно хуже. Риск метастазирования (преимущественно в кости и печень) составляет 34% в течение 5 лет при среднем безметастатическом периоде 73 месяца, риск локального рецидива – 15% в течение 5 лет при среднем безрецидивном периоде 177 месяцев [10]. О худшем прогнозе по показателю бессобытийной выживаемости, хотя и не влияющем на общую выживаемость, свидетельствуют и результаты анализа историй болезни 128 пациенток [11]. А в исследовании, опубликованном в 2020 г., детально проанализирована группа люминального В РМЖ и показаны аналогичные результаты [12]. Однако, если посмотреть более ранние исследования, то не всегда НЭРМЖ соотносился с плохим прогнозом. В частности, при анализе показателей выживаемости больных в зависимости от наличия NSE и синаптофизина достоверных различий ни в общей, ни в опухоль-специфической выживаемости не прослежено [13]. А Francesca Rovera et al. (2008), сравнивая НЭРМЖ (n=13), РМЖ с минимальной нейроэндокринной активностью (n=22) и неспецифический инвазивный РМЖ (n=35) при средней длительности наблюдения 60 месяцев, показали, наоборот, меньшую частоту локального рецидива при НЭРМЖ по сравнению с другими вариантами (р=0,009) [14].
В 2013 г. эти же авторы при средней длительности наблюдения НЭРМЖ 88 месяцев (n=61), РМЖ с минимальной нейроэндокринной активностью (n=35) и неспецифического инвазивного РМЖ (n=2745) продемонстрировали 10-летнюю бессобытийную выживаемость в группе НЭРМЖ 87%. При этом различия по выживаемости между двумя группами РМЖ с нейроэндокринной активностью недостоверны (р=0,43). Обоснованием таких хороших результатов, на взгляд авторов, являются благоприятные клинико-биологические свойства НЭРМЖ (гормонпозитивный статус опухоли (p<<0,001, HER2neu-статус опухоли (p=0,002), низкий Ki67 (p<0,001), низкий р53 (p=0,005)) [15]. Однако по данным M.D. Anderson Cancer Center о 63 больных НЭРМЖ: 5-летняя общая выживаемость – 84%, бессобытийная выживаемость – 65%. Таким образом, данные представленных исследований крайне противоречивы [10].
Следующий вопрос: отчего же зависит прогноз заболевания у больных НЭРМЖ? И по данным анализа базы SEER, и по результатам M.D. Anderson Cancer Center нейроэндокринная дифференцировка опухоли является самостоятельным неблагоприятным фактором, на который не влияют традиционные факторы, такие как уровень экспрессии половых гормонов, HER2neu-статус, проведение системной терапии, в том числе гормонотерапии, лучевой терапии. Единственным клиническим параметром, улучшающим прогноз заболевания при НЭРМЖ, помимо начальной стадии заболевания, служит факт радикального оперативного вмешательства, причем независимо от объема (РМЭ или ОСО). Влияние такого параметра, как степень дифференцировки опухоли (G), неоднозначно.
Однако в более ранних исследованиях экспрессия рецепторов прогестеронов и эстрогенов является позитивным фактором, достоверно улучшающим показатели выживаемости (р=0,02 и р<0,0001 соответственно) [16], равно как и высокая степень дифференцировки опухоли (p=0,007).
По сей день продолжают появляться данные о новых маркерах нейроэндокринной природы опухоли, что заставляет вновь и вновь пересматривать ранее полученные клинические данные. Например, на сегодняшний день, помимо стандартных маркеров, таких как синаптофизин, хромогранин, NSE и CD56, в качестве показателя нейроэндокринной природы опухоли молочной желез применяется и INSM1 (Insulinoma associated protein 1). Показано, что наличие INSM1 ассоциировано с люминальным подтипом РМЖ, HER2neu-отрицательным статусом и благоприятным прогнозом, в частности при люминальном В РМЖ [12]. Факт неоднозначности иммуногистохимической картины нейроэндокринных свойств опухоли усугубляет сложности изучения данного заболевания. Кроме того, скорее всего, и сам по себе НЭРМЖ является разнородной группой, что, безусловно, нуждается в дальнейшем изучении.
Таким образом, и диагностика нейроэндокринного РМЖ, и прогноз его течения неоднозначны, однако очевидно, что он является особой опухолью, нуждающейся в особой системной терапии, так как стандартно применяемые методики не работают. На сегодняшний день принципы лечения НЭРМЖ, ни системного, ни локального, не отличаются от таковых при других гистовариантах РМЖ. Конечно, в литературе обсуждается возможность использования в системной терапии препаратов, зарекомендовавших себя в лечении других нейроэндокринных опухолей, в частности этопозида, однако каких-либо убедительных данных о положительном опыте их применения не представлено. В связи с тем, что последние годы ознаменовались всплеском интереса к возможностям таргетной терапии в лечении РМЖ, стали изучаться возможности подобной терапии и НЭРМЖ. В частности, была изучена роль рецепторов соматостатина (SSTRs) [17]. Кроме того, была произведена оценка экспрессии PD-L1 в нейроэндокринных опухолях молочной железы, но полученные результаты поставили под сомнение перспективу применения ингибиторов контрольных точек у этой группы больных [18]. Проведенное изучение ряда генетических мутаций в образцах 15 первичных и метастатических опухолей показало наличие PIK3CA в трех [19]. Этот же источник сообщает и о корреляции нейроэндокринной дифференцировки опухоли молочной железы с наличием мутаций VEGFR2, что открывает перспективы антиангиогенной терапии. Казалось бы, логичной представляется и специфическая гормонотерапия, учитывая предполагаемую нейроэндокринную активность опухоли. Однако опыт подобной терапии носит единичный и неубедительный характер. Да и гормональная активность НЭРМЖ не является однозначно доказанным фактом.
Выводы. Исходя из данных литературы, представленной на сегодняшний момент, перспективы лечения НЭРМЖ лежат в плоскости поиска биологических мишеней – точек приложения таргетной терапии. При этом, по всей вероятности, ни хирургическое, ни радиотерапевтическое лечение при НЭРМЖ никаких особенностей не имеет. Хотя, конечно, недостаточное количество клинических исследований не позволяет это утверждать однозначно. Безусловно, необходимо дальнейшее изучение молекулярного профиля НЭРМЖ, что позволит выйти на новый уровень понимания данного биологического процесса и определить дальнейшие перспективы поиска специфической терапии.



