Республика Башкортостан (РБ) является регионом с высокой заболеваемостью одной из форм зооантропонозной трихофитии – инфильтративно-нагноительной – волосистой части головы (ИНТВГ) [1]. Согласно проведенным исследованиям, в общем числе больных трихофитией доля данной формы по РБ за 2014–2019 гг. составляет в среднем 5,7 на 100 тыс. населения. Основным препаратом, используемым в терапии, является гризеофульвин. В последнее время все чаще встречаются резистентные формы трихофитии к данному препарату.
Согласно данным литературы, иммунологические исследования показали, что при трихофитии отмечаются значительные изменения в гуморальном звене иммунитета. По мнению ученых, у пациентов данные изменения весьма информативны [2, 3].
С учетом данных фактов изучение процессов иммуногенеза при данном заболевании позволяет проводить диагностическое прогнозирование развития воспалительной реакции в очагах и коррекцию терапии с использованием в комплексе с основным действующим средством иммунопрепарата. Одним из таких средств является ликопид – иммуномодулятор, который усиливает выработку и активацию эндогенных провоспалительных цитокинов (фактора некроза опухоли (ФНО), интерлейкинов (ИЛ1β, ИЛ4 и интерферона ИФНγ)) [4, 5]. Это указывает на целесообразность поиска новых методов и подходов к диагностике и лечению инфильтративно-нагноительной формы трихофитии волосистой части головы.
Цель исследования – изучение изменения некоторых индикаторов состояния гуморального иммунитета (фактора некроза опухоли, интерлейкинов ИЛ1β, ИЛ4 и интерферона ИФНγ) на фоне комплексной и монотерапии инфильтративно-нагноительной формы трихофитии волосистой части головы.
Материал и методы исследования. Под наблюдением находился 61 ребенок в возрастном периоде от 5 до 18 лет с инфильтративно-нагноительной трихофитией волосистой части головы. Из них 28 человек составили контрольную группу и 33 человека – основную группу. Всем больным проведено микроскопическое и культуральное исследование с посевом патологического материала на среду Сабуро с пенициллином, стрептомицином и циклогексимидом. У 61 человека изучены некоторые индикаторы состояния гуморального иммунитета (фактор некроза опухоли (ФНОа), интерлейкины ИЛ1β, ИЛ4 и ИФНγ). В процессе работы данные содержания в крови пациентов с инфильтративно-нагноительной трихофитии волосистой части (ИНТВГ) были подвергнуты двухфакторному и однофакторному дисперсионному анализу. В качестве контролируемых факторов выступали «этапы наблюдения» и «способ лечения». Первый фактор фактически отражал изменения состояния пациента до начала лечения, на 10-й день с начала лечения, при выписке, а также через месяц и через полгода после завершения лечения. Лечение производилось гризеофульвином (контрольная группа – 28 человек) и гризеофульвином в сочетании с ликопидом (основная группа – 33 человека).
Статистическую обработку результатов исследования проводили, используя двухфакторный и однофакторный дисперсионный анализ, а также путем вычисления средней арифметической (М) и средней ошибки средней (m). При оценке достоверности различий сравниваемых данных за уровень значимости принимали p<0,05.
Результаты исследования и их обсуждение. Изменения среднего уровня содержания ФНОа практически полностью и жестко были детерминированы с фактором «этапы наблюдения», т.е. с состоянием пациента в процессе болезни, ее лечения и в отдаленный период, как в целом (η2=98%, F=2439, p<<0,0001), так и в группах с разными подходами к лечению ИНТВГ (η2=98%, F=1439, p<<0,0001 и η2=98%, F=1338, p<<0,0001). Зависимость от способа лечения и сочетанного действия этих факторов оказалась значимой, но слабой (η2=4%, F=31, p<<0,0001 и η2=7%, F=13,3, p<<0,0001). Средний уровень ФНОа претерпевает существенные изменения от одного этапа анализа к другому, но характер этих изменений в обеих группах аналогичен. Средние уровни ФНОа достаточно близки, хотя в интервале времени от 10-го дня после начала лечения и до месяца после него в основной группе они оказывались значимо выше, чем в контрольной (рис. 1).
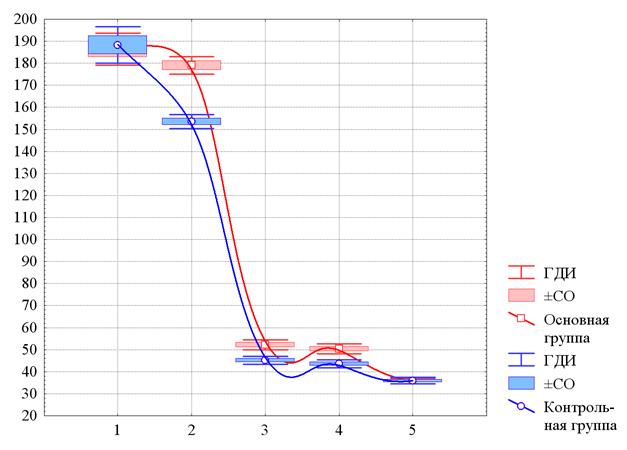
Рис. 1. Изменения среднего уровня ФНОа у больных ИНТВГ на различных этапах наблюдения
По оси ординат – содержание в плазме крови ФНО в пг/мл. По оси абсцисс – этапы наблюдения: 1 – до начала лечения, 2 – на 10-й день с начала лечения, 3 – при выписке, 4 – через 1 месяц после завершения лечения, 5 – через 3 месяца после выписки. По оси ординат – численность лейкоцитов (109/л). ГДИ и ±СО – границы доверительного интервала и стандартная ошибка среднего значения (m). Аппроксимация непрерывных изменений получена методом наименьших квадратов.
Так, последовательные изменения ФНОа в обеих группах характеризуются некоторым снижением среднего уровня ФНОа на 10-й день лечения, после чего отмечаются падение в 4 раза по завершении лечения и сохранение на этом уровне через месяц после него с некоторым снижением к 3 месяцам после выписки из стационара. Начальные значения ФНОа в основной и контрольной группе практически совпадают и значимо не различаются – 186,4±21,2 пг/мл и 188,3±22,4 пг/мл соответственно (p>0,72). Еще более близки друг другу «конечные», имевшие место через 3 месяца значения ФНО – 35,8±3,7 пг/мл в основной группе и 35,4±3,9 пг/мл в контрольной группе (p>0,94).
Рассмотрим изменения содержания ИЛ1β, ИЛ4 и ИФНγ.
Последовательные изменения среднего уровня ИЛ1β в точности повторяли динамику показателя ФНОа. Изменения среднего уровня содержания ИЛ1β в плазме крови были сильно детерминированы фактором «этапы наблюдения» как в целом (η2=96%, F=1257, p<<0,0001), так и в каждой группе (η2=98%, F=935, p<<0,0001 в основной и η2=96%, F=578, p<<0,0001 в контрольной). Зависимость от способа лечения и сочетанного действия этих факторов также оказалась значимой, но крайне слабой, практически несущественной – η2=7%, F=28, p<<0,0001 и η2=4%, F=24, p<<0,0001. Следовательно, средний уровень ИЛ1β также претерпевает существенные поэтапные изменения, но характер этих изменений при обоих вариантах лечения аналогичен, а средние уровни содержания ИЛ1β достаточно близки.
Как видно на рисунке 2, последовательные изменения ИЛ1β, как и ФНОа, в обеих группах практически идентичны. Начальные значения ИЛ1β в основной и контрольной группах достаточно близки и значимо не различались – 154,8±24,2 пг/мл и 164,2±14,1 пг/мл соответственно (p>0,07). На 10-й день лечения происходит некоторое значимое снижение среднего уровня ИЛ1β, а к концу лечения он снижается в 3 раза и удерживается на этом же уровне через месяц после его завершения. Как и в случае ФНОа, в интервале времени от 10-го дня после начала лечения и до месяца после него средний уровень ИЛ1β в основной группе был незначительно, но статистически значимо выше, чем в контрольной.
Через 3 месяца после завершения лечения также происходит небольшое, но статистически значимое снижение среднего уровня ИЛ1β. При этом имеют место сближение средних уровней ИЛ1β в обеих группах – 41,4±6,4 пг/мл в основной группе и 41,8±6,1 пг/мл в контрольной группе – и отсутствие между ними значимых различий (p>0,37).
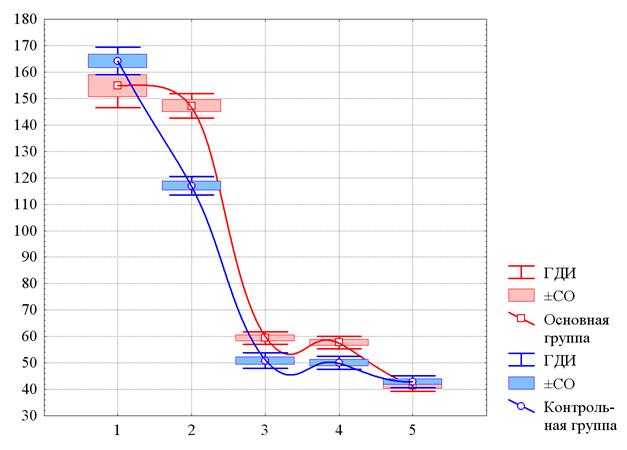
Рис. 2. Изменения среднего уровня ИЛ1β у больных ИНТВГ на различных этапах наблюдения
По оси ординат – содержание ИЛ1β в плазме крови в пг/мл. По оси абсцисс – этапы наблюдения: 1 – до начала лечения, 2 – на 10-й день с начала лечения, 3 – при выписке, 4 – через 1 месяц после завершения лечения, 5 – через 3 месяца после выписки. По оси ординат – численность лейкоцитов (109/л). ГДИ и ±СО – границы доверительного интервала и стандартная ошибка среднего значения (m). Аппроксимация непрерывных изменений получена методом наименьших квадратов.
Совершенно иным образом развивалась ситуация с изменениями содержания ИЛ4. Зависимость уровня ИЛ4 от фактора «этапы наблюдения» оказалась существенно меньше, чем во всех рассмотренных выше случаях: η2=54%, F=694, p<<0,0001. При этом в каждой группе изменения уровня ИЛ4 оказались жестко связаны с фактором «этапы наблюдения» – η2=94%, F=963, p<<0,0001 и η2=98%, F=970, p<<0,0001.
Следует отметить, что сила влияния фактора «способ лечения» оказалась довольно сильной (η2=27%, F=696, p<<0,0001), а сила влияния сочетанного действия обоих факторов – очень сильной – η2=50%, F=595, p<<0,0001. Это означает, что в основной и контрольной группах характер изменения уровня содержания ИЛ4 отличается существенным своеобразием.
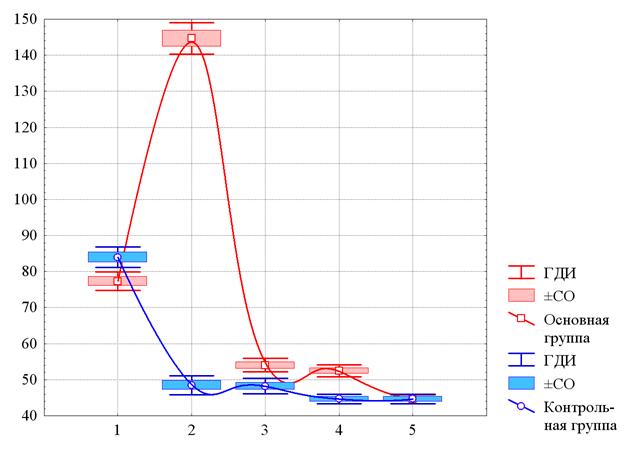
Рис. 3. Изменения среднего уровня ИЛ4 у больных ИНТВГ на различных этапах наблюдения
По оси ординат – содержание ИЛ4 в плазме крови в пг/мл. По оси абсцисс – этапы наблюдения: 1 – до начала лечения, 2 – на 10-й день с начала лечения, 3 – при выписке, 4 – через 1 месяц после завершения лечения, 5 – через 3 месяца после выписки. По оси ординат – численность лейкоцитов (109/л). ГДИ и ±СО – границы доверительного интервала и стандартная ошибка среднего значения (m). Аппроксимация непрерывных изменений получена методом наименьших квадратов.
Действительно, как показано на рисунке 3, до начала лечения средний уровень содержания ИЛ4 в основной и контрольной группах достаточно близок, хотя в основной группе он был значимо ниже – 77,3±7,5 пг/мл и 84,0±7,5 пг/мл соответственно. Однако на 10-й день лечения в основной группе средний уровень содержания ИЛ4 возрастает вдвое (до 144,7±12,8 пг/мл), а в контрольной снижается в 1,5 раза (до 48,6±7,1 пг/мл). В последующие сроки средний уровень содержания ИЛ4 практически стабилизируется, хотя к месяцу и к полугоду все-таки имеет место пусть и незначительное, но статистически значимое снижение уровня ИЛ4. В основной группе к завершению лечения уровень ИЛ4 вновь резко снижается до уровня, сопоставимого с существующим на этом этапе в контрольной группе. К полугоду уровень ИЛ4 в основной группе вновь снижается до значений, практически не отличающихся от таковых в контрольной группе: 44,6±3,6 пг/мл и 44,6±3,7 пг/мл (p>0,95).
Аналогично ИЛ4 менялось содержание ИФНγ, оно тесно зависело от фактора «этапы наблюдения» – η2=69%, F=1539, p<<0,0001. При этом зависимость от способа лечения и сочетания этих факторов также оказалась достаточно очень сильной и равноценной – η2=51%, F=335, p<<0,0001 и η2=51%, F=83, p<<0,0001. Следовательно, в данном случае имело место заметное различие общего уровня содержания ИФНγ при наличии заметного своеобразия его поэтапных изменений. При этом, как и во всех описанных выше случаях, в каждой группе зависимость уровня ИФНγ от фактора «этап наблюдения» оказалась очень жесткой – η2=96%, F=423, p<<0,0001 и η2=99%, F=1524, p<<0,0001.
Как видно на рисунке 4, до начала лечения средний уровень содержания ИФНγ в основной и контрольной группах достаточно близок и значимо не различается – 156,7±19,5 пг/мл и 152,8±21,4 пг/мл соответственно (p>0,44). На 10-й день с начала лечения в основной группе средний уровень содержания показателя возрастает примерно в 1,5 раза (до 225,8±11,9 пг/мл), а в контрольной группе снижается до 146,6±25,2 пг/мл. К завершению лечения и через месяц после него средний уровень содержания ИФНγ в обеих группах практически стабилизируется, но на уровне примерно втрое меньшем, чем на 10-й день лечения. При этом средний уровень ИФНγ в основной группе вдвое и значимо выше, чем в контрольной группе. Через 3 месяца средний уровни содержания ИФНγ в основной и контрольной группах вновь сближаются и значимо не различаются – 37,9±5,0 пг/мл и 36,5±4,9 пг/мл соответственно (p>0,26).
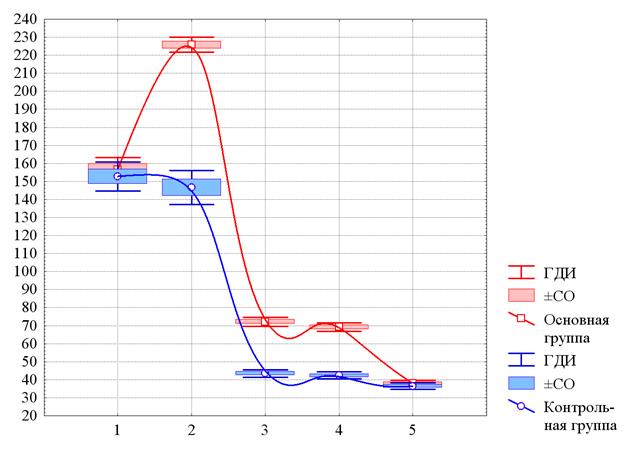
Рис. 4. Изменения среднего уровня ИФНγ у больных ИНТВГ на различных этапах наблюдения
По оси ординат – содержание ИФНγ в плазме крови в пг/мл. По оси абсцисс – этапы наблюдения: 1 – до начала лечения, 2 – на 10-й день с начала лечения, 3 – при выписке, 4 – через 1 месяц после завершения лечения, 5 – через 3 месяца после выписки. По оси ординат – численность лейкоцитов (109/л). ГДИ и ±СО – границы доверительного интервала и стандартная ошибка среднего значения (m). Аппроксимация непрерывных изменений получена методом наименьших квадратов.
Сила влияния факторов на уровень и динамику показателей гуморального иммунитета в исследованных группах
|
Показатели |
Сила влияния одного фактора – «метод лечения» |
Сила влияния двух факторов – «метод лечения» и «этапы лечения» |
||||
|
η2 (%) |
F |
r* |
η2 (%) |
F |
r* |
|
|
Показатели гуморального иммунитета |
||||||
|
ФНОа |
4* |
31 |
0,2 |
7* |
13,3 |
0,26 |
|
ИЛ1β |
7* |
28 |
0,26 |
4* |
24 |
0,20 |
|
ИЛ4 |
27* |
696 |
0,52 |
50* |
595 |
0,71 |
|
ИФНγ |
51* |
335 |
0,71 |
51* |
83 |
0,71 |
Примечание: η2 – сила влияние фактора, F – критерий Фишера, р – уровень значимости, r* – коэффициент канонической корреляции, * – достоверность различий при р<<0,0001, ** – при р<0,05.
Выводы. Результаты показали, что картина последовательных изменений большинства изученных показателей иммунитета в каждой из групп у детей, больных трихофитией, была практически идентична.
Отсутствие статистически значимых различий среднего уровня индикаторов гуморального иммунитета в изучаемых группах до начала лечения и через 3 месяца после выписки из стационара, когда произошло полное излечение больных, свидетельствует об однородности совокупности, из которой производились отбор пациентов и распределение в группы наблюдения.
В ходе исследования было установлено, что клинико-иммунологические показатели в основной группе оказались статистически значимо выше, чем в группе контроля, в которой был применен традиционный подход (монотерапия гризеофульвином), за счет иммунотерапевтического эффекта комбинированной терапии (гризеофульвин + ликопид). В основной группе происходит повышение иммунологической реактивности организма больных, усиливается выработка провоспалительных цитокинов – ИЛ1β, ИЛ4 и ИФНγ, что выражалось в быстром приросте большинства исследованных показателей гуморального иммунитета уже на 10-е сутки в сравнении с группой контроля. Все это способствовало более ранней положительной динамике в клинической картине болезни и может свидетельствовать о достаточной силе влияния метода лечения с применением ликопида в основной группе в сравнении с контролем. Предлагаемый метод лечения трихофитии (гризеофульвин + ликопид) в большинстве случаев оказывал влияние средней силы на последовательные изменения исследованных индикаторов состояния гуморального иммунитета.



