Синдром острой энтеральной недостаточности (ОЭН) – патологический симптомокомплекс, осложняющий множество заболеваний и критических состояний в медицине. Данное осложнение может встречаться при сахарном диабете, ОНМК, различных инфекциях, уремии и ХПН, передозировке лекарств (нейролептиков, антидепрессантов, опиатов и др.), переломах позвоночника и пр. Однако чаще других с данным синдромом встречаются абдоминальные хирурги. Снижение перистальтики кишечника после операции описывается с конца 1800-х гг. Было опубликовано множество исследований по послеоперационной кишечной непроходимости, однако ее патогенез остается загадкой. Экономический ущерб от кишечной непроходимости оценивается в США в 750 тыс. – 1 млрд долларов [1–3]. Этиологию ОЭН лучше всего можно охарактеризовать как многофакторную. Эти факторы действуют одновременно или в разное время в течение послеоперационного периода. Механизмы, участвующие в ОЭН, включают тормозящее симпатическое воздействие; высвобождение гормонов, нейротрансмиттеров и других медиаторов; воспалительную реакцию и эффекты анальгетиков. В экспериментальных исследованиях продолжается выяснение роли и механизмов действия всех этих факторов. Эндогенные опиаты, которые выделяются после операции, по мнению ряда авторов, могут являться причиной ОЭН. Их влияние на опорожнение желудка и сокращение гладких мышц кишечника опосредуется µ-опиоидным рецептором. Энкефалин является мощным агонистом дельта-опиоидных рецепторов, который, как сообщалось, подавляет перистальтику желудка и повышает тонус привратника в экспериментах на животных [4–6]. Одной из наиболее частых причин ОЭН является распространенный перитонит. В данном случае постепенно возникает супераддированная инфекция, и Escherichia coli и Bacteroides являются самыми распространенными микроорганизмами. Полость брюшины резко воспаляется с образованием воспалительного экссудата, который распространяется по брюшине, что приводит к расширению кишечника и СЭН [7–9]. Перитонит вызывает кишечную непроходимость вначале из-за воспаления, затем из-за бактериальных токсинов. Бактериальный липополисахарид вызывает СЭН, инициируя воспалительную реакцию в слоях гладких мышц кишечника и последующее снижение сократимости гладких мышц in vitro и in vivo. Наиболее опасным среди прочих в патогенезе ОЭН является угнетение барьерной функции энтероцитов, что приводит к бактериальной транслокации в портальный тракт и генерализации инфекции [10, 11].
С применением иммуногистохимических методов существенно расширились возможности понимания патогенеза ОЭН. Значимая роль в развитии воспаления принадлежит различным фенотипам Т-клеток. CD3 – мультифункциональный белковый маркер Т-лимфоцитов, отвечающий за передачу сигнала после распознавания антигенов T-клеточным рецептором. CD3 регулирует пролиферацию Т-лимфоцитов, высвобождение цитокинов. CD3 нередко рассматривают как количественный маркер иммунного повреждения кишечной стенки. Кроме этого, изменения экспрессии антиапоптотического белка Bcl-2 позволяют оценить состояние энтероцитов [12].
Цель исследования: изучить иммуногистохимические изменения тонкого кишечника, используя экспериментальную модель острой энтеральной недостаточности.
Материал и методы исследования. Экспериментальная часть работы выполнена на базе ФГБУ «Научно-исследовательский институт по изучению лепры» Минздрава России. Исследования на всех этапах были выполнены в соответствии с требованиями ГОСТ ИСО/МЭК 17025-2009, ГОСТ Р ИСО 5725-2002 и «Правилами лабораторной практики», утвержденными приказом Минзравсоцразвития РФ от 23.08.2010 № 708н. Эксперимент проходил с соблюдением «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» [Directive 2010/63/EU]. Имеется заключение Этического комитета (протокол № 3 от 31.10.2011). В качестве модели мы использовали разработанную нами методику экспериментального воссоздания ОЭН [13]. Исследование проведено на 36 крысах-самцах линии Wistar с массой тела 250±30 г, сопоставимых по возрасту. Животным перорально вводился лоперамид (ЛСР-004065/09) 2 раза в сутки в дозе 0,09 мг/сут на 1 кг массы тела с интервалом между введениями 12 ч в течение 5 суток. У животных был обычный, привычный водно-пищевой режим. После моделирования ОЭИ крысы по одной располагались на белом листе бумаги для оценки количества дефекаций (болюсов) в течение 24 ч. Учитывалось среднее число дефекаций по количеству болюсов. Животные под наркозом выводились из эксперимента через 72 и 120 ч при формировании компенсированной (первая группа, n=12) и декомпенсированной (вторая группа, n=12) ОЭН. Результаты сравнивались с результатами контрольной группы интактных животных. Осуществлялся забор образцов тонкого кишечника для проведения морфометрического и иммуногистохимического исследования.
Иммуногистохимические исследования проведены в сертифицированной лаборатории (НПК «ПраймБиоМед», Москва). После приготовления парафиновых блоков и получения срезов для расплавления парафина срезы помещали в термостат (Смоленское СКТБ-СПУ, Россия) и нагревали при 60°С в течение 30 мин. Депарафинирование срезов осуществляли в двух сменах о-ксилола («Химмед», Россия) по 10 мин в каждой емкости. Затем следовала регидратация срезов в серии изопропиловых спиртов («Химмед», Россия) убывающей концентрации (100%, 100%, 70%, 50%) в емкостях по 5 мин в каждом. Срезы, освобожденные от парафина, промывали в дистиллированной воде 2 мин. Для блокировки эндогенной пероксидазы использовали раствор для блокировки эндогенной пероксидазы (НПК «ПраймБиоМед», Россия) в виде 5–10-минутной инкубации в емкости с раствором. Температурное восстановление эпитопов антигенов проводили в растворе цитратного буфера, pH 6 (НПК «ПраймБиоМед», Россия) в камере для демаскировки и депарафинизации (BioCare, США) в режиме 110°С 10 мин с последующим остыванием срезов в буфере в течение 20 мин. Срезы промывали в двух сменах дистиллированной воды. Дальнейшую работу со срезами проводили в планшете – влажной камере. Срезы предварительно обводили гидрофобным маркером (Daido Sangyo, Япония) для предотвращения растекания реагентов по стеклу и во избежание высыхания заливали буферным раствором для промывки (PBS-T) (НПК «ПраймБиоМед», Россия). Блокировку неспецифического связывания антител проводили с помощью блокирующего раствора (НПК «ПраймБиоМед», Россия), нанесением по 100 мкл на срез и инкубацией 10 мин. Кроличьи антитела к Bcl-2, клон SP66 (Roche, Швейцария) разводили 1:200 в разбавителе антител, кроличьи антитела к CD3 (НПК «ПраймБиоМед», Россия) разводили 1:200. Срезы инкубировали с первичными антителами по 50–100 мкл на срез 1 ч при комнатной температуре во влажной камере, а затем промывали PBS-T буфером 3 раза по 2 мин. В качестве системы детекции использовали систему UltraVision Quanto Detection System HRP Polymer (ThermoFisher, США) в соответствии с инструкцией производителя, а именно: наносили по 2 капли линкера на срез на 10 мин, промывали PBS-T буфером 3 раза по 2 мин, затем наносили по 2 капли на срез конъюгат с HRP-полимером на 10 мин и промывали PBS-T буфером 4 раза по 2 мин. Раствор хромогена брали из Универсальной поливалентной системы № 1 с HRP DAB (НПК «ПраймБиоМед», Россия): непосредственно перед нанесением готовили смесь 1:1 DAB (реагент B1) и буфера для DAB (реагент B2), на срез наносили по 50–100 мкл смеси и инкубировали 5–10 мин в зависимости от развития коричневой окраски. Промывали в PBS-T буфере для закрепления DAB и в дистиллированной воде. Для визуализации ядер использовали гематоксилин Майера («БиоВитрум», Россия) по инструкции производителя 5 мин в ванночке с раствором. Ополаскивали дистиллированной водой и подсинивали ядра в проточной воде, а затем снова переносили в дистиллированную воду. Дегидратацию срезов проводили в ванночках со сменами изопропиловых спиртов («Химмед», Россия) с повышающейся концентрацией (50%, 70%, 100%, 100%) по 3 мин в каждой. Просветление срезов осуществляли в двух сменах о-ксилола («Химмед», Россия) по 3 мин в каждой. Монтировали полученные препараты под покровное стекло в среду на основе ксилола Витрогель (НПК «ПраймБиоМед», Россия).
Полученные препараты исследовали с использованием микроскопа Olympus BX53 (Olympus, Япония) с набором объективов UPlanFL N 4x/0.13, UPlanFL N 10x/0.30, UPlanFL N 40x/0.75. Фотографии делали с помощью камеры Infinity 2 (Lumenera, Канада) при 40х и 100х увеличениях. Количественную оценку окрашенных областей проводили визуально по полям зрения. Анализ изображений осуществлялся с помощью программы «Микроанализ Pro» (ООО «ЛОМО-Микросистемы», Санкт-Петербург). Исследовали следующие показатели: длину ворсинок (ДВ), ширину ворсинок (ШВ), глубину крипт (ГК), ширину крипт (ШК). Для каждого маркера определяли оптическую плотность и площадь экспрессии. Указанные параметры отражают интенсивность синтеза или накопления исследуемых молекул. Относительную площадь экспрессии рассчитывали как отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения и выражали в процентах. Оптическую плотность экспрессии измеряли в условных единицах. Для оценки различий между группами обследуемых применялся параметрический непарный t-критерий. В качестве критического порога значимости выбирался уровень 0,05. Для установления корреляционной связи вычислялся коэффициент парной корреляции Пирсона для номинальных переменных. Для описания данных использовали среднее значение (m) с указанием стандартного отклонения (sd). Статистическую обработку данных, полученных в ходе эксперимента, проводили с использованием пакетов статистических программ Microsoft Excel 2010 и STATISTIKA 6.0.
Результаты исследования и их обсуждение. В контрольной группе морфологически визуализировались толстая слизистая, практически не нарушенная со стороны просвета, широкие и длинные ворсинки. Длина ворсинок ДВ составляла в среднем 365,3±4,3 мкм, ширина ворсинок ШВ – 65,3±0,9 мкм, ГК – 76,3±0,6 мкм, ширина крипт ШК – 31,3±0,4 мкм. В контрольной группе отмечены клетки, отличные от фона, окрашенные Bcl-2.
При морфологическом исследовании в первой группе гистологическая картина характеризовалась выраженным воспалением в строме ворсинок, отмечалась выраженная лимфоплазмоцитарная инфильтрация без примесей нейтрофилов с малым количеством эозинофилов и клеток Панета. Происходило слущивание эпителия, однако участков обнажения собственной пластинки слизистой оболочки не наблюдалось. Лизиса клеток не отмечалось. При морфометрии ДВ составляла в среднем 205,3±6,3 мкм, ШВ – 55,3±1,3 мкм, ГК – 63,3±0,9 мкм, ШК – 26,3±0,5 мкм (p≤0,05). Среднее количество болюсов на 2-е сутки было 1,1, далее дефекации не отмечено. Иммуногистохимические изменения в первой группе: отмечалось большое количество CD3-положительных (T-клеток), которые локализованы в основном в верхней части ворсинок (в центре), кроме этого, также в этих же зонах встречаются Bcl-2+ клетки. В центре кишечных ворсинок наблюдается воспалительный инфильтрат с преобладанием CD3+ T-лимфоцитов, T-клетки также локализованы в верхней части ворсинок (рис. 1).
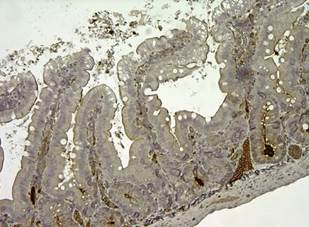 a
a 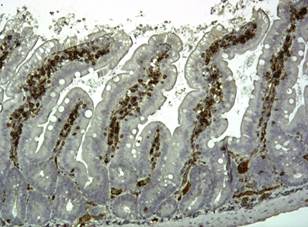 b
b
Рис. 1. Распределение Bcl-2, CD-3 иммунореактивных клеток слизистой оболочки тонкой кишки крыс при моделировании острой энтеральной недостаточности: а – Bcl-2 иммунореактивные энтероциты в эпителии крипт при компенсированной модели ОЭН;
b – распределение CD-3+ Т-лимфоцитов в эпителии крипт при моделировании компенсированной ОЭН. Ув. х100
Во второй группе картина характеризовалась утончением слизистой оболочки тонкой кишки, лизисом клеток верхней части ворсинок, при этом основание ворсинок расширено из-за обилия лимфоидных клеток. Клетки Панета отсутствовали. При морфометрическом анализе выявлены значительные изменения размеров ворсинок и крипт – ДВ 145,5±5,2 мкм, ШВ – 42,3±0,8 мкм, ГК – 53,3±0,9 мкм, ШК – 22,2±0,5 мкм (p≤0,05). Дефекация отсутствовала во все сроки наблюдения. Отмечалось уменьшение количества T-клеток (CD3) за счет того, что из-за лизиса ворсинок сохраняется только их нижняя треть, где локализованы эти клетки. Экспрессия Bcl-2 во второй группе практически отсутствовала (антитела проверены на мезентеральных лимфатических узлах, где показано слабое, но специфичное связывание) (рис. 2).
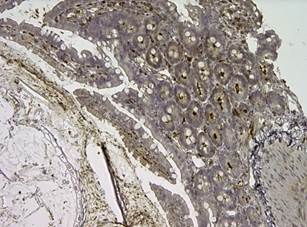 a
a 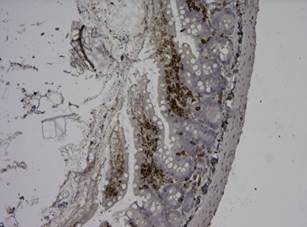 b
b
Рис.2. Распределение Bcl-2, CD-3 иммунореактивных клеток слизистой оболочки тонкой кишки крыс при моделировании острой энтеральной недостаточности: а – отсутствие экспрессии Bcl-2 в кишечном эпителии на опытных моделях декомпенсированной ОЭН;
b – CD3+ клетки располагаются преимущественно в апикальной области стромы ворсинок. Ув. х100
Таким образом, в настоящей работе установлены динамика экспрессии провоспалительного и антиапоптического маркеров и их взаимосвязь с комплексом морфологических изменений в стенке тонкого кишечника крыс при моделировании ОЭН. В первой группе через 72 ч после начала эксперимента в микропрепаратах отмечались выраженные явления воспаления в виде лимфоплазмоцитарной инфильтрации. В эпителии ворсинок встречаются единичные дистрофически измененные клетки, имеющие вид крупных вакуолей. Отмечаются укорочение и истончение кишечных ворсин. В единичных полях зрения наблюдается слущивание эпителия энтероцитов в апикальной части. При этом отмечалось обнажение соединительнотканной основы ворсинок в просвет кишки. Достоверно увеличивалось количество CD3+ клеток, которые локализовались преимущественно в центре верхней части ворсинок. Экспрессия Bcl-2 несколько снижалась в сравнении с контролем (p≥0,05).
Во второй группе в микропрепаратах прогрессировали укорочение и истончение кишечных ворсинок. Толщина кишечной стенки уменьшалась. Исчезали клетки Панета. Отмечалась массивная десквамация эпителиальных клеток в области верхушек таких боковых стенок с обнажением соединительнотканной основы. Отмечены достоверное снижение CD3+ и практически полное отсутствие Bcl-2+ клеток (табл.).
Иммуногистохимические показатели в группах исследования
*– достоверность изменений значений при р≤0,05 по отношению к предыдущему исследованию
|
Показатель |
Контроль (n=12) |
Модель компенсированной ОЭН (n=12) |
Модель декомпенсированной ОЭН (n=12) |
|
Me [min; max]; M±sd |
|||
|
Оптическая плотность энтероцитов, иммунопозитивных к Bcl-2, у.е. |
0.154±0.043 [0,121;0,198] |
0, 124±0,032 [0,09;0,176] |
0,011±0,003* [0,009;0,023] |
|
Относительная площадь экспрессии энтероцитов, иммунопозитивных к Всl-2, % |
11,764±0,385 [8,43;12,34] |
9,342±0,211 [7,65;10,11] |
0,322±0,011* [0,25;0,76] |
|
Оптическая плотность энтероцитов, иммунопозитивных к CD-3, у.е. |
1,07±0,16* [0,71;1,45] |
3,27±0,44* [2,76;6,43] |
0,54±0,09* [0,43;0,74] |
|
Относительная площадь экспрессии энтероцитов, иммунопозитивных к CD-3, % |
14,43±3,56 [9,11;21,44] |
46,34±5,23* [32,12;59,65] |
9,21±1,43* [6,45;11,76] |
По данным некоторых авторов, снижение абсолютного числа лимфоцитов более чем на 65% абсолютного числа CD8+ клеток на 80% свидетельствует о некротических изменениях тонкой кишки [14]. В нашем исследовании отмечено, что при морфологической картине декомпенсированной, необратимой ОЭН относительная площадь экспрессии энтероцитов, иммунопозитивных к CD-3, уменьшались на 36%. Отсутствие экспрессии Bcl-2 служит дополнительным доказательством необратимых апоптических изменений энтероцитов.
Заключение. На основании проведенных морфометрических и иммуногистохимических исследований можно сделать вывод, что используемая модель компенсированной и декомпенсированной ОЭН может быть применена в экспериментальной хирургии для разработки и апробации новых методов лечения.



