В период полового созревания функциональная незрелость репродуктивной системы настолько очевидна, что различные негативные факторымогут толькоусугублять его течение у подростков. В этом случае становление менструального цикла нередко сопровождается высокой частотой позднего менархе, нарушением цикла и в дальнейшемнеизбежно приводит к патологии репродуктивной системы. Развитие симптомов гиперсекреции андрогенов может происходить в различные возрастные сроки – от пубертата до менопаузального периода [1]. Проблема изучения структурно-функциональной организации регуляции дофаминавызывает интерес вследствие того, что нарушение функционирования дофаминергической системы является одним из значимых факторов в патогенезе многих заболеваний [2]. В гипоталамусе и гипофизе дофамин играет роль ингибирующего медиатора, влияющего на секрецию некоторых гормонов [3,4].Необходимо отметить, что тормозящее действие нейрогормона реализуется при различных его концентрациях, что обеспечивает высокую специфичность регуляции[5]. В связи с тем, что одной изпричин патологии репродуктивной системы является синдром гиперандрогении, разработка диагностических критериев гиперандрогенной дисфункции яичниковсвязанасопределенными трудностями вследствие полиэтиологичностипроцесса, а также обусловлена дефицитом исследованийв ракурсе особенностей нейроэндокринных взаимоотношений при гиперандрогении ивлияния различных факторов на активацию и функционирование гипоталамо-гипофизарно-надпочечниково-яичниковой оси. Существенная связь между андрогенами и функциональной активностью дофаминергической системы головного мозга позволяет задуматьсяо целесообразностидальнейших исследований влияниягормона на яичниковый и надпочечниковыйстероидогенез.
Цель исследования: изучить роль дофамина в развитии гиперандрогенной дисфункции яичников у девочек-подростков.
Материалы и методы исследования
Для осуществления поставленных задач в исследование были включены 125 подростков, обратившихся к детскому гинекологу с жалобами на различные клинические проявления синдрома гиперандрогении и нерегулярный менструальный цикл. Согласно созданным критериям невключенияв клинические группы обследуемыене должны были иметь половых контактов, хромосомной патологии,тяжелой соматической патологии, воспалительных заболеваний органов малого таза. I группусоставила61 пациентка с регулярным менструальным циклом и андрогенной дермопатией (акне, гирсутизм) и нормальным индексом массы тела.Во II группу были включены 64 девочки-подростка с аналогичными клиническими проявлениями андрогенной дермопатии(акне, гирсутизм) и нарушениями ритма менструаций. В контрольную группу вошли 20 здоровых девочек-подростков. Состав и характеристика клинических групп представлены в таблице 1.
Таблица 1
Состав и характеристика клинических групп
|
Группы (n=145) |
Возраст, (лет) |
Возраст менархе (лет) |
Диагноз (шифр МКБ) |
|
Iгруппа (n=61) |
15,8 (14,9;16,7) |
13,1 (11,7;14,6) |
Избыток андрогенов (E28.1) |
|
IIгруппа (n=64) |
16,1 (15,4; 17,2) |
14,3 (12,9;15,7) |
Олигоменорея I и II (N91.3; N91.4), Избыток андрогенов (E28.1) |
|
Контрольная группа (n=20) |
16,4 (15.2; 17,7) |
12,8 (11,7;13,9) |
Пубертатный период (II фаза) |
Для оценкипоказателей нейроэндокринной регуляции,функционального состояния гипофизарно-надпочечниковой и гипофизарно-яичниковой осиисследовался уровень дофамина (пг/мл) в плазме крови. Методом иммуноферментного анализа определялись показатели лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), эстрадиола (E2), пролактина, свободного тестостерона (Тсв), общего тестостерона, (Т) дегидроэпиандростерон-сульфата (ДГЭА-С), дегидроэпиандростерона (ДГЭА), 17-гидроксипрогестерона (17-ОП) и адренокортикотропного гормона (АКТГ).
В исследовании использовалась описательная статистика, с помощью которой оценивались значения медианы и интерквартильного размаха (25%, 75%). Статистическая значимость результатов рассчитывалась при доверительной вероятности 95%. Сравнение межгрупповых различий осуществлялось с использованием непараметрического критерия Вилкоксона. Уровень значимости был равен 0,05. Статистическая обработка полученных эмпирических данных велась с использованием пакетов прикладных программ Statistica версии 10.01, EXCEL 2010.
Результаты исследования и их обсуждение
Существенными факторами, влияющими на полноценность и исход пубертата, являются материнский анамнез и оценка показателей течения анте- и перинатального периода. В нашем исследовании 25,1% девочек-подростков I клинической группы и 39,1% пациенток II группы (p=0,05) рождены от женщин, имеющих клинические симптомы гиперпродукции андрогенов (гирсутизм, олигоменорея, ановуляция, бесплодие). Кроме этого, нами выявлено, что у 18,1% матерейI группыи 24,6% матерей обследуемых II группы задолго до беременности был установлен диагноз «гиперандрогенизм».При этом нерегулярный менструальный цикл отмечали10,2% матерейдевочек I группы и23,1% матерей опрошенных II группы (p=0,001). Необходимо отметить, что однимиз частых вариантовгиперандрогении является наличие стертых форм, в связи с чем, вероятно, остальные женщины имели регулярный менструальный цикл. В гестационном периоде32,4% матерей обследуемых отмечали влияние стрессорных факторов (эмоциональный и физический стресс). Так, в I группе на наличие факта стрессовой ситуации указывали 16,5% женщин, во II группе – 28,9% опрошенных матерей (p=0,01). Неблагоприятное течение беременности и родов отмечали 30,7% матерей девочек I группы и 48,5% –II группы (p=0,04).
Течение препубертатного периода у обследуемых подростков тоже имело свои особенности. На преждевременное и/или ускоренное адренархе(что, вероятно, явилось показателем избытка андрогенов(p=0,05)) в I группебыло указано в13,3% случаев,во II группе– в 26,1% случаев. По данным проведенного опроса неправильная последовательность появления вторичных половых признаков по Таннеру была выявлена у 14,9% девочек в I группе и у 28,2% обследованных во II группе(p=0, 001).
При оценке частоты проявлений андрогенной дермопатии в 68,8% случаев отмечался гирсутизм, в 57,3% –акне. Степень гирсутизма далеко не всегда соответствует уровню повышения андрогенов в крови. Незначительное увеличение содержания андрогенов может сочетаться с выраженным гирсутизмом, и наоборот, повышение лабораторных показателей андрогенов может не сопровождаться клиническими проявлениями андрогенной дермопатии. Данное расхождение свидетельствует о различнойчувствительности волосяных фолликулов к тестостерону [6].
Классификация нарушений менструального циклау обследуемых девочек-подростков показала, что частота олигоменореи составила88,8% случаев,а вторичнаяаменореянаблюдалась у 11,2% девочек-подростков. До конца неразрешенным вопросомранней диагностики гиперандрогении является то, что в пубертатном периоде наличие признаков избыточноговлияния андрогенов на кожу, олигоменорея, а также мультифолликулярная структура яичников и увеличение их объема у некоторых пациенток могут являться вариантами нормы [7,8]. В тоже время главным показателемрепродуктивного здоровья девочки-подростка всегда был и остается менструальный цикл. В связи с этим поводом для терапевтической настороженности может явитьсянерегулярность менструального цикла через два года после менархе в сочетании с клиническими проявлениями избытка андрогенов. В нашем исследовании девочки-подростки с олигоменореей или вторичной аменореейи признаками гиперандрогении в 24,6% случаев имели позднее менархе,что, возможно,является косвенным маркером дисфункции яичников в дальнейшем.
Известно, что главнымисточникомандрогенов в препубертатном периоде и раннем пубертате являются надпочечники. Анализ уровняандрогенов в зависимости от имеющихся нарушений менструальной функции выявил значимое повышение продукции исследуемых андрогенов у девочек с патологическим ритмом менструаций по сравнению с пациентками, имеющими проявления только андрогенной дермопатии. Данный факт объясним преобладанием неклассических генных мутаций и экспансией в девиантныйстероидогенезкак надпочечников, так и яичников. Степень участия яичников и надпочечников в процессе имеет прямую зависимость отразличной чувствительности ферментов, а также обусловленаих различным распределением в зонах желез [9].В результате проведенного исследования выявлено (табл.2), что у девочек, имеющих нарушения менструального цикла, медиана значений дофамина 6346 (970,0; 8940) пг/мл была достоверно выше соответствующих показателей обследуемых без нарушений менструального цикла (p=0,01).
Таблица 2
Показатели дофамина в плазме кровиу подростков клинических групп
|
Группы (n=145) |
Дофамин (пг/мл) |
|
Iгруппа (n=61) |
3975,3 (1930,0;5700,0) |
|
II группа (n=64) |
6346,3 (970,0;8940,0) |
|
Контрольная группа (n=20) |
2350,0 (1070,0; 2700,0) |
|
p 1 |
0,04 |
|
p2 |
0,01 |
|
p3 |
0,02 |
Примечание: p – статистические различия между группами: р1 – I и контрольной группой; р2 – II и контрольной группой; р3 –I и II группой
Эти данные не противоречат заключению о том, что изменениедофаминовой системы может явиться триггером, ухудшающим течение гиперандрогенизма [10]. В период физиологической и функциональной незрелостирепродуктивной системы имеет место несоответствие фактического резерва адаптационных возможностей запросамсозревающего организма, что, несомненно, приводит к нарушениям регуляции и избыточной активации нейроэндокринной системы[11].
При исследовании показателей психоэмоционального фона у 41,2%девочек-подростков с проявлениями гиперандрогении имели место признакисубклинической депрессии или повышенной тревожности. Депрессия легкой степени была отмеченау 23,6% пациенток I группыиу31,1% II группы. 29,1% девочек в нашей выборке констатировали наличие психотравмирующей ситуации (смерть родственников, неблагополучные отношения между родственниками), что служит косвенным подтверждением значимости эмоционального фактора в развитии менструальной дисфункции. Данный факт является подтверждением постулата, что в пубертатном периоде имеет место особая уязвимость структур, ответственных за полноценностьфункционирования нейроэндокринной системы растущего организма [12,13].
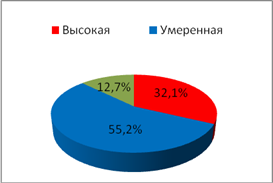
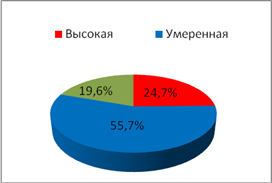
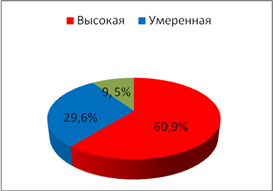
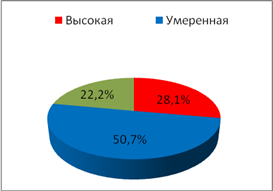
С целью исследования показателей ситуационной и личностной тревожности у обследуемых использовался стандартный опросник Спилбергера–Ханина, гденизким считался уровеньне более 30 баллов, умеренным – 31–44 балла, высоким – свыше 45 баллов.При анализе частоты встречаемости типов тревожности (рис. 1,2) было отмечено увеличениечастоты встречаемости показателя личностной тревожности высокой степениу пациенток II группы с нарушениями менструального цикла по сравнению с пациентками I группы (p=0,007).
Личностная тревожность
Ситуационная
Рис. 1.Частота встречаемости типов тревожности у обследуемых I группы
Личностная тревожность
Ситуационная
Рис. 2.Частота встречаемоститипов тревожности у обследуемых II группы
В I группе обследуемых отмечено возрастание частоты случаевумеренной степени тревожности по сравнению с обследуемымиII группы (p=0,005). В частоте случаев проявлений ситуационной тревожности статистических различийвыявлено не было.
Исследование связей дофамина с адреналовыми андрогенами позволило выявить прямую статистически достоверную связь гормона с17-ОП, ДГЭА-С, АКТГ(табл.3).Это объясняется тем, что неблагоприятный психоэмоциональный фон оказывает влияние на факторы активации оси гипоталамамус – гипофиз – надпочечники, что проявляется в нарушении синтеза АКТГ, непосредственно контролирующего адекватный уровень андрогенов крови [14].
Таблица 3
Показатели корреляционной связи дофамина у девочек-подростковисследуемых групп
|
Гормоны Показатели корреляции |
17-ОП |
ДГЭА-С |
АКТГ |
ЛГ |
ФСГ |
Э2 |
||||||
|
R |
p |
R |
p |
R |
p |
R |
p |
R |
p |
R |
p |
|
|
Дофамин |
0,27 |
0,05 |
0,53 |
0,04 |
0,77 |
0,02 |
0,67 |
0,04 |
0,94 |
0,20 |
-0,44 |
0,03 |
Примечание: R – коэффициент корреляции по Спирмену:
знак (–) свидетельствует об обратной корреляционной связи; отсутствие знака «–» – о прямой корреляционной связи;
p – значимость корреляционной связи по Спирмену
Исследование связей дофамина с гонадотропными гормонами выявило положительную корреляцию нейрогормона с ЛГ (p=0,04)у девочек II группы, что, возможно, обусловлено нарушением цирхоральной секреции гонадотропин рилизинг-гормона на фоне разбалансированности дофаминергической регуляции [15].Пиковые значения ЛГ оказывают влияние на гиперпластические процессы в тека ткани яичников, что существенно снижает показатели эстрадиола в крови [16]. Данную связь подтверждает обратная корреляция дофамина со значениями эстрадиола крови (p=0,03). Примечательно, что у девочек, не имеющих менструальной дисфункции, корреляции дофамина с вышеуказанными показателями не отмечено.
Заключение
Таким образом, у обследуемых с синдромом гиперандрогенииотмечается статистически значимое увеличение показателей дофамина крови. Нарушения дофаминергической регуляции, связь дофамина с андрогенами, гонадотропинами и половыми стероидами подтверждают вкладнейрогормона в формирование гиперандрогенной дисфункции яичников. Наиболее закономерными факторами, ярко демонстрирующими причинно-следственную связь между овариальной дисфункцией и избыточной секрецией андрогенов, являются активация оси гипоталамус – гипофиз – надпочечники, десинхронизация продукции гонадотропинов и соответственно половых стероидов.



