В современном мире отмечается неуклонный рост числа аллергических заболеваний (АЗ) [1]. У детей раннего возраста наиболее частым проявлением АЗ является пищевая сенсибилизация, при этом наиболее распространенным аллергеном у данной возрастной группы рассматривается белок коровьего молока. Клиническая картина аллергии к БКМ (АБКМ) весьма многообразна и сложна. Ее различные клинические проявления, характеризующиеся при этом широким спектром изменений и различной тяжестью, описаны в многочисленных исследованиях и рекомендательных документах, подтверждающих участие в патологическом процессе различных органов и систем [1]. Гастроинтестинальные проявления АБКМ считаются наиболее труднодиагностируемыми и характеризуются многообразием клинических проявлений со стороны желудочно-кишечного тракта, частым развитием нутритивной недостаточности, отсутствием эффективных методов диагностики [2].
Одним из патогенетических механизмов формирования АБКМ являются нарушение состоятельности кишечного барьера и повышение его проницаемости [3, 4]. Исследования последних лет показывают, что, помимо гомеостаза воды и соли, а также переваривания и поглощения питательных веществ, другой ключевой функцией кишечника служит регулирование переноса антигенов окружающей среды через барьер слизистой оболочки кишечника. Плотные кишечные соединения (TJ) ответственны за параклеточный перенос макромолекул, и, следовательно, они способствуют поддержанию баланса между толерантностью и иммунным ответом на пищевые антигены [5]. Хотя в настоящее время хорошо описана ультраструктура TJ, относительно мало известно об их патофизиологической регуляции, приводящей к локальному и/или системному аллергическому воспалению.
Зонулин, предшественник гаптоглобина – единственный известный на настоящий момент белок, участвующий в физиологической регуляции как эпителиальных, так и эндотелиальных барьерных функций путем модуляции межклеточных TJ-контактов [6]. Его открытие позволило лучше понять сложные механизмы, которые регулируют парацеллюлярный транспорт, а также роль кишечной проницаемости и состоятельности кишечного барьера в поддержании гомеостаза. Зонулин может использоваться в качестве биомаркера нарушенной барьерной функции кишечника при аллергических заболеваниях и в будущем способен стать потенциальной терапевтической мишенью для лечения этих состояний [7].
Цель исследования: изучить содержание зонулина в образцах мочи и кала у детей с аллергией к коровьему молоку и уточнить его диагностическое значение.
Материалы и методы исследования
В данное исследование были включены 65 детей раннего возраста (от 3 месяцев до 3 лет) с аллергией к коровьему молоку (I группа), контрольную группу сформировали 20 сопоставимых по полу и возрасту здоровых детей без признаков аллергических заболеваний в анамнезе (II группа). Родители всех пациентов дали письменное согласие на участие в исследовании. Исследование было проведено с учетом требований Хельсинской декларации Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Министерства РФ от 19.06.2003 № 266.
Зонулин в моче и кале изучали с использованием метода ELISA (энзим-связанного иммуносорбентного анализа) с помощью реактивов фирмы Immunоdiagnostik (Германия) вместе с многочисленными копрологическими исследованиями.
Статистический анализ был осуществлен с помощью программного пакета «Statistica 13». Были использованы стандартные методики описательной статистики, рассчитан непараметрический тест Манна–Уитни для сравнения количественных показателей, проведен корреляционный анализ с расчетом коэффициента корреляции Спирмена для определения связи и значимости различий между признаками. Чувствительность (Se), а также специфичность (Spe) данных методов исследования были оценены с помощью ROC-анализа.
Результаты исследования и их обсуждение. При изучении анамнестических данных в 95% случаев установлена взаимосвязь между началом заболевания и введением в рацион питания детей белка коровьего молока.
После проведения анализа клинических проявлений заболевания установлено, что у всех детей I группы отмечалось нарушение характера стула в 100% случаев, рвота и срыгивания – у 23% и 91% детей соответственно, явления метеоризма и флатуленции – у 95,4% и 91% детей соответственно. После проведения многократных копрологических исследований были выявлены следующие копрологические нарушения: йодофильная флора у 89,23%, перевариваемая клетчатка у 60%, амилорея у 92,3%, креаторея у 46,15%, смешанная стеаторея и стеаторея II типа у 53,85% и 46,15% пациентов соответственно. При проведении последующих этапов исследования для объективизации клинической картины гастроинтестинальных проявлений применяли шкалу The Cow's Milk-related Symptom Score (CoMiSS). При анализе клинических проявлений у 18 детей (27,69%) по шкале CoMiSS была получена оценка, соответствующая легким проявлениям (4,1+0,8 балла); у 30 (46,15%) детей отмечались гастроинтестинальные симптомы средней степени тяжести, что соответствовало 11,2+0,5 балла; тяжелые желудочно-кишечные проявления были зафиксированы у 17 (26,15%) детей, их оценка по шкале CoMiSS составила 15,1+1,2 балла.
Для оценки состоятельности кишечного барьера и определения целостности TJ-контактов кишечника мы изучили содержание зонулина в кале у здоровых детей и детей с АБКМ. В результате проведенного исследования было установлено статистически значимое увеличение показателей зонулина в анализах кала у детей с пищевой аллергией. Так, у детей I группы (рис. 1) его уровень был более чем в 2 раза выше показателей контрольной группы и составил 1,79±0,16 нг/мл и 0,75±0,01 нг/мл соответственно, р<0,001.
При чрезмерной продукции зонулина и значительном повышении его содержания в циркулирующей крови возможно его выделение почками. Для подтверждения этого мы изучили его содержание в моче. В моче здоровых детей зонулин определялся в незначительном количестве, его содержание составило 0,54±0,05 нг/мл. У пациентов с АБКМ определение зонулина в моче показало его увеличение в 2,9 раза (рис. 2), что было подтверждено при статистической обработке полученных данных (1,58±0,12 нг/мл, р<0,05).
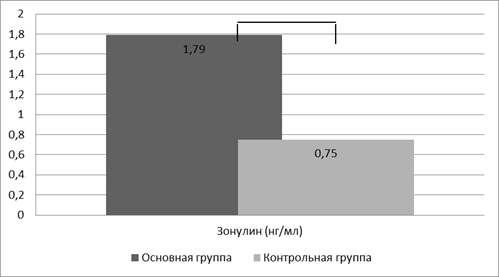
Рис. 1. Уровень зонулина в копрофильтрате, p<0,001
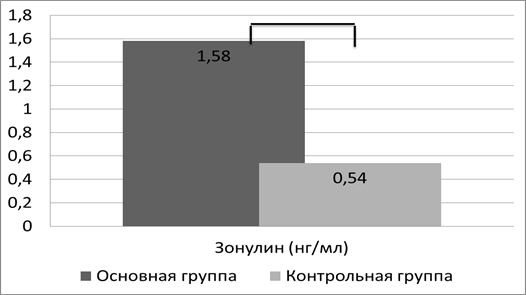
Рис. 2. Уровень зонулина в моче, p<0,05
Уровень зонулина в моче и копрофильтрате в нашем исследовании зависел от выраженности клинических проявлений АБКМ. Для оценки взаимосвязи между выраженностью клинических проявлений по шкале CoMiSS и средними концентрациями зонулина в моче и копрофильтрате мы определили коэффициент ранговой корреляции Спирмена. При этом выявлены прямолинейные корреляционные связи различной степени интенсивности между клиническими проявлениями и уровнями полученных биомаркеров (табл. 1).
Таблица 1
Взаимосвязь между выраженностью клинических проявлений и зонулином в моче и копрофильтрате. Коэффициент ранговой корреляции Спирмена
|
Показатель |
Оценка по шкале COMISS |
Зонулин в копрофильтрате |
Зонулин в моче |
|
Оценка по шкале COMISS |
– |
0,6584* |
0,5921* |
|
Зонулин в копрофильтрате |
0,6584* |
– |
0,6632* |
|
Зонулин в моче |
0,5921* |
0,6632* |
– |
Примечание * – p < 0,05 (достоверность различий)
Полученные нами в проведенном исследовании данные были подтверждены с использованием других методов статистической обработки информации, а именно при использовании ROC-кривых и анализе площадей под кривыми (Area Under Curve – AUC) для зонулина в копрофильтрате (рис. 3) и в моче (рис. 4).
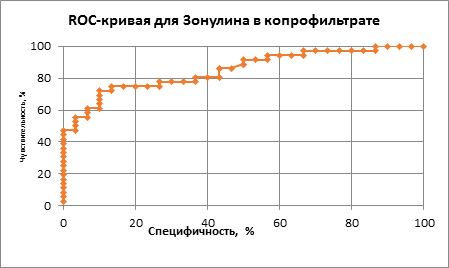
Рис. 3. ROC-кривая диагностической эффективности определения зонулина в копрофильтрате у детей с АБКМ
С помощью ROC-анализа было установлено, что показатель AUC составил 0,81 при исследовании зонулина в копрофильтрате, что подтверждает его диагностическую значимость, при этом оптимальный порог зонулина в образцах стула составил 1,21 нг/мл (чувствительность метода 73%, специфичность 90%).
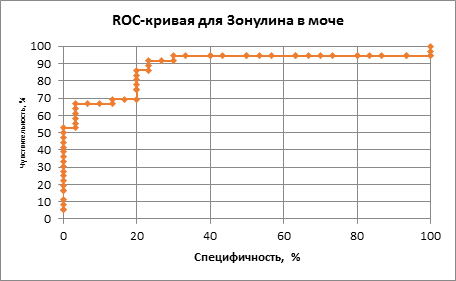
Рис. 4. ROC-кривая диагностической эффективности определения зонулина в моче у детей с АБКМ
Анализ AUC при определении уринального уровня зонулина также продемонстрировал достоверную информативность исследования и составил 0,78 (при этом оптимальный порог зонулина в моче был на уровне 91,8 нг/мл, чувствительность метода составила 91%, специфичность 76%).
В ходе дальнейшего динамического наблюдения на фоне соблюдения пациентами строгой элиминационной диеты отмечалось статистически значимое уменьшение продукции зонулина в моче и образцах стула.
Одним из патогенетических механизмов развития пищевой аллергии является нарушение состоятельности или повреждение кишечного барьера. Эпителиальные плотные соединения (TJ-контакты) поддерживают кишечный барьер, регулируя проницаемость ионов, питательных веществ, воды и различных антигенов. TJ-контакты представляют собой сложный белковый комплекс, который образует избирательно проницаемое уплотнение между соседними эпителиальными клетками и демаркирует границу между апикальными и базалокальными мембранными доменами [6]. Модификация барьерной функции TJ и парацеллюлярной проницаемости динамически регулируется различными внеклеточными стимулами и тесно связана с различными заболеваниями человека. Нарушение целостности TJ-контактов и повышенная парацеллюлярная проницаемость с последующим проникновением провоспалительных молекул могут индуцировать активацию иммунной системы слизистой оболочки, что приводит к устойчивому воспалению и повреждению тканей, в том числе других органов и систем организма [8].
Пространства между эпителиальными клетками контролируются по меньшей мере четырьмя межклеточными соединениями, которые регулируют проницаемость кишечника [6, 7, 8]. Зонулин является единственным на настоящий момент измеримым белком, который отражает проницаемость кишечника, его повышение в окружающих тканях достоверно приводит к разрушению TJ-контактов в тонком кишечнике. Опубликованные клинические и экспериментальные научные исследования [9] неоднократно продемонстрировали, что именно зонулин может быстро регулировать TJ-соединения, при этом данные изменения являются обратимыми и воспроизводимыми.
С помощью проведенного исследования мы определили повышение уровня зонулина в различных биологических жидкостях (моче и копрофильтрате) у детей с установленным диагнозом АБКМ, что свидетельствует о повышении его продукции в слизистой оболочке кишечника и является достоверным признаком нарушения состоятельности барьера кишечника. Это приводит к избыточному поступлению пищевых антигенов, продуктов метаболизма и биологически активных веществ через эпителиальный барьер, что вызывает высвобождение провоспалительных цитокинов. Присутствие цитокинов в конечном итоге поддерживает повышенную проницаемость, вызывающую массовый приток пищевых и микробных антигенов, что приводит к активации Т-лимфоцитов и формированию аллергического воспаления. Полученные нами данные о наличии прямой корреляционной связи между уровнем концентрации зонулина и выраженностью клинических проявлений заболевания подтверждают значимость этого механизма. В зависимости от генетической предрасположенности сенсибилизированные Т-клетки могут оставаться в желудочно-кишечном тракте, вызывая местное аллергическое воспаление, или мигрировать в различные органы, вызывая системные реакции, формируя тем самым реализацию атопического марша.
Выводы. Таким образом, исследование кала и мочи с определением в них зонулина может улучшить диагностику ПА у детей и является многообещающим методом контроля динамики заболевания на фоне соблюдения элиминационной диетотерапии. Его повышение в моче и кале достоверно указывает на утрату целостности кишечного барьера при формировании пищевой аллергии. Разработка технологий, способных модулировать кишечную барьерную функцию и, следовательно, контролировать аллергическое воспаление, может представлять собой инновационный подход к профилактике и/или лечению аллергических заболеваний, при которых повышенная проницаемость кишечника является неотъемлемой частью патогенеза.



