Длительный психологический стресс может не только провоцировать развитие депрессии, но также способен вызвать различные психосоматические заболевания. Большинство аутоиммунных длительно текущих заболеваний, в том числе и ревматоидный артрит (РА), характеризуются депрессивным настроением, низкой самооценкой, ангедонией и нарушениями сна, приема пищи и процессов обучения. В последние годы воспалению отводится роль основного посредника, с помощью которого психологические и физические факторы стресса могут способствовать развитию как депрессии, так и системных заболеваний. Считается, что воспаление может стать новым объектом для разработки методов лечения депрессии, а также психосоматических и соматопсихологических заболеваний.
Наряду с генетическими факторами на развитие депрессии сильно влияют стресс и факторы окружающей среды. Психологические, а также физические стрессорные факторы могут активировать иммунные и воспалительные процессы и приводить к повышению уровня цитокинов, способствуя структурным и функциональным изменениям нейронов и развитию депрессии. Роль воспаления и связанных с ним цитокинов в развитии депрессии впервые была обсуждена в 1980-х гг. В настоящее время рассматривается новый аспект процесса иммунного воспаления в ответ на стресс и депрессию: воспалительная патология обеспечивает двунаправленный путь между депрессией и коморбидными системными заболеваниями [1]. Концепция двунаправленной связи между иммунной системой и центральной нервной системой выражается как «теория депрессии макрофагов» и «гипотеза цитокинов депрессии», которая описывает большую экспрессию моноцит-ассоциированного интерлейкина-1-бета (IL-1β) и других провоспалительных цитокинов у пациентов, страдающих депрессией. Появляется информация об изменениях параметров лейкоцитов у пациентов с депрессивными расстройствами. В частности, A. Buras и соавт. (2012 г.) была выявлена положительная корреляция высоких уровней моноцитов с симптомами депрессии у больных ревматическими заболеваниями [2].
Психосоциальный стресс и системные заболевания могут повлиять на развитие депрессии. Например, встречаемость депрессивных расстройств у пациентов с сердечно-сосудистыми заболеваниями составляет 17–29%, системной красной волчанкой (СКВ) – 22,542%, а при РА – 13–32% [3],что значительно выше, чем среди населения в целом – 10,3% [4].
В работе B. Kwiatkowska и соавт. симптомы депрессии (>10 баллов по шкале BDI) были обнаружены у 76% пациентов с РА, в том числе у 87% женщин и 13% мужчин (различия по полу недостоверны, р=0,93), причем симптомы депрессии чаще возникали у неработающих пациентов (р=0,04) [5].
Учитывая, что хроническое воспаление непосредственно связано с патологией данных заболеваний, была высказана гипотеза о связи воспаления с развитием депрессии. Было замечено, что сывороточные уровни провоспалительных цитокинов (интерлейкин-1β – IL-1β, интерлейкин-6 – IL-6, фактор некроза опухоли-альфа – TNFα) часто повышаются у пациентов с выраженной депрессией [6]. Хорошо известно, что эти цитокины могут вызывать соматические симптомы (усталость, потерю аппетита), а также влиять на настроение, вызывая дисфорию и беспокойство.
Открытие Toll-подобных рецепторов (TLR), являющихся рецепторами распознавания образов (PRR) на клеточной поверхности иммунных клеток, способствовало раскрытию механизмов врожденного иммунного ответа. TLR способны распознавать инвариантные молекулярные структуры – патоген-ассоциированные молекулярные структуры (PAMP), в результате чего происходит высвобождение провоспалительных цитокинов, включая IL-1β, IL-6 и TNFα. Индукция IL-1, IL-6 и TNFα в ответ на TLR осуществляется посредством активации транскрипции гена, только в случае с IL-1 требуется дополнительная стадия – обработка про-IL-1β до зрелой активной формы IL-1β. Высвобождение про-IL-1β происходит в основном через NLRP3 (цитозольный NOD-подобный рецептор с пиринсодержащим доменом), который способен образовывать крупные мультипротеиновые «воспалительные» комплексы. В составе данного комплекса NLRP3 участвует в активации каспазы-1, способной расщеплять про-IL-1β с последующим высвобождением IL-1β [7].
Цель исследования – установить наличие депрессивных расстройств и их связь с уровнем провоспалительных цитокинов в сыворотке крови больных РА.
Материал и методы исследования
Под наблюдением находились 88 женщин (средний возраст – 54,2±12,0 года, длительность заболевания – 9,0[3,5;16,0] лет) с достоверным диагнозом РА, преимущественно с умеренной активностью заболевания (68,2%), серопозитивных по антителам к циклическому цитруллинированному пептиду (54,5%) и по ревматоидному фактору (36,4%). Нестероидными противовоспалительными средствами (НПВС) пользовались 82 (93,2%) человека, а 67 (76,1%) пациенток на момент проведения исследования принимали данные препараты ежедневно или более 3 раз в неделю; 53 (60,2%) человека проходили лечение с использованием базисных противовоспалительных препаратов (БПВП) (метотрексат, плаквенил, сульфасалазин, арава, мабтера, препараты золота); 62 (70,5%) – с применением глюкокортикоидов (ГК): 45 (51,1%) пациенткам были назначены малые дозы ГК (<10 мг/сут), 17 (19,3%) – ГК в дозе от 10 до 25 мг/сут.
Уровень депрессии определяли по опроснику депрессивности Бека (Beck Depression Inventory пересмотра 1996 г., BDI-II) из 21 группы утверждений с оценкой полученных результатов в баллах от 0 до 3 (0–13 – нормальное состояние, 14–19 – легкая, 20–28 – умеренная, 29–63 – выраженная/тяжелая депрессия). Тест BDI-II удовлетворяет современным требованиям медицинского сообщества, позволяет проводить количественную оценку интенсивности депрессии и характеризуется оптимальным сочетанием объема, простого алгоритма обработки результатов и высокой диагностической эффективностью.
Уровни цитокинов (интерлейкин-1 – IL-1, интерлейкин-2 – IL-2, интерлейкин-6 – IL-6 и фактор некроза опухолей-альфа – TNFα) в сыворотке крови больных РА определяли иммуноферментным методом с использованием коммерческих тест-систем производства АО «Вектор-бест» (Россия) согласно инструкциям по применению.
Статистический анализ проводился с использованием программы «Statistica 10.0» (StatSoft Inс., USA). Все тесты были выполнены при уровне значимости p<0,05, данные представлены в виде среднего значения ± стандартное отклонение средней (М±SD) после проверки гипотезы о нормальности распределения анализируемых переменных с использованием критерия Колмогорова–Смирнова (с поправкой Lilliefors). Для величин, закон распределения которых отличался от нормального, использовали медиану и интерквантильный интервал (Ме [Р25;Р75]). Для определения межгрупповых различий применяли параметрический t-критерий Стьюдента или непараметрический U-критерий Манна–Уитни, а также дисперсионный анализ. Для количественной оценки корреляционных связей использовали коэффициенты корреляции Пирсона и Спирмена (r).
Результаты исследования и их обсуждение
Депрессивные расстройства являются серьезной проблемой для пациентов с РА, так как плохое психическое здоровье может значительно усугубить течение заболевания [6] и вызвать дальнейшее снижение качества жизни [8]. Наличие депрессии различной степени выраженности было установлено у 58 (65,9%) больных РА: легкая имела место у 23, умеренная – у 17, тяжелая – у 18 человек (рис. 1).
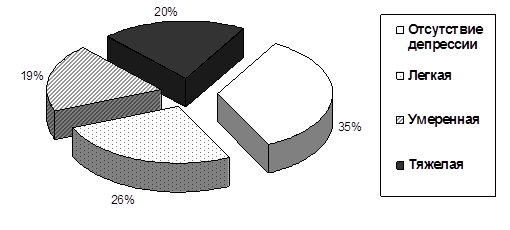
Рис. 1. Выраженность депрессивных расстройств у больных РА (по шкале BDI-II), в %
У больных РА при наличии коморбидной патологии (артериальная гипертензия, диабет, заболевания щитовидной железы, легких и желудочно-кишечного тракта) не было отмечено достоверных различий в проявлении симптомов депрессии по сравнению с пациентами без наличия различных сопутствующих заболеваний (р>0,05). Исключение составила группа пациентов РА с ишемической болезнью сердца (ИБС): отмечена достоверная положительная связь слабой силы между уровнем депрессии по BDI-II и наличием ИБС (r=0,23, р=0,032). Также были выявлены межгрупповые различия при определении выраженности депрессии у больных РА с ИБС (n=15) и без ИБС (n=73): 21,7±18,7 балла против 14,3±10,2 балла; р=0,032.
У больных РА с выраженной/тяжелой депрессией уровень IL-6 достоверно превосходил показатели больных РА без депрессивных расстройств (р=0,003). Также была отмечена тенденция к нарастанию IL-6 в группе больных с выраженной/тяжелой депрессией по сравнению с больными с легкой депрессией (р=0,06) (табл. 1).
Таблица 1
Показатели провоспалительных цитокинов в зависимости от выраженности депрессии (по шкале BDI-II) у больных РА, М ± SD
|
Показатели, пг/мл |
Степень выраженности депрессии |
|||
|
Группа I |
Группа II |
Группа III |
Группа IV |
|
|
IL-6 |
9,82±3,7 |
11,1±4,96 |
11,6±5,88 |
14,6±6,72 *IV-I |
|
IL-1β |
1,98±0,82 |
2,53±1,02 *II-I |
8,75±5,04 *III-II |
13,46±7,85 *IV-III |
|
IL-2 |
1,84±0,69 |
1,96±0,74 |
2,16±1,02 |
1,95±0,99 |
|
TNFα |
1,07±0,41 |
0,99±0,54 |
1,27±0,47 |
1,35±0,68 |
Примечание: * – межгрупповые различия достоверны, р<0,05
Показатели IL-1β достоверно нарастали с прогрессированием депрессии (без депрессии – легкая депрессия, р=0,034; легкая – умеренная, р<0,001; умеренная – выраженная/тяжелая депрессия, р=0,044). При оценке уровней IL-2 и TNFα в группах больных РА с различной степенью выраженности депрессии не было получено достоверных межгрупповых различий (р>0,05).
В настоящее время депрессия рассматривается как сложное заболевание, включающее множество факторов, связанных с нервной, нейроэндокринной и иммунной системами. Теории о значимой роли воспаления при развитии депрессии подтверждаются увеличением провоспалительных цитокинов IL-6, IL-1, TNF-α или IL-17 у пациентов с депрессией [9], хотя встречаются и противоположные утверждения [3, 5]. H.D. Schmidt и соавт. рассматривают IL-1β в качестве возможного биомаркера депрессии [10].
По результатам нашей работы не было обнаружено корреляции между уровнем депрессии и приемом БПВП (р=0,268), а также статистически значимых различий в распространенности симптомов депрессии между пациентами, получавшими (n=53) и не получавшими (n=35) базисные противовоспалительные препараты (13[7;17] и 15[8;22] баллов, соответственно; z= –0,87, р=0,386).
Также не было выявлено достоверной корреляции между выраженностью симптомов депрессии и назначением ГК (р=0,19), длительностью приема данных препаратов (р=0,48), среднесуточной дозой препарата в течение последнего года (р=0,81). Но была продемонстрирована положительная связь средней силы между степенью депрессии (по BDI-II) и дозой ГК на момент исследования (r=0,33, р=0,002). И если на фоне хронического заболевания длительный прием (в подавляющем большинстве случаев невысоких доз) ГК не оказывает значимого влияния на прогрессирование симптомов депрессии, то увеличение дозы ГК в краткосрочной перспективе способно усугублять депрессивные расстройства у больных РА (табл. 2).
Таблица 2
Показатели уровня депрессивных расстройств и IL-1β в зависимости от дозы ГК у больных РА
|
Показатели |
Прием глюкокортикоидов на момент исследования |
||
|
Группа I, |
Группа II, |
Группа III, |
|
|
Уровень депрессии по BDI-II, баллы (Me[Р25;Р75]) |
8,5[5;16] |
14[9;17] |
19[14;29] *III-I |
|
Уровень IL-1β, пг/мл (М±SD) |
4,57 ± 1,83*I-II |
6,04 ± 3,27 |
6,52 ± 5,16 |
Примечание: * – межгрупповые различия достоверны, р<0,05
Пациенты, применявшие ГК в ежедневной дозе ≥10 мг/сут (группа III), имели достоверно более высокую степень депрессии по сравнению с больными РА из I группы (z=–2,98; р=0,003), а при использовании низких доз ГК (группа II) межгрупповые различия не достигали статистической значимости (р II-I =0,085, р II-III =0,05). Различия в ежедневной дозе ГК не оказывали влияния на содержание IL-1β у больных РА (р II-III =0,084), а у пациентов, не использующих в схеме лечения ГК, уровень данного цитокина был достоверно выше (р I-II =0,039), чем у пациентов с назначением ГК в минимальных дозах (до 10 мг/сут) (табл. 2). По содержанию других провоспалительных цитокинов достоверных изменений зарегистрировано не было. Следует отметить, что группы больных РА, сформированные по дозе используемых ГК, не различались по применению БПВП и НПВС.
Более 70% людей с депрессией имеют повышенные значения кортизола по сравнению с людьми, не страдающими депрессией [11]. IL-1β увеличивает выделение гипоталамического кортикотропин-рилизинг-гормона (CRH), секрецию гипофизарного адренокортикотропного гормона (ACTH) и стероидогенез надпочечников. В нормальных условиях ГК подавляют провоспалительные цитокины, а у пациентов с депрессией данного эффекта, как правило, не наблюдается, что может свидетельствовать о нарушении гомеостатических механизмов. Повышенные показатели провоспалительных цитокинов в головном мозге и на периферии [12] нарушают обратную связь ГК, вызывая атрофию пирамидных нейронов в гиппокампе и способствуя развитию депрессивных симптомов [13, 14].
В целом участие провоспалительных цитокинов в развитии симптомов, подобных депрессии, у больных РА может быть не столь очевидным, потому что способны реализоваться и другие механизмы взаимодействия аутоиммунного воспаления и депрессии [15]. Тем не менее, по-видимому, именно IL-1β, являясь первым шагом в провоспалительном ответе на психологический стресс, способен вызывать последующий каскад других воспалительных цитокиновых ответов. Активация провоспалительных цитокинов при стрессе и депрессии позволяет предположить, что подавление воспалительного ответа способно ослабить симптомы депрессии при РА.
Заключение
Хроническое воспаление и иммунные реакции при системных заболеваниях могут способствовать развитию депрессии. Ревматоидный артрит и депрессия оказывают взаимное влияние, что приводит к ухудшению их течения. Необходимо проведение скрининга на наличие симптомов депрессии у пациентов с РА, что может способствовать ранней диагностике и своевременному назначению противовоспалительной терапии не только для нивелирования проявлений РА, но и для прямого воздействия на симптомы депрессии.



