Ограниченные гнойные заболевания печени встречаются редко, но трудно поддаются диагностике и протекают тяжело. Среди госпитализированных в хирургический стационар больных пациенты с абсцессами печени составляют до 0,16%.
Выделяют следующие группы абсцессов печени: 1) холангиогенные (54,8%); 2) криптогенные (19,1%); 3) травматические (7,1%); 4) пилефлебитические (4%); 5) послеоперационные (4,7%); 6) контактные (4,7%); 7) амебные (4%) [1] (рис. 1).
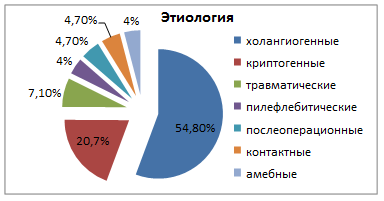
Рис. 1. Этиология абсцессов печени
Лечение этой патологии чаще хирургическое, и до внедрения пункционных методов лечения больные с абсцессами печени обычно подвергались большим полостным операциям, нередко сопровождающимся послеоперационной летальностью от 16,9% до 55,0% [2, 3]. В современной хирургии с диагностической и лечебной целью широко используют компьютерную томографию (КТ) и ультразвуковое исследование (УЗИ) [3-5].
До внедрения в клиническую практику КТ и УЗИ лечение ограниченных гнойников печени проводилось в основном на основании клинических данных. Прорывом в лечении и, конечно, «золотым стандартом» в лечебной тактике явилось внедрение в клиническую практику методов КТ и УЗИ. Чрескожная пункция и дренирование гнойников печени свое доминирующее место в хирургии приобрели при ультразвуковой навигации. Метод открыл новые возможности для диагностики и лечения, позволил внедрить малотравматичные методы эвакуации гнойников печени. Ведущее место в лечении больных с абсцессом печени занимают пункционные методы. К их достоинствам относят: отсутствие риска общего обезболивания, сокращение сроков нахождения на стационарном лечении, низкий уровень операционной агрессии, невысокий процент летальных исходов [5-7].
Цель исследования: анализ результатов лечения абсцессов печени пункционным способом под ультразвуковой навигацией.
Материалы и методы исследования
В отделениях хирургии ГКБ № 8 г. Уфы с 2014 по 2019 гг. с солидными абсцессами печени находились 19 больных. Возраст пациентов варьировал от 31 до 72 лет, средний возраст составил 53,5±0,3 года, соотношение мужчин и женщин было соответственно14 (73,7%) и 5 (26,3%) (рис. 2).
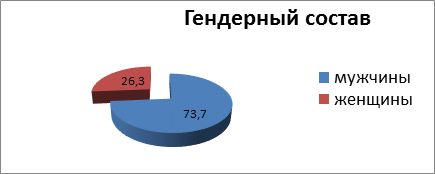
Рис. 2. Гендерный состав анализируемых больных (%)
Следует отметить, что в анализируемой группе преобладали более молодые мужчины (их средний возраст составил 38±0,15 года) и более пожилые женщины (средний возраст 65±0,15 года) (рис. 3).
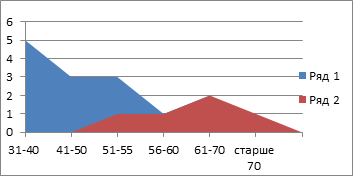
Рис. 3. Частота встречаемости абсцессов печени
Пик заболеваемости приходился на возраст от 31 до 55 лет (43± 0,3 года) (11 пациентов, 57,9%). Гнойный процесс в правой доле выявлялся в 17 (89,5%) случаях, в левой доле – в 2 (11,5%) случаях (рис. 4).
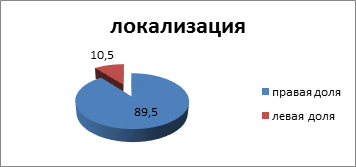
Рис. 4. Локализация абсцессов печени (%)
УЗИ больным с подозрением на абсцесс печени проводили в течение первых 3 суток от момента госпитализации. Степени тяжести состояния больных определяли при помощи шкалы SAPS II, в анализируемой группе среднее число баллов составило 41±1,18. Средний период диагностики составил 4,1±0,7 сут. (таблица).
Этиология абсцессов печени в клинической группе
|
Этиология |
Встречаемость в % |
Встречаемость в натуральных числах |
|
|
1 |
Холангиогенные |
47,36 % |
9 больных |
|
2 |
Криптогенные |
21,05% |
4 больных |
|
3 |
Травматические |
15,79% |
3 больных |
|
5 |
Послеоперационные |
10,52% |
2 больных |
|
6 |
Контактные |
5,26% |
1 больной |
Результаты исследования и их обсуждение
При УЗИ обычно выявляли увеличение размеров печени, образование округлой или неправильной формы с анэхогенной структурой содержимого, а по периферии имелась капсула повышенной эхогенности. В диагностике приоритетными являлись результаты УЗИ, по ним фактически определялась тактика лечения. При необходимости дифференциальной диагностики применялась КТ. Исходя из стадии формирования абсцессов бактериальной этиологии выделяют 3 возможные вариации эхоскопической картины.
Первоначально при УЗИ в печени выявляется неоднородный, нечетко обозначенный фрагмент паренхимы повышенной эхогенности, внутри которой выделяется бесструктурный гипоэхогенный участок (стадия инфильтрации). В этой стадии в паренхиматозной ткани печени вероятно выявление участка сниженной яркости, который имеет разнородное строение и неотчетливые контуры, которые переходят в здоровую ткань. В центре этого участка мы наблюдаем анэхогенный бесструктурный участок некроза (рис. 5).
Такая картина может наблюдаться непродолжительный отрезок времени, буквально несколько часов, и уловить во время УЗИ ее удается редко.
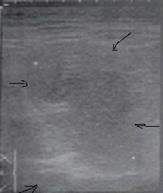
Рис. 5. Эхограмма. Стадия некроза печени
Со временем в зоне инфильтрации образуется полость с гноем, без четких границ, ее содержимое гипоэхогенное, чаще неоднородное (стадия абсцедирования). Характер содержимого полости связан с наличием гноя и тканевого детрита. В ткани печени, прилежащей к данному участку, имеется воспаление средней степени выраженности. Клинические проявления, соответственно, становятся более выраженными, что соответствует образованию гетерогенной жидкости (рис. 6).
Помимо свойственных для жидкостной структуры эхографических признаков («усиление» задней стенки, эффект боковых теней, эффект длительного псевдоусиления эхосигнала), обнаруживаются нестандартные показатели: внутреннее содержимое полости абсцесса обособляется, в связи с этим образуется граница «жидкость – жидкость» с горизонтальным уровнем, более плотная часть содержимого при этом находится ниже границы; у верхней стенки полости вероятно присутствие воздушных пузырьков в виде гиперэхогенных структур (они дают реверберирующий эффект – «хвост кометы»).
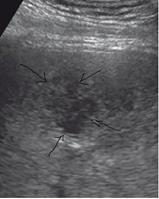
Рис. 6. 2-й вариант эхографической картины, стадия абсцедирования
Третья стадия (хронизации процесса) характеризуется выявлением плотной, толстой пиогенной капсулы по контуру гнойника. При УЗИ мы наблюдаем хронический абсцесс печени, характеризующийся четкими контурами, центральной частью сниженной яркости, толстая стенка очага эхогенная, с явлениями кровотока. Также вероятно выявление кальцинированных компонентов в капсуле (рис. 7). Следовательно, выявление при УЗИ в печени очага обызвествления является возможным признаком обратного развития абсцесса.
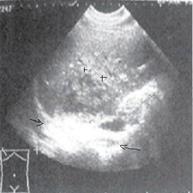
Рис. 7. Стадия хронизации абсцесса печени
При проведении исследования с помощью аппарата УЗИ в абсцессах могут быть выявлены в различной степени акустические эффекты, которые присущи кистам. Также имеются такие особенные признаки абсцессов, как разграничение содержимого на два компонента: жидкость и осадок, в гнойной полости выявляются пузырьки воздуха (гиперэхогенные компоненты с реверберирующим эффектом на стенках полости), сдвиг содержимого гнойной полости, который фиксируется с помощью УЗИ.
Для проведения пункционных, УЗ-ассистированных методов лечения противопоказаниями являлись технические причины (отсутствие безопасной пункционной трассы) и тяжелые нарушения свертывающей системы крови.
Пациентам после постановки диагноза под местной анестезией и под контролем УЗИ производили чрескожно-чреспеченочную пункцию и дренирование места абсцесса. Для наглядного контроля при прицельных чрескожных пункциях и для введения дренажей пользовались ультразвуковыми аппаратами «Aloka 1000» и «Medison SonoAce» с конвексным и линейным датчиком с диапазоном частоты 3,5–10 МГц. Для более точного позиционирования пункционной иглы применялся биопсийный адаптер. Показания для выполнения пункционного лечения выставлялись при помощи ультразвуковой диагностики, пункция осуществлялась только под ультрасонографической навигацией, что позволяло проводить прицельную и безопасную пункцию. Для пункции применяли иглы с внешним диаметром 1,5 мм, длиной 15–20 мм.
Местная анестезия, которую применяли при пункционном лечении, является вполне достаточной. Место пункции зависит от пораженного сегмента печени, но чаще ее проводили по задней подмышечной линии. Нами был использован также добавочный доступ в XI–X межреберье между передней и средней подмышечными линиями справа для проведения пункционной манипуляции для более качественного промывания при полостях большого размера. Во время манипуляции производили максимальное удаление гноя из полости с последующим промыванием полости дезинфицирующим раствором (хлоргексидином, диоксидином). В послеоперационном периоде проводили антибактериальную, дезинтоксикационную и направленную на общее укрепление организма терапию.
Мы добились выздоровления всех 19 пациентов путем пункционной аспирации (12 человек) и катетеризации (в 7 случаях). При этом для санации внутрипеченочного гнойника 8 пациентам была достаточна однократная пункция, в 3 случаях потребовалась двукратная и в 1 – трехкратная.
Катетеризацию мы проводили чаще всего катетерами pig tail диаметром 8–12 Fr. При абсцессах менее 10 см в диаметре было достаточно дренирования одним микродренажом (5 больных). При абсцессах большого размера (диаметром более 10 см) и наличии выраженной капсулы мы выполняли двойное дренирование полости (2 случая, 10,5%).
Среднесуточное стояние дренажа у этих больных составило 8±1,4 сут.
В каждом случае мы проводили микробиологическое исследование извлеченной посредством пункции жидкости. При этом этиологическими факторами содержимого абсцесса выступали разнообразные микроорганизмы: гемолитический стрептококк, золотистый стафилококк, энтеробактерии, кишечная палочка, клебсиелла, анаэробные микроорганизмы. Нередко при посеве гноя выделяется смешанная флора. Во время выполнения процедуры эвакуации содержимого полость сокращалась на 60–75%. В динамике после катетеризации абсцесса печени в различные сроки наблюдали полное сокращение остаточных полостей. В проекции дренированного абсцесса жидкость не определяется, в ткани печени визуализируются два дренажа (рис. 8).
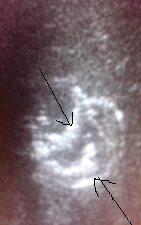
Рис. 8. УЗИ в динамике. В проекции дренированного абсцесса в ткани печени визуализируются два дренажа
Больные после первичной пункции находились под наблюдением хирурга поликлиники, в зависимости от общего состояния им выполнялись контрольное УЗИ и по показаниям повторные пункции. Интервал между пункциями определялся индивидуально в зависимости от ультрасонографической динамики, чаще через 1,5–2 месяца. Дренаж мы убирали, если по нему отсутствовало отделяемое после контрольного исследования с помощью аппарата УЗИ.
При пункции абсцессов наблюдалось 2 осложнения. При эвакуации содержимого абсцесса при помощи медицинского электроотсоса отмечалось необильное наружное кровотечение, остановленное при помощи тугого наполнения полости физиологическим раствором на 13–15 мин. В другом случае при пункции краевого абсцесса VI сегмента печени размерами более 12 см в диаметре был прорыв гноя в брюшную полость, что удалось ликвидировать при помощи лапароскопической санации.
Выводы
1. Способ санации абсцессов печени с помощью пункции под контролем УЗИ обладает доступностью, эффективностью и низкой травматичностью. Данная методика повышает эффективность комплексного лечения, снижая интоксикацию и вероятность послеоперационных осложнений.
2. При небольших абсцессах печени (до 5 см в диаметре) пункция абсцесса в большинстве случаев оказывается достаточной для его санации, при абсцессах от 5 до 10 см в диаметре лечебный эффект может быть достигнут дренированием одним микродренажом, при диаметре абсцесса более 10 см в диаметре и выраженной капсуле полость предпочтительнее дренировать двумя катетерами.
3. Частота постманипуляционных осложнений при лечении абсцессов печени с помощью диапевтических технологий невысока, эти осложнения могут быть купированы без лапаротомии.



