Впервые возникшие эпилептические приступы (ВВЭП) могут наблюдаться хотя бы раз в жизни у 8-10% взрослого населения [1; 2]. Среди нетравматических ВВЭП во взрослом возрасте выделяют острые симптоматические припадки (ОСП) при синдроме отмены алкоголя, лекарственных средств и неспровоцированные приступы (НП), что имеет значение для диагностики эпилепсии и определения лечебной тактики [3; 4]. Дифференциальная диагностика ВВЭП построена на уточнении причины, определении типа приступа, оценке риска рецидива и лежит в основе диагностирования эпилепсии и прогностического консультирования [5]. Согласно литературным данным, риск рецидива у пациентов с НП составляет 50% [6] и существенно возрастает при выявлении эпилептиформной активности и симптоматической этиологии приступов [7]. У взрослых с ВВЭП вероятность выявления эпилептиформных разрядов возрастает при регистрации биоэлектрической активности мозга в период сна [8]. Сон – циклический процесс, структурные и динамические характеристики сна изменяются при различных типах эпилепсии [9], однако в доступной литературе не удалось выявить характеристик ночного сна у взрослых с различными типами ВВЭП.
Целью исследования явилось изучение структурно-динамических характеристик ночного сна у пациентов с впервые возникшими эпилептическими приступами.
Материалы и методы исследования
В исследование вошли 124 пациента с ВВЭП, находившиеся под наблюдением в эпилептологическом кабинете в период с 2008 по 2019 г. Нейрофизиологическое исследование проводилось в лаборатории видео–ЭЭГ–мониторинга кафедры неврологии и нейрохирургии ФГБОУ «СибГМУ». Клинические критерии включения: впервые возникший клинически документированный эпилептический приступ; возраст от 18 до 50 лет, динамическое наблюдение в течение 1 года, отсутствие эпилептических приступов в течение 10 дней перед исследованием. Клинические критерии исключения: актуальная соматическая и неврологическая патология, структурные изменения на МРТ, гравидарный период и лактация, психические расстройства, прием противоэпилептических препаратов в стабильной дозе в течение месяца перед исследованием. В течение года наблюдения у 53 человек приступы рецидивировали и в соответствии с критериями [10] был диагностирован дебют идиопатической генерализованной эпилепсии с вариабельным фенотипом (ИГЭ). У 44 пациентов диагностированы неспровоцированные приступы (НП), у 27 – острые симптоматические припадки (ОСП). Группу сравнения составили 53 пациента с неэпилептическими приступами (НЭП). Общая характеристика вошедших в исследование лиц представлена в таблице 1.
Таблица 1
Общая характеристика вошедших в исследование лиц
|
Исследуемые группы пациентов с ВВЭП |
Показатель |
|
|
|
Пол, м/ж (абс. цифры) |
Возраст, годы (M±SD) |
|
ИГЭ |
16/37 |
26.38±9.01 |
|
НП |
24/20 |
29.13±10.87 |
|
ОСП |
25/2 |
31.74±10.33 |
|
НЭП |
29/24 |
28.17±8.45 |
Примечание. ВВЭП – впервые возникшие эпилептические приступы, ИГЭ – идиопатическая генерализованная эпилепсия с вариабельным фенотипом, НП – неспровоцированные приступы, ОСП – острые симптоматические приступы, НЭП – неэпилептические приступы. Исследуемые группы были сопоставимы по полу и возрасту (p>0.05).
Протокол нейрофизиологического исследования. Всем пациентам проводилось полисомнографическое исследование (ПСГ), включающее электроэнцефалографию (в отведениях F3, F4, F7, F8, C3, C4, T3, T4, P3, P4, T5, T6, O1, О2 с применением стандартного расположения электродов по системе 10–20), электроокулографию (2 канала), электрокардиографию (1 отведение), электромиографию с подбородочных мышц (2 канала), на аппарате «Нейрон–Спектр–4ВП» фирмы «Нейрософт» в период физиологического ночного сна. Визуальное определение стадий сна проводили согласно стандартным критериям Американской академии медицины сна [11]. После идентификации стадий и фаз сна вычисляли общепринятые параметры, характеризующие структуру сна [12]: общая длительность сна (TST – total sleep time) – суммарная длительность всех стадий и фаз сна в минутах; латентность сна (SOL – sleep on set latency) – время от выключения света до возникновения первого периода сна в минутах; эффективность сна (SE – sleep efficiency) – процент TST от времени в кровати; латентность быстрого сна (RL – rapid eye movement sleep latency) – время от засыпания до возникновения первой эпохи быстрого сна (R) в минутах; относительная продолжительность каждой стадии медленного сна (первая стадия - N1, вторая стадия - N2, дельта-сон - SWS, объединяющий третью и четвертую стадии) и R по отношению к TST в процентах; продолжительность бодрствования внутри сна (WASO – wake after sleep onset) – общая длительность пробуждений в минутах; число спонтанных пробуждений из сна (NWake – number of a wakenings) в пересчете на 1 час сна (в целом) в абсолютных единицах. Для оценки динамики стадий сна подсчитывали количество фактических переходов между стадиями: бодрствования (W), N1, N2, SWS и R [13]. Динамику стадий сна анализировали в периоде от засыпания до утреннего пробуждения. Рассчитывали относительную частоту определенной смены стадий по отношению к сумме всех переходов между стадиями в процентах [14]. Анализировали относительную частоту всех переходов из каждой стадии (W, N1, N2, SWS и R), сравнивали смены всех стадий сна в исследуемых группах. Статистическую обработку выполняли с использованием пакета Statistica 6.0. В исследовании применяли параметрические и непараметрические методы сравнения, Манна–Уитни, Kruskal-Wallis test, Шапиро-Вилка, t-тест (Стьюдента). За достоверный принимался уровень значимости р<0,05. Данные представлены в виде среднего и стандартного отклонения (M±SD), медиан (Me) и квартилей (q1; q3) – Me (q1; q2).
Результаты исследования и их обсуждение
На первом этапе работы проводили сравнение показателей, характеризующих структуру сна (табл. 2).
Таблица 2
Результаты полисомнографического исследования вошедших в исследование лиц, Me (q1; q2)
|
Показатель |
Группы |
р |
|||
|
|
ИГЭ |
НП |
ОСП |
НЭП |
|
|
TST, мин. |
387.68 (341.62; 418.37) |
404 (361.11; 437.62) |
338.62 (316.53; 395.83) |
373.45 (323.17; 414.03) |
А-В*, Б-В** |
|
SOL, мин. |
5.18 (2.1; 13.98) |
4 (2.33; 7.02) |
7.03 (3.08; 16.4) |
6.53 (3.83; 21.67) |
|
|
SE, % |
92.68 (88.35; 97.87) |
95.85 (91.95; 97.82) |
91.11 (82.84; 93.56) |
93.01 (89.53; 97.61) |
Б-В** |
|
RL, мин. |
104.63 (79.08; 126.67) |
100.11 (80.05; 127.32) |
91.58 (54.4; 147.45) |
93.48 (68.6; 120.05) |
|
|
N1, % |
12.99 (5.21; 19.67) |
10.53 (6.99; 17.88) |
19.47 (9.3; 28.35) |
16.04 (7.24; 28.37) |
А-В*, Б-В* |
|
N2, % |
53.18 (42.86; 61.13) |
47.4 (41.25; 58.88) |
41.38 (29.98; 52.24) |
42.41 (35.16; 51.26) |
А-Г**, А-В**, Б-В* |
|
SWS, % |
17.61 (9.03; 26.8) |
19.56 (15.37; 26.68) |
19.69 (10.63; 29.32) |
21.38 (15.86; 26.09) |
|
|
R, % |
12.84 (9.15; 16.27) |
13.07 (10.73; 15.96) |
10.68 (8.52; 12.73) |
12.34 (7.62; 16.25) |
|
|
WASO, % |
3.92 (0.47; 10.88) |
2.79 (0.94; 6.42) |
8.3 (1.45; 17.32) |
3.19 (0.83; 7.5) |
Б-В* |
|
NWake, в час |
0.37 (0.14; 1.16) |
0.32 (0.14; 0.76) |
0.73 (0.34; 1.63) |
0.37 (0.16; 0.82) |
Б-В** |
|
Примечание: **р< 0.01 и *р< 0.05 (Mann-Whitney U Test). |
|||||
У пациентов из группы ОСП продолжительность TST была достоверно снижена по сравнению с группами ИГЭ и НП. В свою очередь значения SE у пациентов с ОСП были достоверно ниже значения соответствующего показателя в группе НП. SOL в группах ИГЭ и НП была короче, чем у пациентов с ОСП и НЭП, однако различия не достигли уровня достоверных. Значения RL в исследуемых группах не различались. Относительная продолжительность стадии N1 иN2 среди пациентов с ОСП была достоверно больше, чем в группах ИГЭ и НП. Процентная представленность стадий SWS и R в исследуемых группах не различалась. Относительная продолжительность WASO и NWake в час записи в группе ОСП достоверно превышала значения соответствующих показателей в группе НП. На втором этапе работы проводили сравнение показателей, характеризующих динамику смены стадий сна. Относительная частота переходов из определенной стадии в другие по отношению к числу всех смен стадий в исследуемых группах представлена в таблице 3.
Таблица 3
Относительная частота смены из определенной стадии в другие по отношению к числу всех переходов между стадиями в исследуемых группах, в %, Me (q1; q2)
|
Стадия |
Группы |
р |
|||
|
|
ИГЭ |
НП |
ОСП |
НЭП |
|
|
W |
13.64 (10; 23.81) |
12.5 (8.71; 20.52) |
21.74 (12.5; 26.92) |
14.29 (8.33; 20) |
Б-В**, В-Г* |
|
N1 |
21.43 (13.64; 27.27) |
20.83 (17.52; 27.92) |
27.45 (18.18; 35.71) |
21.43 (15.38; 28.57) |
А-В* |
|
N2 |
38.89 (33.33; 41.67) |
37.5 (28.29; 42.21) |
30.43 (25; 39.39) |
36 (30; 40) |
А-В**, Б-В*, В-Г* |
|
SWS |
13.64 (9.3; 17.65) |
15.63 (12; 19.67) |
11.63 (7.69; 17.5) |
16.67 (10.71; 20) |
|
|
R |
10.71 (7.32; 13.64) |
12.31 (8.82; 14.29) |
8.7 (5.88; 13.64) |
10.53 (8.11; 14.29) |
|
|
Примечание: **р< 0.01 и *р< 0.05 (Mann-Whitney U-Test). |
|||||
Наиболее часто у пациентов из группы ОСП наблюдались переходы из стадии W и N1 в другие, тогда как у пациентов из групп ИГЭ, НП и НЭП из стадии N2. Относительная частота смены стадий из SWS и R в исследуемых группах не различалась. Относительная частота смены стадий сна в исследуемых группах представлена на рисунке. В группе ОСП частота смены стадии W на N1 (W->N1) составила 15.38% и была достоверно выше, чем в группах ИГЭ и НЭП (10% в каждой группе). У пациентов из группы НП частота перехода из стадии W в N1 (W->N1) и обратно (N1->W) составила 9.1% и 3.77% соответственно и была достоверно меньше, чем в группе ОСП (15.38% и 7.84% соответственно). Также в группе ОСП частота смены стадии SWS на N2 (SWS->N2) составила 4.25% и была достоверно меньше, чем в группах ИГЭ и НП (9.1% и 8% соответственно), тогда как частота обратных переходов из стадии N2 в SWS (N2->SWS) в сравниваемых группах не различалась. Различий по частоте смены стадий из N2 в исследуемых группах выявлено не было.
В данной работе проводилось ПСГ-исследование с оценкой структуры сна и динамики стадий у пациентов с впервые возникшим эпилептическим приступом. Катамнестическое прослеживание пациентов с ВВЭП позволило выделить группу с дебютом ИГЭ и сравнить значения ПСГ-показателей с когортами пациентов с НП, ОСП и НЭП. Полученные данные свидетельствовали о меньшей продолжительности времени сна (TST), большей длительности периодов бодрствования во время сна (WASO) и более частых пробуждениях из сна (NWake) у пациентов с ОСП по сравнению с пациентами с ИГЭ, НП и НЭП. Эффективность сна (SE) – интегральный показатель, зависящий от времени засыпания (SOL) и значений WASO, также был снижен среди пациентов с ОСП, что в целом может свидетельствовать о нарушении процессов инициализации и поддержания сна в этой группе исследуемых с ВВЭП. В структуре сна у пациентов с ОСП преобладала стадия N1, тогда как у пациентов с ИГЭ и НП – N2, что в целом характеризовало сдвиг гипнограммы в сторону поверхностных стадий у всех пациентов с ВВЭП. У пациентов с НЭП также отмечалось преобладание поверхностных стадий сна, что в целом соответствует литературным данным [15]. Согласно современным представлениям, к ПСГ-маркерам, характерным для инсомнии, в настоящее время относят следующие: укорочение TST, увеличение SOL и WASO, нарастание числа NWake и поверхностных стадий медленного сна, редукция SWS [16]. Представленные данные свидетельствуют о более выраженных нарушениях архитектоники ночного сна у пациентов с ОСП. Оценка динамики смены стадий сна дополняет статическую информацию, характеризующую структуру сна. Согласно литературным данным, анализ частоты и направления межстадийных переходов является перспективным методом оценки качества и регуляции сна [17]. У пациентов с ОСП по сравнению с другими группами зарегистрировано большее число переходов из состояния бодрствования и из стадии N1 и, наоборот, меньшее из стадии N2 в другие стадии в период ночного сна, что коррелирует с данными о продолжительности этих стадий в сравниваемых группах. У пациентов с ОСП частота переходов между стадиями W и N1 была выше, чем в других группах, что свидетельствовало о нестабильности и частом прерывании сна у этих пациентов [13]. Следует заметить, что частота переходов из стадии N2 в другие стадии сна в исследуемых группах не различалась. Согласно литературным данным, для хронической инсомнии характерно нарастание числа переходов между стадиями N1 и N2 [18]. В сравниваемых группах больных эти показатели не различались, что в сочетании с данными об одинаковой относительной продолжительности стадии SWS и частоте переходов из дельта-сна в другие стадии позволяет судить о меньшей длительности выявленных нарушений инсомнического характера. В то же время анализ частоты переходов из глубокого сна выявил, что у пациентов с ОСП наблюдалась меньшая частота переходов из SWS в N2 в отличие от других групп. На рисунке видно, что в этих группах пациентов с ВВЭП наблюдалась более высокая частота смены SWS на N1 и W (SWS->N1/W) минуя N2, однако различия не достигли достоверного уровня. Выявленные нарушения динамики стадий сна по данным литературы могут рассматриваться в качестве показателя дезинтеграции физиологической регуляции сна [14].
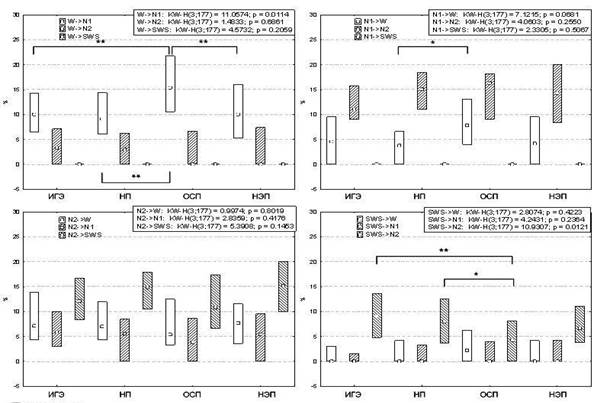
Относительная частота смены стадий сна в исследуемых группах в (%) – Me (q1; q2)
Примечания:
KW-H – Kruskal-Wallis test; p – уровень достоверности различий; **p < 0.01 и *p < 0.05 (Mann-Whitney Test);
W->N1 – переход стадии W в N1; W->N2 – переход стадии W в N2; W->SWS – переход стадии W в SWS; N1->W – переход стадии N1 в W; N1->N2 – переход стадии N1 в N2; N1->SWS – переход стадии N1 в SWS; N2->W – переход стадии N2 в W; N2->N1 – переход стадии N2 в N1; N2->SWS – переход стадии N2 в SWS; SWS->W – переход стадии SWS в W; SWS->N1 – переход стадии SWS в N1; SWS->N2 – переход стадии SWS в N2.
Впервые возникший эпилептический приступ – драматическое явление, которое, согласно представленным данным, может сопровождаться стресс-индуцированными нарушениями сна. По современным данным, острые нарушения сна инсомнического характера возникают в ответ на стрессовое воздействие и связаны с высокой реактивностью диэнцефальных структур [19]. Также нарушения сна диагностируются у большей части взрослых с эпилепсией [20]. Влияние эпилепсии на сон в общем проявляется снижением эффективности сна, увеличением латентности, фрагментацией сна и сдвигом гипнограммы в сторону поверхностных стадий [21], в то же время данных, характеризующих особенности нарушений структуры сна у взрослых с различными типами эпилепсий и эпилептическими приступами, к настоящему времени недостаточно [22]. По мнению [23], инсомния у взрослых пациентов с эпилепсией в большей степени ассоциирована с коморбидными соматическими и неврологическими заболеваниями. Согласно полученным данным, у пациентов с дебютом ИГЭ и НП выявленные изменения в гипнограмме не различались с группой сравнения, тогда как у исследуемых с ОСП регистрировались более выраженные нарушения архитектуры и динамики смены стадий сна.
Выводы
Различная степень выраженности нарушений сна у пациентов с острыми симптоматическими приступами по сравнению с пациентами с идиопатической генерализованной эпилепсией с вариабельным фенотипом и неспровоцированными приступами обусловлена различными этиопатогенетическими механизмами, лежащими в основе развития приступа. Выявленные структурно-динамические изменения характеризуют реактивное нарушение хронобиологической регуляции сна активационными системами ствола мозга и могут учитываться при оценке прогноза развития заболевания и разработке персонифицированных реабилитационных программ для пациентов с впервые возникшими эпилептическими приступами.
Исследование выполнено в рамках комплексной темы НИР «Комплексное исследование клинико-психопатологических закономерностей и патобиологических механизмов формирования и прогредиентности социально значимых психических и поведенческих расстройств с разработкой инновационных методов ранней диагностики, персонализированных стратегий терапии и профилактики», номер госрегистрации АААА-А19-119020690013-2 государственного задания № 075-01412-20-03.



