В настоящее время в мире около 40% населения имеют проблемы, связанные с заболеваниями или травмами суставов, которые сопровождаются нарушением целостности гиалинового хряща и развитием мостеоартроза [1, 2]. Большую часть среди больных остеоартрозом составляют пациенты с патологией крупных суставов – коленного и тазобедренного [3]. Характерные для данной патологии болевой синдром и двигательные нарушения со временем прогрессируют и приводят к необходимости выполнения серьезного и дорогостоящего оперативного вмешательства по замене поврежденного сустава на искусственный эндопротез [4, 5].
Недостаточная регенеративная способность гиалинового хряща обусловлена его структурой: полярным и зональным расположением хондроцитов [6-8]. Еще в 1783 г. было отмечено, что, будучи однажды поврежденным, такой хрящ не способен к регенерации [9-11]. В настоящее время большое количество работ посвящены разработке новых перспективных методов восстановления гиалинового хряща [12-14]. Основной задачей при этом является обеспечение оптимальных условий для регенерации или репарации хрящевой ткани [15, 16]. Малое количество высокодифференцированных клеток (5% по сухой массе), окруженных высокогидратированным внеклеточным матриксом, позволяет хрящевой ткани выдерживать значительные механические воздействия и обратимо восстанавливать свой объем [17, 18]. Несмотря на большое количество доступных современным хирургам методов, используемых для восстановления повреждений хряща, данная проблема до сих пор не решена в полном объеме [1]. По разработанной методике аутологичной хондропластики в большинстве случаев не удается полностью заместить поврежденный участок из-за недостатка донорского материала и инвазивности его забора [19, 20]. Метод микрофрактурирования показывает положительные результаты лишь в краткосрочной перспективе, так как образующийся из волокнистого хряща регенерат обладает отличными от гиалинового хряща упруго-прочностными характеристиками [21-23].
В 1987 г. группой шведских ученых во главе с M. Вrittberg была предложена принципиально новая методика предварительного культивирования хондроцитов с последующей их трансплантацией в область повреждения [24]. Затем данный метод видоизменили, и клеточные элементы (хондроциты, ММСК, iPSC или другие клетки) начали трансплантировать в область дефекта в составе биодеградируемого скаффолда [25-27]. Применение таких клеточно-инженерных конструкций (КИК) показывает хорошие результаты, но лишь в среднесрочной перспективе [28, 29, 30]. Однако при длительном наблюдении и они также проявляют признаки деградирования [14, 25]. В настоящее время одним из наиболее отработанных подходов является белковая модификация клеточной культуры цитокином Tgfβ3, играющим ключевую роль в хондрогенной пролиферации клеточной культуры. Механизм действия данного цитокина подробно описан в научных публикациях [31-33].
Целью данного исследования было оценить влияние цитокина Tgfβ3 на экспрессию генов хондрогенеза (col2a1, tgfβ3, sox9) и динамику перифокальных реакций при замещении дефекта суставного хряща клеточно-инженерной конструкцией в эксперименте.
Материал и методы исследования. Эксперимент in vivo. Исследование выполнено на 27 половозрелых самках крысы линии Wistar весом 260±40 г. Экспериментальная работа прошла этическую экспертизу и соответствовала международным рекомендациям по проведению медико-биологических исследований с использованием животных. Все животные случайным образом были разделены на 3 группы по 9 животных в каждой: Контрольная («D») – просто дефект, без трансплантации КИК; Без Tgfβ3 («С») – дефект с трансплантацией КИК, без модификации клеточной культуры цитокином Tgfβ3; С Tgfβ3 («TС») – дефект с трансплантацией КИК, с модификацией клеточной культуры цитокином Tgfβ3.
Животным формировали поверхностный дефект гиалинового хряща проксимального конца большеберцовой кости глубиной 0,5 мм и диаметром 1,0 мм с помощью специально разработанного нами устройства [34], после чего животным групп С и ТС в область сформированного дефекта трансплантировали КИК. После послойного закрытия раны крыс помещали в одинаковые условия с принудительной вентиляцией при 20°C и относительной влажностью 40–75%. На 14-е, 30-е и 90-е сутки после операции животных выводили из эксперимента и забирали блок тканей для гистологического исследования.
Культивирование и дифференцировка клеток. Культуру мезенхимных мультипотентных стромальных клеток (ММСК) выделяли из костного мозга половозрелых крыс. Культивирование клеток проводили в среде DMEM («Биолот», Россия) с 10% сыворотки FBS («Биолот», Россия) и пенициллин-стрептомицином («Биолот», Россия) в концентрации 25 мкг/мкл при стандартных условиях (температура 37°С, 5% СО2). Смену среды осуществляли каждые 3 суток. Контроль пролиферации проводили с помощью светового микроскопа Leica (Германия). Принадлежность клеточной культуры к ММСК (CD90+,CD45–) была подтверждена цитофлюориметрическим анализом, который выполняли после третьего пассажа с помощью прибора BDFACSAriaIII (BDBiosciences, США). Для дифференцировки ММСК в хондрогенном направлении использовали цитокин Tgfβ3 (Sigma, USA) в концентрации 10 нг/мкл с добавлением его при каждой смене среды.
Изготовление биодеградируемого скаффолда и КИК. Для изготовления скаффолдов на основе поли (D,L-лактида) (PLA) готовили растворы полимера в DMSO с 10% воды для инъекций. Образцы замораживали при –20°С в течение 24 часов, а затем замороженные образцы помещали в лиофилизатор при температуре –50°С и давлении 1 Торр для полного удаления растворителя. КИК получали статическим совмещением биодеградируемого носителя и культуры ММСК.
Проведение гистологических исследований. Для гистологических исследований блоки тканей оперированного сустава помещали в 10%-ный формалин, после чего декальцинировали при помощи препарата «ТрилонБ» («Нижегородхимпродукт», Россия) и готовили парафиновые блоки. Срезы толщиной 5–10 мкм получали с помощью микротома Leica (Германия). Окраску проводили гематоксилин-эозином («Био-Витрум», Россия) и альциановым синим («Био-Витрум», Россия) согласно прилагаемым производителем протоколам. Исследование образцов осуществляли с помощью микроскопа Leica (Германия).
Проведение полимеразной цепной реакции. Для оценки экспрессии основных генов, ответственных за хондрогенез, применяли полимеразную цепную реакцию в реальном времени. С ее помощью оценивали изменение экспрессии ответственных за хондрогенез генов: col2a1 – ген, кодирующий коллаген II типа, один из основных белков внеклеточного матрикса гиалинового хряща, tgfβ3 – ген, кодирующий белок Tgfβ3 – один из основных цитокинов, ответственных за хондрогенез, sox9 – ген, кодирующий один из основных транскрипционных факторов участвующий в хондрогенезе. Относительное увеличение высчитывали по методу 2–∆∆Сt. Для нормировки использовали ген 18S. Последовательности праймеров самостоятельно подбирали по базе PubMed.
Результаты исследования и их обсуждение. В ходе исследования установлено, что экспрессия тестируемых генов в клеточной культуре ММСК под действием цитокина Tgfβ3 превышала таковую в культуре без ММСК без дополнительной стимуляции (табл. 1).
Таблица 1
Увеличение экспрессии генов под действием белка Tgfβ3
|
Название гена |
Увеличение (раз) |
|
col2a1 |
800 |
|
tgfβ3 |
20 |
|
sox9 |
120 |
За время проведения эксперимента у подопытных животных отсутствовали воспалительные реакции, летальные исходы не зарегистрированы, что подтверждает безопасность применяемой КИК и соответствует опубликованным ранее результатам.
На 14-е сутки после формирования дефектов контрольной группе животных «D» в месте повреждения суставной поверхности визуализировали чашеобразный дефект, заполненный детритом – рыхлой, отечной волокнистой тканью с небольшим количеством мононуклеаров и фибробластов (рис 1, А, B, C). В группе «С» – с применением немодифицированной КИК – дефект определялся в виде углубления, заполненного массой КИК с крупными светлыми клетками внутри мембраны, с небольшим количеством фибробластов и волокон (рис. 1 D). Костная пластинка прерывалась в области дна дефекта, местами заполнялась волокнистой тканью (рис. 1 E). Визуализировались краевые некрозы хряща (кариолизис) после повреждения. Область дефекта была заполнена фрагментами КИК с крупными светлыми клетками и волокнистой тканью (рис. 1 F).
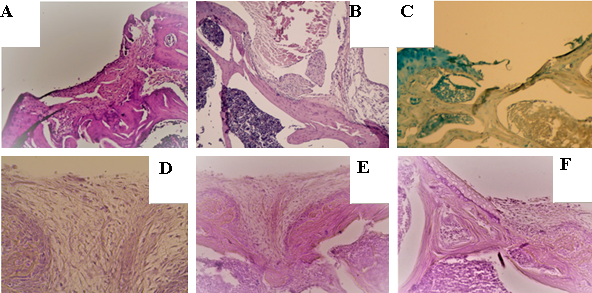
Рис. 1. Микрофотография препаратов области дефекта на 14-е сутки: A – группа «D»: чашеобразный дефект заполнен волокнистой тканью с мононуклеарами и фибробластами (окраска гематоксилин-эозином, ув. х40); B – группа «D»: дно дефекта – костная пластинка (окраска гематоксилин-эозином, ув. х100); C – группа «D»: деструкция, кариорексис и кариолизис хондроцитов в крае хряща (окраска альциановым синим, ув. х100); D – группа «С»: дефект заполнен массой КИК, представлен крупными светлыми клетками в сетке мембраны (окраска гематоксилин-эозином, ув. х400, конденсор опущен); E – группа «С»: прерывистая субхондральная пластинка в дне дефекта, группы хондроцитов на ней (окраска гематоксилин-эозином, ув. х200); F – группа «ТС»: в крае хряща – кариолизис, дефект заполнен скаффолдом с ММСК (окраска гематоксилин-эозином, ув. х200)
На 30-е сутки после операции в группе «D» дефект суставной поверхности визуализировали в форме более плоской чаши, заполненной примерно наполовину волокнистой тканью, местами с сосудами и четко очерченными краями (рис. 2 A, B). Дно дефекта было образовано прерывистой костной пластинкой, местами покрыто волокнистой тканью. В зоне дефекта хрящевая ткань или хондроциты отсутствовали. В суставном хряще по краям дефекта сохранялись некробиотические изменения. В указанные сроки в группе «С» область дефекта была заполнена волокнистой тканью с очагами хондроцитов, дно дефекта представляло собой прерывистую костную пластинку с очагами хондрального остеогенеза (рис. 2 C). В группе «ТС» на 30-е сутки в зоне дефекта также располагалась волокнистая ткань, среди коллагеновых волокон определялась КИК в виде сетки и группы больших округлых хондроцитоподобных клеток со светлой цитоплазмой и округлыми ядрами в ней. Глубже располагалась субхондральная костная пластинка с прослойкой хрящевой ткани разной толщины (рис. 2 D).
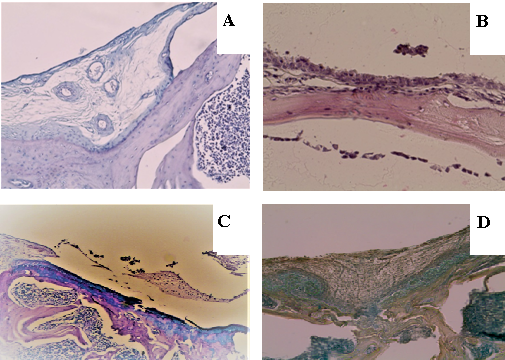
Рис. 2. Микрофотография препаратов области дефекта на 30-е сутки: A – группа «D»: волокнистая ткань с сосудами, заполняющая дефект (окраска альциановым синим, ув. х200); B – группа «D»: покрытое дно дефекта (окраска гематоксилин-эозином, ув. х400);
C – группа «С»: хондральный остеогенез в дне дефекта, слой хондроцитов на его поверхности (окраска альциановым синим, ув. х200); D – группа «ТС»: КИК с крупными хондроцитоподобными клетками со светлой цитоплазмой и группами хондроцитов в дне дефекта (окраска альциановым синим, ув. х200, конденсор опущен)
К 90-м суткам дефект суставной поверхности в группе «D» стал более плоским в сравнении с ранними сроками наблюдения. Примерно четверть его поверхности покрывала волокнистая ткань. Глубокая чаша дефекта сохранялась (рис. 3 А). Дно дефекта было представлено зрелой пластинчатой костью без хрящевых клеток и признаков остеогенеза, под ней располагалась губчатая кость с кроветворным костным мозгом между костными балками. В группе «С» в суставной поверхности выявлялся плоский дефект, заполненный волокнисто-хрящевой тканью (рис. 3 В). В ней были заметны очаги хондрального остеогенеза вокруг групп хондроцитов. В группе «ТС» определялась область повреждения с неровной поверхностью, дно было образовано прерывающейся костной пластинкой с широкой прослойкой хрящевой ткани на ней (рис. 3 С, D). Их окружали скопления хондроцитов.
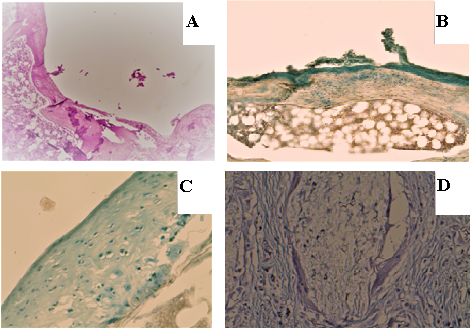
Рис. 3. Микрофотография препаратов области дефекта на 90-е сутки: A – группа «D»: костная пластинка в дне дефекта, покрыта волокнистой тканью разной толщины без элементов гиалинового хряща (окраска гематоксилин-эозином, ув. х100); B – группа «С»: волокнисто-хрящевая ткань с группами хондроцитов и участками хондрального остеогенеза в дне дефекта (окраска альциановым синим, ув. х200); C – группа «ТС»: хондроидная ткань на поверхности дефекта, хондроциты изолированные и в виде изогенных групп (окраска альциановым синим, ув. х400); D – группа «ТС»: сохранившиеся инкапсулированные фрагменты КИК в зоне дефекта (окраска альциановым синим, ув. х400, конденсор опущен)
В настоящее время активно развиваются методики, связанные с применением различных КИК, состоящих из биодеградируемого скаффолда, заселенного культурой клеток [28], однако многие молекулярные механизмы, связанные с клеточной пролиферацией, остаются неясными [35]. В нашей работе была изучена целесообразность применения цитокина Tgfβ3 для модификации КИК при замещении поверхностного дефекта гиалинового хряща с помощью гистологической методики, что согласуется с литературными данными как по выбору модели эксперимента, так и по использованию гистологического метода анализа результатов [36].
Ранее в эксперименте in vitro нами было показано, что применение цитокина Tgfβ3 при культивировании ММСК с 7-х суток наблюдения приводит к агрегации клеточной культуры, что было расценено как начало хондрогенной дифференцировки. Данное предположение подтвердили полученные нами результаты об относительном увеличении экспрессии генов col2a1, tgfβ3, sox9 в 800, 20 и 120 раз соответственно при культивировании ММСК в присутствии цитокина Tgfβ3, а также данные научных публикаций [33, 37].
Установленная в ходе эксперимента хорошая биосовместимость тестируемых КИК на ранних сроках наблюдения (14 суток) подтвердила полученные ранее результаты об отсутствии негативных тканевых реакций на трансплантацию биоматериалов из полимолочной кислоты [38, 39]. В указанный срок гистологическая картина в области дефекта была схожей во всех исследуемых группах, за исключением визуализации скаффолда в обеих опытных группах. Однако на 30-е сутки у животных группы «С» область дефекта частично заполнялась хондроцитами, в отличие от животных контрольной группы. В то же время после трансплантации КИК область дефекта в группе «С» была покрыта волокнистой тканью, тогда как в группе «ТС» – тканью с хондроцитоподобными клетками, что свидетельствует о положительном влиянии дифференцированных клеток на регенерацию гиалинового хряща. По нашему мнению, увеличение экспрессии ответственных за хондрогенез генов, согласно результатам РВ-ПЦР, под действием цитокина Tgfβ3 привело к увеличению синтеза белков внеклеточного матрикса гиалинового хряща, что косвенно подтверждается при окраске срезов тканей в области дефекта альциановым синим для выявления ГАГ. По-видимому, появление хондроцитоподобных клеток в области регенерата также связано с применением модифицированной цитокином Tgfβ3 культуры ММСК, что подтверждается данными Yamagata с соавт. [40]. При этом дальнейшее увеличение дефекта в контрольной группе является следствием низкой регенеративной способности гиалинового хряща [41-43].
К концу эксперимента (90-е сутки) гистологические различия области повреждения между исследуемыми группами были еще более выражены. У животных в контрольной группе в области латерального мыщелка определялась зона деструкции субхондральной кости, без каких-либо признаков регенераторного процесса. В то же время у крыс в группе «С» область дефекта была заполнена волокнисто-хрящевой тканью (рис. 3 C), а у животных в группе «ТС» четко визуализировалась прослойка хрящевой ткани с инкапсулированными остатками полилактидной мембраны в виде нитей, окруженных скоплениями хондроцитов (рис. 3D). В ходе исследования было выявлено, что в процессе приготовления гистологических препаратов отмечается частичная деградация трансплантированного полимерного носителя, что, на наш взгляд, говорит о необходимости разработки другого эффективного способа приготовления срезов для анализа регенеративных изменений в области созданного повреждения. По данным гистологических материалов не удалось однозначно определить полное замещение области повреждения в экспериментальных группах, что было показано ранее методом СЭМ [38]. Мы связываем этот факт с погрешностями при ориентации среза относительно центра дефекта и малым объемом исследуемого материала (экспериментальное животное – крыса), что требует дальнейшего исследования на более крупных моделях.
Заключение. Таким образом, применение цитокина Tgfβ3 способствует экспрессии генов хондрогенеза (col2a1, tgfβ3, sox9) и хондрогенной дифференцировке ММСК в культуре. По-видимому, заселение такой модифицированной культуры в скаффолд и трансплантация полученной КИК в область дефекта суставного хряща стимулируют перифокальные регенераторные процессы за счет увеличения синтеза белков внеклеточного матрикса гиалинового хряща, таких как ГАГ. Созданная технология получения модифицированной клеточно-инженерной конструкции представляется перспективной для дальнейшего изучения на более крупных моделях животных, включающего не только гистологические исследования, но и изучение физико-механических свойств полученных регенератов.
Список сокращений: КИК – клеточно-инженерная конструкция. ММСК – мезенхимные стромальные стволовые клетки. Tgfβ – трансформирующий ростовой фактор роста β. iPSC – индуцированные плюрипотентные стволовые клетки. PLA – полимолочная кислота. ГАГ – гликозаминоглинаны. РВ-ПЦР – полимеразная цепная реакция в реальном времени.



