Формирование многих патологий, таких как сахарный диабет, интоксикационный синдром, сопряжено с развитием окислительного стресса. Неблагоприятная экологическая обстановка вообще, и в нашем регионе в частности, представляет серьезную опасность для здоровья населения [1; 2]. Ионы цветных металлов поступают перорально через органы дыхания и наружные покровы. Повышенные концентрации никеля обладают мутагенными, аллергическими свойствами, вызывают образование АФК (активных форм кислорода) и онкопатологию. Чрезмерное поступление в организм никеля, кадмия, кобальта индуцирует свободнорадикальное окисление липидов, что способствует развитию дисфункции эндотелия в результате повреждения мембранных структур клеток сосудистой стенки [3]. На фоне влияния солей тяжелых металлов повреждается нитрооксидпродуцирующая функция эндотелия сосудов. Особое внимание в этом плане привлекает оксид азота (NO), как молекула - посредник реагирования клеток органов. Продуцируется оксид азота клетками эндотелия сосудов из L-аргинина с участием фермента NO-синтазы [4]. Различают 2 изоформы NOS - конститутивные: эндотелиальная - eNOS (NOS-3) и нейрональная nNOS (NOS-1), активность которых является Са-зависимой. Помимо этих двух видов, существует индуцибельная - iNOS (NOS-2), активируемая эндотоксинами и провоспалительными цитокинами [5; 6]. Поскольку основным субстратом синтеза NO является L-аргинин, то представляется интересным вопрос о биодоступности субстрата к eNOS, факторы, влияющие на этот процесс, а также влияние L-аргинина и его модифицированного производного L-NAME (NG-нитро-Lаргинин метиловый эфир) на продукцию оксида азота. Выяснение маркеров эндотелиальной дисфункции, которая сопровождается нарушением баланса между вазоконстрикцией и вазодилатацией, представляет научный интерес. В связи с изложенным не менее важной является разработка способов коррекции.
Цель исследования: выявление биохимических маркеров, свидетельствующих о механизмах нарушения окислительно-восстановительных процессов в условиях действия экопатогенных факторов и разработка способа их коррекции.
Материал и методы исследования. Подопытные биологические объекты (крыс подбирали по массе и возрасту) состояли из 5 групп: 1-я - контрольная, 2-я - с моделью никелевых ангиопатий в дозе 0,5 мг/кг веса животного, 30 дней парентерально, 3-я и 4-я группы - введение L-NAME (25 мг/кг) интактным и интоксифицированным крысам, 5-я группа - введение коэнзима композитума (10 мг/кг, 30 дней) на фоне интоксикации хлоридом никеля. Экспериментальные исследования соответствовали требованиям проведения работ с использованием экспериментальных животных и условиям Хельсинкской декларации. В работе определяли: интенсивность перекисного окисления липидов (ПОЛ) в эритроцитах, гомогенатах ренальной ткани по концентрации диальдегида малоновой кислоты (МДА) на фотоэлектроколориметре (ФЭК) по методу Asacawa; состояние антиокислительной защиты клеток (АОЗ) - по активности каталазы (метод Королюка М.И) и супероксиддисмутазы (СОД) по аутоокислению адреналина, концентрацию церулоплазмина (ЦП) в сыворотке по методу Равина. Активность натриевого насоса в ткани почек - методом Scou ТС (1957). Содержание в плазме крови суммарных конечных метаболитов оксида азота (NOx) определяли с реактивом Грисса. С целью выявления предатерогенных изменений в сосудистой системе изучали метаболизм холестерина: общий холестерин (ХС), холестерин липопротеинов высокой плотности (ХС ЛПВП), холестерин липопротеинов низкой плотности ХС ЛПНП, триацилглицериды (ТАГ).
Для выявления достоверности показателей использовали программы статанализа Statistika 6.0 и Microsoft Office Excel.
Результаты исследования и их обсуждение. Избыточные концентрации ионов никеля в плазме крови и выделение почками при регулярном введении регенерируют активные радикалы, стимулирующие ПОЛ в красных кровяных клетках, а также во внутренних органах. Маркером этих изменений является повышение содержания альдегида малоновой кислоты в клетках крови, коркового и мозгового вещества ренальной ткани.
Свое участие в развитие окислительного стресса вносит нарушение ферментативной составляющей антиокислительной системы (АОС) организма. Она обеспечивается СОД, глютатионредуктазой и пероксидазой. Второй линией антиоксидантной защиты является каталаза, оксидоредуктаза, расщепляющая пероксид на молекулу кислорода и воды. Церулоплазмин в плазме крови выполняет антиоксидантную функцию. Наши данные показали снижение активности СОД в эритроцитах на 65% и повышение активности каталазы и ЦП на 39% и 16,7% соответственно, как проявление компенсаторной реакции организма. Эти данные идут в унисон со сведениями литературы, свидетельствующими об индуцировании ионами тяжелых металлов процесса ПОЛ [3].
Образующийся супероксид-анион радикал взаимодействует с оксидом азота, что способствует снижению концентрации в сыворотке крови суммарных метаболитов NO. При этом образуется сильный окислитель - пероксинитрит. Важную роль играет путь передачи сигнала от L-aргинина к NO, т.е. механизм транспорта L-аргинина к эндотелиальной NO-синтазе и нарушение экспрессии eNOS [7]. В этом плане одной из возможных причин препятствия транспорту L-аргинина к эндотелиальной NO-синтазе могут быть метаболические изменения, в частности обмена холестерина. Повышенное содержание холестерина в сыворотке крови является фактором риска развития атеросклероза в эндотелии сосудов. Более того, следует заметить, что в этом процессе важную роль играют ЛПНП. В наших исследованиях при систематической интоксикации хлоридом никеля отмечается гиперхолестеринемия и гипер-β-липопротеинемия при снижении ХС ЛПВП. Принимая во внимание условия окислительного стресса, предатеросклеротическое поражение (липоидоз) в интиме развивается при неконтролируемом захвате циркулирующих в кровяном русле холестеринсодержащих ЛПНП клетками стенки сосудов, в результате чего образуются богатые липидами «пенистые клетки». Окислительной модификации подвергаются фосфолипиды наружного слоя ЛПНП, так как в крови имеется большое количество индукторов окисления: кислород, ионы железа, гемопротеиды. В процессе окисления ЛПНП первичные продукты - липопероксиды в результате окислительной деструкции продуцируют α-оксоальдегиды, подобные МДА. Альдегидные группы МДА способны легко реагировать с Σ-аминогруппами аргинина в апопротеине В100 частиц ЛПНП. Происходит окислительная модификация белковой молекулы, она реагирует со «скэвинджер» рецепторами фагоцитов, обеспечивая более эффективный захват липопротеиновых частиц с образованием «пенистых клеток». Одновременно с этим происходит угнетение аффинности ЛПНП к собственным рецепторам, что поддерживает повышенное содержание холестерина в крови. Следует подчеркнуть, что эти изменения в метаболизме холестерина препятствуют транспортному механизму. Помимо этого фактора, на содержание оксида азота может оказывать влияние сам субстрат L-аргинин и его модифицированное производное L-NAME. Возможность использования L-аргинина NO-синтазой определяли в другом варианте исследований на фоне экспозиции хлоридом никеля в течение 30 дней. Результаты показали антиоксидантные свойства аминокислоты по данным снижения содержания МДА в крови. Адаптивная система в условиях снижения интенсивности ПОЛ показала повышение активности СОД и снижение уровня каталазы и ЦП (рис.). Эти изменения способствовали повышению концентрации NO на фоне L-аргинина в токсических условиях. Модифицированный L-аргинин - L-NAME показал противоположные результаты: повышение интенсивности свободнорадикального окисления (СРО) при ингибировании АОС, что сопровождалось более выраженным снижением концентрации NO сравнительно с уровнем при интоксикации. Наряду с этим L-аргинин оказал позитивное влияние на липопротеиновые фракции, способствуя нормализации в обмене холестерина, одновременно улучшал биодоступность аминокислоты к eNOS. При введении L-NAME животным в токсических условиях отмечались противоположные аргинину результаты, сопровождающиеся более значительным снижением уровня оксида азота.
У экспериментальных животных в хронической стадии интоксикационного синдрома гемодинамические изменения в сосудах почек приводили к повышенному выделению с мочой калия и натрия. Причиной этих изменений было нарушение фильтрационно-реабсорбционных процессов, для выяснения которых определяли функцию фермента АТФ-азы, активируемой Na и K в гомогенатах почечной ткани. У подопытных животных с интоксикационным синдромом выявлено достоверное понижение активности функционального состояния Na+/K+-АТФ-азы в корковом и мозговом веществе ренальной ткани относительно контроля (р<0,001) на 64,4% и 64,6% соответственно. Наибольшее нарушение функции энзима выявлено в наружном мозговом веществе почек. Это связано с нахождением в нем толстого отдела восходящей части петли Генле. Именно в мозговом веществе почек функционирует Na-насос. Изменения физико-химических свойств фосфолипидов цитоплазматической мембраны канальцев почек в условиях окислительного стресса, в частности активности ПОЛ, может изменять молекулярные структуры и активность встроенной транспортной Na+/K+-АТФ-азы. Действительно, в эксперименте нами было установлено угнетение функциональной способности энзима и показано наличие обратной взаимосвязи между содержанием МДА и активностью Na+/K+-АТФ-азы в корке (r= -0.8) и медулле ренальной ткани (r= -0.75).
С целью коррекции негативного влияния интоксикационного синдрома на метаболические нарушения подавали коэнзим композитум длительностью один месяц. В состав этого препарата входит витамин Е и коэнзим Q. Применяя его, мы исходили из следующих представлений: витамин Е обладает способностью предотвращать окислительный стресс и нарушение липидной фазы цитоплазматических мембран. Восстановленная форма α-токоферола образуется с участием гидрофобного начала -убихинола. Сам по себе убихинол (QH2) является восстановленной формой убихинона (UQ), т.е. коэнзима Q10. Это активный антиоксидант, предотвращающий ПОЛ липидов мембран. Будучи в составе Q-цикла, происходят окислительно-восстановительные реакции в цепи переноса электронов, что и обеспечивает его регенерацию. Он же поддерживает и α-токоферол в восстановленной форме. Синтез коэнзима Q10 осуществляется из аминокислоты тирозина при участии кофакторов из витаминов группы В и микроэлементов, а боковая углеводородная цепь образуется из мевалоната - промежуточного предшественника синтеза холестерина. С другой стороны, убихинон индуцирует энергообразование и угнетение супероксид-анион радикала (O2-) в реакции сукцинатдегидрогеназы. Все эти метаболические изменения позитивного характера являются показателем его эффективности в ингибировании липопероксидации. Полученные результаты демонстрируют снижение интенсивности ПОЛ по данным содержания МДА в красных кровяных клетках крови, корковом и мозговом веществе ренальной ткани под влиянием коэнзима композитума.
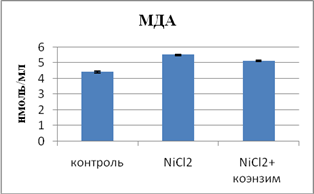
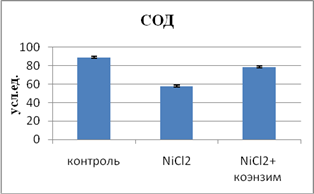
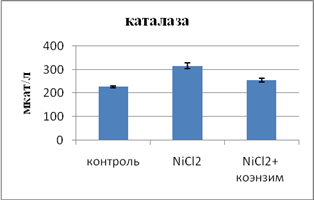
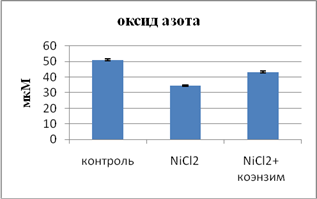
Влияние коэнзима композитума на систему ПОЛ - АОС и содержание оксида азота при интоксикации хлоридом никеля
С целью изучения вопроса, насколько эффективно влияние препарата на ферментативную составляющую АОЗ, изучали взаимосвязь между активностью ПОЛ и дисмутазной реакцией (СОД), что показало обратную связь (r=-0.46; р<0.01). Этому способствовало повышение активности адаптивных энзимов АОС. Анализ показал восстановление реакции дисмутации супероксид-анион радикала, которая достигла уровня контроля.
Следовательно, данные показывают регулирующее влияние коэнзима композитума на интенсивность тканевого дыхания, ингибирование образования активных метаболитов кислорода, что и способствует образованию энергии АТФ. Коэнзим композитум оказал позитивное влияние и на NO-продуцирующую функцию эндотелия сосудов. На фоне нормализации окислительно-восстановительного потенциала происходит индуцирование продукции оксида азота, и его концентрация на фоне терапии значительно возрастает (рис.). Такой эффект коэнзима композитума может быть обусловлен повышением доступности субстрата синтеза для eNOS. В этом механизме действия позитивную роль сыграла положительная динамика в обмене холестерина, которая происходит по принципу конкурентного ингибирования синтеза холестерина. На фоне введения подопытным животным с интоксикацией тяжелым металлом коэнзима композитума отмечено также повышение функциональной способности Na+/K+-АТФ-азы как в корковом, так в мозговом слоях почек соответственно на 27,3% и 30,13% вследствие адекватности окисления в цепи переноса электронов.
Следовательно, используемый в эксперименте препарат коэнзим композитум оказал положительное влияние на функцию сосудистого эпителия, что подтверждается повышением содержания оксида азота - как вазодилататора в крови у животных с интоксикационным синдромом, получавших этот препарат в течение месяца. На фоне лечения коэнзимом композитумом коррекция дисфункции эндотелия сопровождалась достоверным улучшением микроциркуляции в сосудах почек вследствие повышения содержания вазодилататора в крови на фоне антиоксиданта.
Заключение. Окислительный стресс при систематической интоксикации хлоридом никеля приводит к недостатку основного вазодилататора – NO, вследствие дефицита и снижения биодоступности L-аргинина, необходимого для образования оксида азота. В механизмах нарушения транспорта субстрата синтеза NO играет роль гиперхолестеринемия и гипер-β-липопротеинемия. Активные формы кислорода вызывают окислительную модификацию фосфолипидов и апопротеина В100, что способствует большей их атерогенности. С другой стороны, образующийся оксид азота, реагируя с активными радикалами, играет роль антиоксиданта и препятствует негативным изменениям в артериолах и капиллярах. Показателем эффективности данного антиоксиданта является ингибирование липопероксидации, повышение NO-образующей функции и дилатация мелких сосудов органов, включая почки. Кроме этого, на фоне применения коэнзима композитума происходит нормализация молекулярной структуры фосфолипидов клеточных мембран канальцев почек, адекватное восстановление кислорода в цепи переноса электронов и энергообразования, как активирующий фактор для фермента Na+/K+-АТФ-азы. Следовательно, на фоне введения коэнзима композитума снижаются проявления микрососудистых осложнений интоксикационного синдрома, включая вазоренальную патологию.



