Качество жизни во многом определяется состоянием опорно-двигательного аппарата (ОДА). В последние годы увеличивается рост патологии ОДА у детей и подростков, а распространенность сниженной относительно нормативных показателей для указанного возраста минеральной плотности кости составляет 16–38%, что является важной социально-гигиенической проблемой и увеличивает тяжесть медико-социальных последствий [1, 2]. Ученые выделяют критические периоды развития кости, сопровождающиеся ускоренным ремоделированием: первый год жизни, 5–7 лет и пубертатный период. В эти периоды повышена активность остеотропных гормонов [3, 4]. Проведенные ранее научные исследования [1, 2] доказывают, что именно в подростковом возрасте количественные и качественные изменения уровня гормонов в организме ведут к развитию первичного остеопороза и играют огромную роль в формировании вторичного остеопороза. Поэтому так важно определить исходное состояние кости, скорость и качество процессов ее обновления, а также уровень процессов ремоделирования.
Изучение влияния гормонального статуса на состояние ОДА – междисциплинарная проблема. Исследования известны с 1960-х гг., когда были установлены отклонения в функционировании гипофизарно-надпочечниковой системы и собственно коры надпочечников (В.И. Осташко, 1964; М.В. Волков с соавт., 1971; Т.Я. Балаба, 1973; А.М. Зайдман и И.Г. Фалк, 1976), выявлены изменения в содержании половых гормонов (Е.Н. Бахтина, 1990), исследован гормон роста (Дудин М, 1993) и др. Научных исследований изучения кальцийрегулирующих гормонов в формировании костной ткани у здоровых подростков недостаточно. Данный вопрос является актуальным, и работа в этом направлении позволит выделить уже в подростковом возрасте лиц, предрасположенных к развитию остеопенического синдрома в будущем, разработать профилактические программы профилактики и лечения.
Костная ткань состоит из клеток и внеклеточного матрикса, образованного коллагеновыми волокнами и неколлагеновыми белками, способными постоянно изменяться (ремоделироваться). Костный метаболизм на разных стадиях формирования кости регулируется: паратгормоном (ПТГ), соматотропным гормоном (СТГ), трийодтиронином (Т3), тироксином и тиреотропным гормоном, активной формой витамина D3 и другими факторами. Важным регулятором минеральной плотности костей является ПТГ, влияющий как на активность костной резорбции, так и на костеобразование, поскольку рецепторы для него обнаружены на остеобластах и на остеокластах. Установлено, что ПТГ может изменить способность остеобластов синтезировать коллаген, стимулирует остеокласты, повышая активность коллагеназы, увеличивает растворимость гидроксиапатитов, способствует выходу в кровь Са и Р из костного депо, регулирует mRNA RANKL в стромальных клетках костного мозга на поздних стадиях дифференцировки остеобластов, подавляя экспрессию OPG в «ранних» остеобластах. Под влиянием ПТГ и СТГ гормонов активируются пролиферация костномозговых клеток и созревание остеобластов. Малое количество ПТГ стимулирует костеобразование локально на трабекулярных и кортикальных костных поверхностях за счет увеличения числа и активности остеобластов. При значительном росте его содержания снижается минеральная плотность костей. Высокий уровень ПТГ приводит как к костным изменениям (уплощению тел позвонков, сколиозам, мышечной слабости и др.), так и к изменениям со стороны внутренних органов. Антагонистом ПТГ выступает тиреокальцитонин, основным свойством которого является способность уменьшать уровень Са и Р в плазме крови за счет усиления захвата Са и Р остеобластами, стимулирования функциональной активности остеобластов, торможения увеличения и функциональной активности остеокластов и усиления процессов резорбции кости [4].
В процессе ремоделирования тиреоидные гормоны оказывают влияние на частоту активации цикла ремоделирования [5], вследствие этого фаза резорбции и костеобразования становится короче. Научные исследования свидетельствуют, что гипертиреоз и гипотиреоз влияют на кальций-фосфорный обмен и костный метаболизм. Так, при тиреотоксикозе площадь поверхности неминерализированной матрицы увеличена [5], но активность остеобластов и остеокластов возрастает за счет повышенного уровня тиреоидных гормонов. Общим результатом такого механизма является потеря костной массы. В научных исследованиях показано, что тиреотоксикоз ведет к повышению костного обмена за счет увеличения количества остеокластов и резорбционных поверхностей [6, 7]. В результате избыточного действия тиреоидных гормонов процесс резорбции костной ткани доминирует над процессом формирования, так как увеличение активности остеобластов не может сбалансировать костную резорбцию. Тиреотоксикоз чаще всего сопровождается гипокальциемией, гиперфосфатемией, гиперкальциурией.
Т3-активатор метаболизма в организме повышает экскрецию Са с мочой, активирует обмен костной ткани, в большей степени резорбцию и опосредованно регулирует ответ остеобластов на ПТГ посредством изменения синтеза рецепторов к паратгормону. Воздействие Т3 на остеокласты происходит благодаря стимуляции цитокинов IL6, IL8 и простагландина E2, участвующих в остеокластогенезе [6, 7]. Однако существует и опосредованное воздействие тиреоидных гормонов на кость, они способствуют повышению чувствительности рецепторов на поверхности остеокластов к ПТГ. Когда уровень тиреоидных гормонов снижен, частота активации цикла ремоделирования уменьшается, а фазы костной резорбции и костеобразования удлиняются [8]. В состоянии гипотиреоза глубина полости резорбции меньше, но количество сформированной кости остается в норме, несмотря на снижение активности остеобластов. Это приводит к позитивному балансу в цикле ремоделирования.
При недостатке тиреоидных гормонов развиваются тяжелые изменения всех органов и систем, в том числе и ОДА. Повышенная продукция тиреоидных гормонов ведет к повышению костного обмена, происходит увеличение количества остеокластов, активируются процессы резорбции костных тканей, нарушается баланс резорбционных и костеобразующих центров, создается отрицательный костный баланс, резорбция кости опережает образование новой кости, что приводит к генерализованонму остеопорозу.
Губчатое вещество костной ткани является органом-мишенью для половых гормонов [9, 10]. После открытия специфических рецепторов на остеобластах к эстрогенам, андрогенам, гормону роста многие исследователи подтвердили прямое действие экзо- и эндогенных половых гормонов на костную ткань, в частности на активность остеобластов. Недостаток половых стероидов является фактором риска развития остеопороза [11]. Андрогены, в том числе и тестостерон, как у мужчин, так и у женщин оказывают влияние на пубертатное ускорение роста, определяют длительность пубертатного периода. Однако влияние андрогенов на рост в длину ограничивается их воздействием на эпифизарные хрящи [12]. Учеными достаточно хорошо изучен патогенез постменопаузального остеопороза [13].
В научной литературе есть данные влияния на формирование костной ткани, процессы остеогенеза гормона пролактина. Установлено при гиперпролактеинемии, в достоверной корреляции выраженность остеопенического синдрома и уровня пролактина (минеральная плотность костной ткани обратно пропорциональна уровню пролактина) [14], наблюдается снижение минеральной плотности костной ткани, в том числе у женщин гиперпролактинемическим гипогонадизмом [14].
При интенсивном образовании кости наблюдается увеличение в плазме крови уровня СТГ, который активирует синтез инсулиноподобного фактора роста (IGP-1), протеогликанов и коллагенов в костной ткани. Данный гормон совместно с ПТГ контролирует и уменьшает старение и апоптоз остеобластов, индуцирует угнетение экспрессии белков – ингибиторов циклинзависимых киназ – Р21 и Р16, поддерживает дифференциацию остеогенных клеток [15]. Гормон роста обладает выраженным анаболическим эффектом, он стимулирует клетки эпифизарных хрящей непосредственно через рецепторы на мембранах и опосредованно – через повышение синтеза ИФР-1 и ИФР-2. Известна важнейшая роль цитокинов IL1, IL6, IL4, IL10, IL11, γ-интерферона, TNF-a, CSF в регуляции остеогенеза и костного ремоделирования. Комбинированный эффект цитокинов состоит в регуляции не только функциональной активности остеогенных клеток, но и их апоптоза.
Витамин D3 как гормон регулирует дифференцировку остеокластов [15]. В частности, преостеобласты экспрессируют mRNA OPG/ RANKL, ее содержание контролируется кальцитриолом, паратгормоном и PGE2. У детей с остеопенией обнаружена ассоциация генотипов полиморфизма гена рецептора витамина D3 и генов цитокинов с концентрацией ПТГ в сыворотке крови и уровнем фосфата. Установлена взаимосвязь полиморфизма ряда генов, в том числе и гена витамина D3, и снижения минеральной плотности кости [10].
Таким образом, проведенный анализ научных исследований, изучающих особенности костного метаболизма, подтверждает важность кальцийрегулирующих гормонов. Однако исследований, изучающих уровень и взаимосвязи кальцийрегулирующих гормонов у здоровых подростков, нами не найдено, что и явилось одной из целей нашей работы.
Цель работы: оценить взаимосвязи структурно-функционального состояния опорно-двигательного аппарата, уровня кальцийрегулирующих гормонов и маркеров костного ремоделирования у здоровых подростков Приморского края.
Материалы и методы исследования. Изучено состояние здоровья 77 подростков I и II групп здоровья в возрасте от 15 до 17 лет, обучающихся в общеобразовательных учреждениях г. Владивостока. В исследуемую группу включены 46 девочек (61,6%) и 31 мальчик (38,4%). Средний возраст – 15,6 ± 0,64 года. Распределение по группам здоровья проводилось в соответствии с общепринятыми рекомендациями (проведены оценка соответствия биологического возраста паспортному, физического развития (методом центилей), оценка функционального состояния организма и др.). Изучение ОДА включало: общую оценку состояния костно-мышечной системы, осанки, двигательной активности, силовых возможностей, проведена электронная плантография. Использован метод активного интервью по разработанной индивидуальной карте с учетом добровольного информированного согласия. Проведено исследование в сыворотке крови: общего Са, неорганического Р, Mg, остеокальцитонина, активности щелочной фосфатазы, а также количественное определение гормонов на приборе Multiskan FC с помощью программы «BiometraBDA/BioDocAnalyze», статистическая обработка осуществлена посредством пакета анализа Statistika 10.0. в малых группах.
Результаты исследования и их обсуждение. Результаты клинического обследования оценки ОДА в исследуемой группе подростков 15–17 лет представлены в таблице 1.
Таблица 1
Оценка костно-мышечной системы в общей группе подростков (%)
|
Признак |
Частота встречаемости (%) |
||
|
Тип осанки |
Без нарушений – 40,2%; кифоз – 15,2%; лордоз – 3,3%; выпрямленная – 42% |
||
|
Телосложение |
Нормостеническое – 79,5%; гиперстеническое – 8,9%; астеническое – 10,7% |
||
|
Наличие сколиоза |
Отсутствие признака – 63,4%; 1-я степень – 33,9%; 2-я степень – 2,7% |
||
|
Форма ног |
Правильная – 58,9%; Х-образная – 22,3%; О-образная – 0,9% |
||
|
Изменения стопы |
|||
|
вальгус/варус |
Вальгусная деформация первого пальца |
Плоскостопие поперечное |
Плоскостопие продольное |
|
вальгус – 7,1%; варус – 1,8% |
S – 66,1%; D – 60,7% |
1-й степени – 33%; 2-й степени – 54,5%; 3-й степени – 2,7% |
1-й степени – 28,6%; 2-й степени – 7,1% |
|
Смещение костей таза |
Нет – 82,2%; правое – 8,8%; левое – 8,8% |
||
|
Гипермобильность суставов |
Нет – 79,8%; наличие – 20,2% |
||
|
Переломы |
Отсутствовали – 67,9%; 1 – 25,9%; 2 – 4,5%; 3 – 1,7% |
||
|
Вывихи |
Отсутствовали – 88,4%; 1 – 9,8%; 2 – 1,8% |
||
Нами выявлены достоверные возрастно-половые различия (р>0,05) по следующим признакам: осанка, наличие переломов и вывихов, сколиоз, плоскостопие, которые и были отобраны для проведения корреляционного анализа.
Показатели гормонов крови в исследуемой группе представлены в таблице 2.
Таблица 2
Средние значения показателей гормонов крови у подростков 15–17 лет (M± m)
|
Мальчики n = 31 |
Девочки n = 46 |
|
|
Гормон роста, нг/мл |
5,65±3,49 |
4,09±2,69 |
|
Паратгормон, пг/мл |
48,46±3,23 |
32,69±2,05 |
|
Кальцитонин, пг/мл |
1,36±1,62 |
8,92±2,70 |
|
Остеокальцин, нг/мл |
26,31±4,70 |
29,85±4,15 |
|
Витамин D, нг/мл |
14,9±2,70 |
13,86±3,10 |
|
Щелочная фосфотаза, МЕ/л |
204,1 ±2,80 |
112,2 ±1,45 |
|
ТТГ, мкМЕ/мл |
0,43±0,36 |
0,40±0,21 |
|
Св. тироксин, пмоль/л |
0,95±0,11 |
0,99±0,08 |
|
Трийодтиронин, пмоль/л |
1,2±0,15 |
1,3±0,012 |
|
Тироксин, пмоль/л |
0,63±0,01 |
0,61±0,07 |
|
Тестостерон, нмоль/л |
1,53±0,31 |
2,64±0,20 |
|
Прогестерон, нмоль/л |
1,53±0,20 |
1,37±0,31 |
|
ЛТГ, ед/л |
0,15±0,11 |
0,17±0,08 |
|
Пролактин, мкМЕ/л |
0,14±0,03 |
0,16±0,06 |
|
Кортизол, ммоль/л |
0,39±0,15 |
0,35±0,09 |
Анализ показателей минерального обмена (Са, Р, Мg) и витамина D выявил, что у 46 подростков (60%) уровень Ca находился в пределах нормы, тогда как у 31 (40%) школьников показатель Ca был повышенным, что при нормальных значениях паратгормона и повышенного кальцитонина (у девочек) характеризует состояние гиперпаратиреоза, характерного для подростков в данный возрастной период. Мы не исключаем, что при обследовании у подростков были дефекты забора крови (не натощак, например жевали жевательную резинку и т.д.). Только у 4 (5%) детей P в сыворотке крови был в пределах нормы, у 73(95%) показатели Р были выше нормы, что подтверждают дисбаланс кальциево-фосфорного обмена и снижение уровня витамина D в крови у подростков. Полученные данные уровня витамина D в исследуемой группе совпадают с общероссийскими данными. Более 85% (65 человек) подростков имели пониженный уровень витамина D (р>0,05).
При анализе взаимосвязи кальцийрегулирующих гормонов и ОДА (в зависимости от группы здоровья I и II) нами выявлен относительно сильный характер связи св Т3 и показателей ОДА у подростков II группы, критерий Фишера (F =6,932794807, значимость F=0,010247236, р<0,05), указывающий на наличие прямой взаимосвязи (рис. 1).
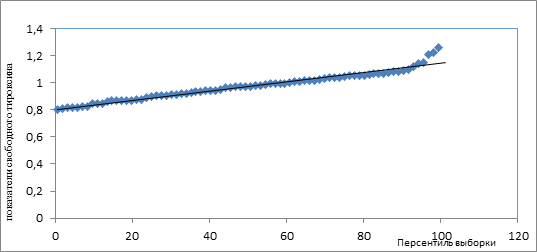
Рис. 1. Связь свободного тироксина и ОДА у детей со II группой здоровья
Учитывая ранее проведенные нами исследования (Крукович Е.В., Каблуков Д.А., 2018 и др.), мы предположили, что необходим более детальный анализ полученных взаимосвязей. Проведенный анализ распределения вариационных рядов изучаемых показателей позволил нам считать изучаемый процесс аллометрическим со всеми характерными для него математическими процессами, поэтому следующим этапом статистического анализа было изучение вопроса о наличии и силе связей между исследуемыми величинами внутри группы. С этой целью строились корреляционные матрицы на основании таблиц исходных данных (по Пирсону или Спирмену). Составленная корреляционная матрица позволила проанализировать совокупность изменения корреляционных связей между группами признаков в зависимости от пола (мальчики/девочки). Группа ФР включала длину тела (ДТ), массу тела (МТ), индекс массы тела (ИМТ), окружность грудной клетки (ОГК), группа ОДА – силу правой и левой руки, тип осанки, телосложение, гипермобильность суставов, форму ног, стопы и иное, а также использованы группа признаков уровня гормонов и группа кальциево-фосфорного обмена (Са, Р, Мg, витамин D). Пример силы и направленности корреляционных связей у девочек представлен на рисунке 2.
В процессе последующей обработки данных мы изучили вероятную изменчивость одного клинического признака в соответствии с изменчивостью других групп признаков. Нами выявлены: у мальчиков 15–17 лет слабые прямые связи частоты переломов с типом телосложения: r=0,343 (р≥0,041) и уровнем кальцитонина: r = 0,385 (р≥0,020), а у девочек – с Т4: r=0,323, (р≥0,037), а также у мальчиков отрицательные корреляционные связи ИМТ с показателями плоскостопия (r=–0,49) (р≥0,032) и частотой переломов (r=–0,48) (р≥0,035). Интересными мы считаем выявленные сильные, но отрицательные корреляционные связи признака «наличие вывихов» у мальчиков с уровнем Са r=–0,411 (р≥0,014), Р r=–0,909, (р≥0,005), Мg r=0,922, (р≥0,005).
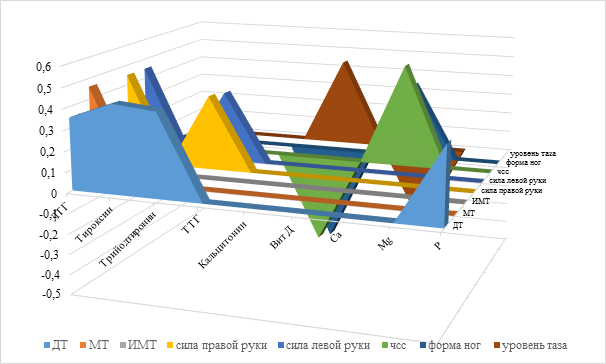
Рис. 2. Сила и направленность корреляционных связей у девочек 15–17 лет
У девочек обозначалась средняя прямая связь ДТ с показателями поперечного плоскостопия 2-й степени (r=0,33) (р≥0,031), с hallus valgus 2-й степени (r=0,35) (р≥0,023), а также с гормонами: ЛДГ (r=0,35) (р≥0,023), Т3 (r=0,43) (р≥0,004) и св Т3 (r=0,41) (р≥0,007) и уровнем Р (r=0,37) (р≥0,015). Выявлено наличие слабых, но отрицательных связей между показателями ДТ с отклонениями уровня таза (r=–0,36) (р≥0,020) и переломами (r=–0,38) (р≥0,012).
Изучение взаимосвязей показателей минерального обмена – уровня Са и тиреоидных гормонов – не выявило взаимосвязи между показателями уровня Т4 и Т3 (r=0,111 при значимости α=0,05 и r=–0,120, при значимости αз=0,05), тогда как свТ4 и Ca имели высокую тесную связь (r=1, r =0,22 при значимости α=0,05). Интересно, что в результате этого вида статистического анализа в данной исследуемой группе подростков нами выявлено отсутствие корреляционных и регрессионных взаимосвязей витамина D с состоянием ОДА, несмотря на средний дисбаланс показателей в общей выборке. Полученные результаты мы расценили как преморбидное состояние по формированию отклонений ОДА (состояние предболезни), что позволит нам рассматривать данную группу подростков как группу риска и назначить профилактические мероприятия.
Заключение. В результате проведенного исследования взаимосвязей структурно-функционального состояния ОДА и кальцийрегулирующих гормонов у здоровых подростков г. Владивостока в исследуемой группе нами выявлены частые отклонения со стороны ОДА у девочек по сравнению с мальчиками (р>0,05) по следующим признакам: осанка, наличие переломов и вывихов, сколиоз, плоскостопие. Средние показатели уровня гормонов находились в пределах возрастной нормы, не имелось достоверных половых различий, за исключением уровня тиреоидных гормонов. Выявлена зависимость между показателем св Т3 и наличием частоты переломов, а также между уровнем Са и св Т3. В исследуемой группе здоровых подростков выявлен дисбаланс кальцийрегулирующих гормонов и их взаимосвязей с ОДА, которые могут быть причиной нарушения метаболизма костной ткани в будущем.



