Центральная нервная система (ЦНС) управляет всем процессами организма через тонко настроенную нейронную сеть. Эта непрерывная деятельность не может осуществляться сама по себе, доказано, что помощь нейронам в этом оказывают клетки глии, а также внеклеточный матрикс, представляющий собой трехмерную структуру наподобие сети, которая окружает клетки, и ее свойства определяются особенностями той или иной ткани. При этом в ЦНС внеклеточный матрикс может выполнять несколько функций:
1) является биологическим скаффолдом, поддерживающим структуру ЦНС;
2) осуществляет контроль диффузии и доступности различных молекул, необходимых для биохимической сигнализации и коммуникации;
3) осуществляет контроль биохимических свойств ЦНС [1].
Более того, с внеклеточным матриксом напрямую связана способность тканей к регенерации, поскольку различные нарушения в механотрансдукции или отклонения от нормы в составе внеклеточного матрикса приводят к потере тканями и клетками этой способности; соответствующие иммунный и токсический ответы на инфекционные агенты также определяются правильным соотношением компонентов внеклеточного матрикса [2].
В ЦНС компоненты внеклеточного матрикса синтезируются и секретируются как нейронами, так и клетками глии, при этом качественный и количественный состав внеклеточного матрикса зависит от стадии развития головного мозга, соответственно, и от процессов нейро- и глиогенеза, которые в свою очередь также зависят от состава внеклеточного матрикса. Более того, состав внеклеточного матрикса оказывает влияние на процессы синаптогенеза и на функционирование синапсов, на основании чего была предложена концепция четырехстороннего синапса, одну из ведущих ролей в функционировании которого играет внеклеточный матрикс [3], способный развиваться с образованием специфических перинейрональных сетей (ПНС). Таким образом, внеклеточный матрикс выступает в роли своеобразного посредника между нейронами и астроцитами, благодаря чему может оказывать влияние на работу рецепторов, ионных каналов, передавать диффузные молекулярные сигналы, используя продукты протеолитического расщепления молекул, выделяемых нейронами и астроцитами.
Основными компонентами нейронального внеклеточного матрикса являются хондроитинсульфат протеогликаны лектинового семейства и гепарансульфат протеогликаны, а также тенасцины, ламинины и тромбоспондины, относящиеся к классу гликопротеинов [4].
При этом в структуре ПНС, так же как и в развивающейся ЦНС, наблюдается преимущественно экспрессия таких хондроитинсульфат протеогликанов, как аггрекана, бревикана, нейрокана и версикана, при этом экспрессия компонентов ПНС в разных регионах мозга гетерогенна. Предполагается, что хондроитинсульфат протеогликаны участвуют во многих процессах, обеспечивающих нормальное функционирование мозга, например в поддержании концентрации ионов, защите от оксидативного стресса и стабилизации синапсов [5].
Целью нашего исследования было определить уровни транскрипции генов, кодирующих компоненты внеклеточного матрикса в нейронах коры головного мозга и гиппокампа in vitro в ответ на индуцированное нейровоспаление.
Материал и методы исследования
Исследование проводилось на культуре нейронов, полученных от 3-дневных крыс линии Wistar.
Все манипуляции с использованием животных проводились в соответствии с этическими принципами, установленными Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (принятой в Страсбурге 18.03.1986 и подтвержденной в Страсбурге 15.06.2006).
Культуру нейронов получали из коры и гиппокампа головного мозга в соответствии с протоколом, опубликованным Beaudoin и соавторами [6].
Культуру астроцитов получали из аналогичных регионов в соответствии с протоколом, описанном Mecha и соавторами [7]. После получения готовой культуры астроцитов в них заменялась питательная среда с DMEM (Thermo Fisher Scientific) на Neurobasal-A (Thermo Fisher Scientific), в которой росли нейроны, поскольку последние особенно чувствительны к содержанию в среде фетальной бычьей сыворотки и других ростовых факторов. Затем производилось активирование астроцитов бактериальным липополисахаридом (ЛПС) Escherichia coli O127:B8 (Sigma-Aldrich) в концентрации 1 мкг/мл в течение 24 часов, таким способом создавались условия индуцированного нейровоспаления.
Питательная среда культуры нейронов заменялась питательной средой от активированных ЛПС и контрольной группы астроцитов, в которой нейроны находились 24 часа, после чего проводилось определение профилей транскрипции генов, кодирующих внеклеточный матрикс.
Для этого нами была выделена РНК из культур нейронов, выращивавшихся как в нормальных условиях, так и в условиях индуцированного нейровоспаления. Выделение РНК было произведено с помощью набора RNeasy Plus Mini Kit (Qiagen) в соответствии с протоколом, рекомендованным производителем, с дополнительной обработкой ДНКазой. Перед выделением РНК был подготовлен рабочий раствор буфера RLT (лизирующий буфер, прилагается в наборе) путем добавления в 1 мл буфера 10 мкл β-меркаптоэтанола. Концентрацию выделенной тотальной РНК измеряли с помощью флуориметра Qubit 2.0 («Invitrogen», США) и набора реагентов Qubit® RNA BR Assay Kit («Invitrogen», США). В результате выделения данным методом было получено около 1,5 мкг РНК.
Выделенная РНК была использована для постановки обратной транскрипции с целью получения кДНК. Проведение обратной транскрипции проводилось c помощью набора MMLV RT (Евроген) в соответствии с протоколом, рекомендованным производителем, с использованием термоциклера для амплификации нуклеиновых кислот C1000 (Bio-Rad). Концентрация кДНК измерялась с помощью флуориметра Qubit 2.0 и набора реагентов Qubit® dsDNA HS Assay Kit («Invitrogen»).
Полученные образцы кДНК были использованы для дальнейшей постановки ПЦР в реальном времени с целью определения уровней транскрипции генов, кодирующих компоненты внеклеточного матрикса в различных условиях.
Уровень транскрипции мРНК генов, кодирующих компоненты ВКМ, определяли методом ПЦР в реальном времени. В качестве референсного гена, относительно которого проводилась нормализация показателей уровня транскрипции исследуемых генов, был выбран ген глицеральдегид-3-фосфатдегидрогеназы (GAPDH) как один из наиболее стабильно экспрессирующихся генов в клетках. Для qRT-ПЦР использовали ДНК-полимеразу Taq и 10x буфер Taq, 50x SYBR Green I, смесь dNTP (все Евроген, Россия). Амплификацию проводили с помощью термоциклера CFX96 Thermal cycler («Bio-Rad», США) в 20 мкл реакционной смеси, содержащей: 1x буфера Taq, 1х SYBR Green I, 0,25 мкМ смеси dNTP, 0,3 нМ смеси праймеров, 0,2 мкл Taq ДНК-полимеразы. ПЦР в реальном времени проводили в следующих условиях: кДНК денатурировали при 95°С в течение 3 минут, затем следовали 50 циклов: денатурация при 95°С в течение 10 с, отжиг праймеров при 63°С в течение 30 с и элонгация цепи при 72°С в течение 20 с.
В качестве отрицательных контролей использовали реакционную смесь без добавления матрицы. Все исследуемые и контрольные образцы амплифицировали в пятикратной повторности.
Уровни транскрипции выбранных генов определялись с помощью метода 2-ΔΔСt. Статистическая обработка проводилась с помощью программного обеспечения GraphPad Prism 7. Оценку достоверности различий нормализованных уровней транскрипции генов компонентов внеклеточного матрикса между исследуемыми группами проводили с использованием непараметрического критерия Манна–Уитни, различия между сравниваемыми выборками считали статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
Для анализа уровней транскрипции генов компонентов внеклеточного матрикса нами были выбраны 20 генов, кодирующих основные компоненты внеклеточного матрикса, среди них: тенасцины C и R, рилин, агрин, аггрекан, бревикан, нейрокан, синдеканы (1–4) и ламинины (1a – 5a; 1b – 3b, 1c), а также были подобраны праймеры к референсному гену – глицеральдегид-3-фосфатдегидрогеназе (GAPDH).
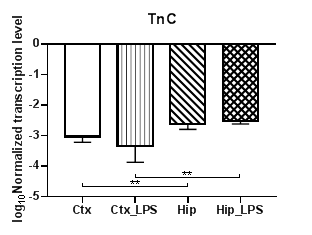
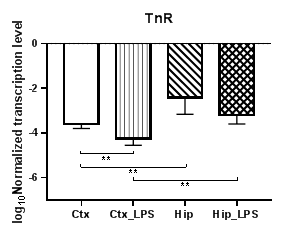
В результате проведенных нами исследований было установлено, что уровни транскрипции семейства тенасцинов (TnC и TnR) статистически значимо снижаются при индуцированном нейровоспалении в коре только для TnR (p<0,01) (рис. 1б), тогда как для TnC наблюдались лишь региональные различия в уровнях транскрипции между контрольными и экспериментальными группами (p<0,01) (рис. 1а). Для TnR также были выявлены статистически значимые региональные различия в уровнях транскрипции при сравнении обеих групп (p<0,01).
|
а) |
б) |
Рис. 1. Относительные уровни транскрипции генов TnC (а) и TnR (б) в коре головного мозга (Ctx) и гиппокампе (Hip), нормализованные на референсный ген, представленные в логарифмической шкале. Ctx – нейроны префронтальной коры (контроль);
Ctx_LPS –нейроны префронтальной коры с индуцированным нейровоспалением;
Hip – нейроны гиппокампа (контроль); Hip LPS – нейроны гиппокампа с индуцированным нейровоспалением; ** – p<0,01
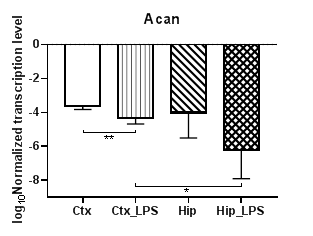
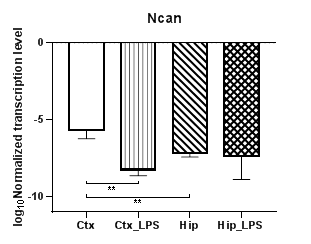
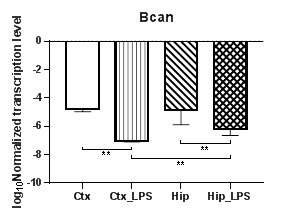
Анализ уровней транскрипции протеогликанов (аггрекана, нейрокана и бревикана) показал, что уровни транскрипции гена аггрекана (Acan) (рис. 2а) и нейрокана (Ncan) (рис. 2б) в коре в условиях индуцированного нейровоспаления статистически значимо снижаются (p<0,01), для гена бревикана (Bcan) (рис. 2в) в коре и гиппокампе наблюдались аналогичные изменения (p<0,01). Кроме того, для экспериментальных групп были выявлены региональные статистически значимые различия в уровнях транскрипции для Acan (p<0,05) и для Bcan (p<0,01), а для Ncan – в контрольных группах (p<0,01).
|
а) |
б) |
|
в) |
|
Рис. 2. Относительные уровни транскрипции генов Acan (а), Ncan (б) и Bcan (в) в коре головного мозга (Ctx) и гиппокампе (Hip), нормализованные на референсный ген, представленные в логарифмической шкале. Ctx – нейроны префронтальной коры (контроль); Ctx_LPS – нейроны префронтальной коры с индуцированным нейровоспалением;
Hip –нейроны гиппокампа (контроль); Hip LPS –нейроны гиппокампа с индуцированным нейровоспалением; * – p<0,05; ** – p<0,01
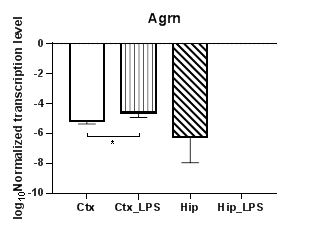
Анализ гена агрина (Agrn) (рис. 3а) продемонстрировал статистически значимое повышение уровней транскрипции в коре (p<0,05) при сравнении контрольной группы с экспериментальной, при этом в гиппокампе в условиях индуцированного нейровоспаления агрин прекращает транскрибироваться. При анализе гена рилина (Reln) (рис. 3б) было обнаружено статистически значимое снижение уровней транскрипции в гиппокампе (p<0,01) при сравнении контрольной группы с экспериментальной, при этом в коре изменений, вызванных индуцированным нейровоспалением, не наблюдалось. Также были выявлены региональные различия в уровне транскрипции между экспериментальными группами (p<0,01).
|
|
|
Рис. 3. Относительные уровни транскрипции генов Agrn (а) и Reln (б) в коре головного мозга (Ctx) и гиппокампе (Hip), нормализованные на референсный ген, представленные в логарифмической шкале. Ctx – нейроны префронтальной коры (контроль);
Ctx_LPS –нейроны префронтальной коры с индуцированным нейровоспалением;
Hip – нейроны гиппокампа (контроль); Hip LPS – нейроны гиппокампа с индуцированным нейровоспалением; * – p<0,05; ** – p<0,01
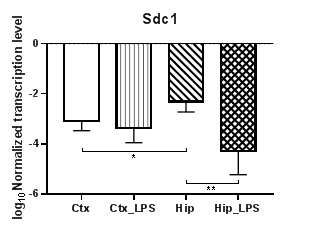
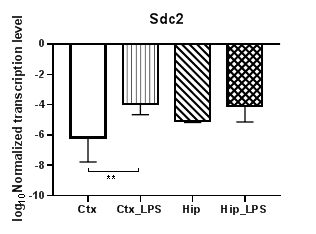
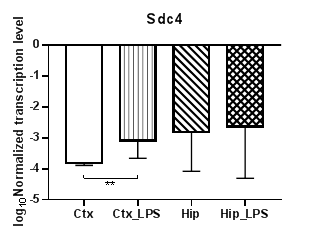
Анализ четырех генов семейства синдеканов (Sdc1 – 4) (рис. 4) показал статистически значимое снижение уровней транскрипции гена Sdc1 (рис. 4а) в гиппокампе (p<0,01) и практически неизменные значения уровня транскрипции в коре, тогда как для гена Sdc2 (рис. 4б) уровни транскрипции в коре повысились (p<0,01), а в гиппокампе не изменились. В то же время для Sdc1 наблюдаются статистически значимые различия в уровнях транскрипции для контрольных групп (p<0,05). Аналогично Sdc2 уровни транскрипции Sdc4 (рис. 4в) в коре повысились (p<0,01), а в гиппокампе не изменились. В уровнях транскрипции гена Sdc3 статистически значимых различий не наблюдалось.
|
а) |
б) |
|
в) |
|
Рис. 4. Относительные уровни транскрипции генов Sdc1 (а), Sdc2 (б) и Sdc3 (в) в коре головного мозга (Ctx) и гиппокампе (Hip), нормализованные на референсный ген, представленные в логарифмической шкале. Ctx – нейроны префронтальной коры (контроль); Ctx_LPS – нейроны префронтальной коры с индуцированным нейровоспалением;
Hip –нейроны гиппокампа (контроль); Hip LPS – нейроны гиппокампа с индуцированным нейровоспалением; * – p<0,05; ** – p<0,01
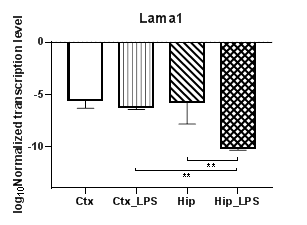
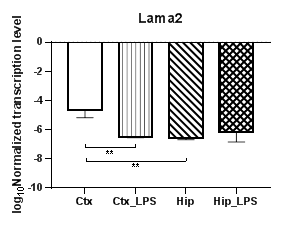
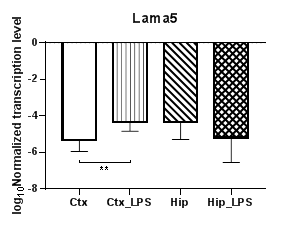
Анализ пяти генов α субъединиц белков ламининов (Lama1 – 5) (рис. 5) продемонстрировал полное отсутствие транскрипции гена субъединицы α3 (Lama3). При этом уровни транскрипции гена Lama1 (рис. 5а) статистически значимо снижались в гиппокампе (p<0,01) и демонстрировали региональные различия между экспериментальными группами (p<0,01). При анализе гена Lama2 (рис. 5б) были выявлены статистически значимые снижение уровней транскрипции в коре (p<0.01) и региональные различия в контрольных группах (p<0,01). Уровни транскрипции гена Lama4 не изменялись в условиях индуцированного нейровоспаления, тогда как уровни транскрипции гена Lama5 (рис. 5в) в коре статистически значимо повышались (p<0,01).
|
а) |
б) |
|
в) |
г) |
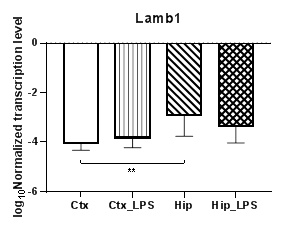
Рис. 5. Относительные уровни транскрипции генов Lama1 (а), Lama2 (б), Lama5 (в) и Lamb1 (г) в коре головного мозга (Ctx) и гиппокампе (Hip), нормализованные на референсный ген, представленные в логарифмической шкале. Ctx – нейроны префронтальной коры (контроль); Ctx_LPS – нейроны префронтальной коры с индуцированным нейровоспалением;
Hip – нейроны гиппокампа (контроль); Hip LPS –нейроны гиппокампа с индуцированным нейровоспалением; ** – p<0,01
Анализ трех генов β субъединиц белков ламининов (Lamb1 – 3) и одной субъединицы γ1 (Lamc1) продемонстрировал полное отсутствие транскрипции гена субъединицы γ1 в нейронах. Уровни транскрипции гена Lamb1 (рис. 5г) не изменялись в условиях индуцированного нейровоспаления, однако наблюдались статистически значимые региональные различия в уровнях транскрипции между контрольными группами (p<0,01). При этом ген Lamb2 транскрибируется примерно на одном и том же уровне в обоих регионах независимо от условий. Ген Lamb3 (рис. 6б), напротив, транскрибируется лишь в условиях индуцированного нейровоспаления.
Снижение уровней транскрипции протеогликанов, в том числе растворимых хондроитинсульфат протеогликанов (аггрекана, нейрокана и бревикана), и тенасцинов-R и -C в условиях индуцированного нейровоспаления может свидетельствовать о стремлении нейронов подавить их ингибирующее действие на рост аксонов [8, 9] и, следовательно, способствовать функциональному восстановлению связей между нейронами. Ламинины и синдиканы, так же как и протеогликаны, оказывают влияние на рост нейрональных отростков, однако, в отличие от протеогликанов, ламинины и синдиканы, наоборот, способствуют росту аксонов [10, 11]. Таким образом, повышение уровней транскрипции ламинина α5 в коре и появление транскрипции β3, а также повышение уровней транскрипции синдикана 2 и 4 в обоих регионах головного мозга тоже могут свидетельствовать о противодействии разрушения связей между нервными клетками. При этом о функциональной нестабильности нейронов в условиях индуцированного нейровоспаления свидетельствует снижение уровней транскрипции рилина, необходимого для поддержания процессов синаптической пластичности, обучения и памяти [12]. В поддержании процессов синаптической пластичности также участвует гепарансульфат протеогликан – агрин [13, 14], повышение уровней транскрипции которого в коре в условиях индуцированного нейровоспаления указывает на стремление к восстановлению межклеточных взаимодействий, тогда как прекращение транскрипции в гиппокампе может означать повышенную чувствительность данного региона мозга к воздействию индуцированного нейровоспаления.
Заключение
Таким образом, в результате проведенного исследования нами были получены для нейронов in vitro профили транскрипции генов, кодирующих компоненты внеклеточного матрикса, а также продемонстрированы изменения в уровнях транскрипции этих генов в условиях индуцированного нейровоспаления, указывающие, с одной стороны, на развитие функциональной нестабильности нейронов, а с другой – на стремление клеток нивелировать неблагоприятные эффекты от нейровоспаления посредством изменения уровней транскрипции генов компонентов внеклеточного матрикса.
Работа выполнена при поддержке гранта РФФИ 18-34-00152.




 а)
а)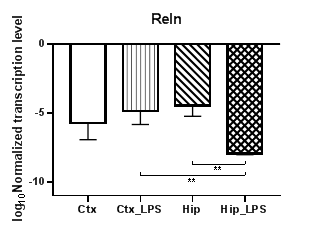 б)
б)