До недавнего времени нейроны считали основными функциональными единицами нервной системы, тогда как клетки глии – лишь опорными и вспомогательными элементами. Однако за последние несколько лет эта концепция сильно изменилась. Исследования показывают, что глиальные клетки не просто образуют опорный каркас нервной ткани, но также обеспечивают нормальное функционирование нейронов: поддерживают баланс ионов, регулируют уровень нейротрансмиттеров в синаптической щели, выделяют глиотрансмиттеры, участвуют в энергетическом обмене и образовании гематоэнцефалического барьера, вырабатывают цитокины и факторы роста, способствуют формированию нейрональных сетей, удаляя малоактивные синапсы во время развития мозга [1]. Из всех глиальных клеток астроциты наиболее многочисленны и выполняют самые разнообразные функции. Исторически астроциты подразделяют на два типа, основываясь на морфологии и расположении: протоплазматические и фиброзные, находящиеся в сером и белом веществе соответственно. Но результаты последних исследований показывают, что гетерогенность астроглии не ограничивается этими двумя фенотипами.
Основываясь на экспериментальных данных, S. Miller с соавт. (2018) показали, что при развитии нейродегенеративных заболеваний, таких как болезни Паркинсона и Альцгеймера, профиль астроцитов изменяется, в частности снижается экспрессия калиевых каналов Kir4.1 и транспортера глутамата Glt1, а экспрессия глиального фибриллярного кислого белка (GFAP) повышается, в то время как при эпилепсии астроглия характеризуется пониженной экспрессией Kir4.1, Glt1, а также синтетазы глутамина (GS) и каналов AQP4 [2]. При развитии процессов нейровоспаления профиль астроцитов тоже изменяется. S. Liddelow с соавт. (2017) продемонстрировали, что под воздействием липополисахарида астроциты изменяют фенотип на нейротоксический (А1), который характеризуется повышенной экспрессией компонентов системы комплемента, в частности С3, но это происходит только в том случае, если микроглиальные клетки тоже активированы; в то время как нейропротекторный фенотип (А2) характеризуется повышенной экспрессией S100а10, Stat3 и CD14 [3]. Таким образом, молекулярный профиль глиальных клеток изменяется под воздействием различных внутренних и внешних факторов, и можно выделить фенотипы астроцитов, характерные для того или иного патологического состояния.
Большинство исследований посвящено изменениям глии при развитии нейродегенеративных заболеваний [4], процессов нейровоспаления, сопутствующих стрессовым расстройствам [5] или развитию системной иммунной реакции. Однако гетерогенность астроцитов в физиологическом состоянии и при нормальном старении также представляет большой интерес. Аналогично нейронам, которые различаются по морфологии, нейротрансмиттерному профилю и функциональным особенностям в разных регионах мозга, астроциты тоже демонстрируют морфологические и функциональные отличия. Например, региональной гетерогенностью экспрессии отличаются щелевые контакты астроцитов, состоящие из белков коннексинов CX43 и CX30: CX43 экспрессируется повсеместно в мозге, но в особенности в гиппокампе, в то время как CX30 – преимущественно в таламусе и мозжечке, значительно меньше – в коре и гиппокампе [6]. Даже в отношении белка цитоскелета GFAP существуют различия: в белом веществе чаще встречаются астроциты, для которых характерна высокая экспрессия GFAP (GFAPhi), в то время как в сером веществе большинство астроцитов экспрессируют этот белок в меньшем количестве (GFAPlow) [7]. Более того, астроциты демонстрируют гетерогенность внутри одного региона. Так, в гиппокампе мыши было обнаружено две популяции: так называемые пассивные астроциты, которые экспрессируют только транспортеры глутамата, и активные, для которых характерно наличие как транспортеров, так и рецепторов глутамата. Таким образом, астроциты представляют собой гетерогенную популяцию глиальных клеток как в морфологическом, так и в функциональном отношении. Исследование молекулярных механизмов этой гетерогенности необходимо для лучшего понимания нейрон-глиальных взаимодействий в здоровом мозге, а также при развитии различных патологических состояний. Целью настоящего исследования было изучение региональной гетерогенности астроцитов мозга крысы в отношении экспрессии двух наиболее часто используемых астроцитарных маркеров (GFAP и GS) in vitro.
Материалы и методы исследования
Для приготовления культур клеток использовали 3-дневных (Р3) крыс Rattus norvegicus domestica. Животных содержали в стандартных условиях вивария при световом режиме 12/12, доступе к корму и воде ad libitum. Эксперименты проводили в соответствии с этическими правилами работы с животными (приказ МЗ и СР РФ № 708н от 23.08.2010 г. «Правила лабораторной практики в Российской Федерации» и «European Convention for the Protection of Vertebral Animals Used for Experimental and Other Scientific Purposes». CETS No. 123). В работе использовали оборудование и реактивы для приготовления культур от ThermoFisher Scientific (США), реактивы для гистологии от Sigma Aldrich (США), антитела для иммуногистохимии и среду для приготовления препаратов от Abcam (Великобритания).
После декапитации проводили выделение регионов мозга (церебральная кора, гиппокамп, ствол мозга) в сбалансированном солевом растворе Хэнкса на льду. Полученные суспензии клеток пропускали через фильтр и помещали во флаконы, предварительно обработанные полилизином. Клетки выращивали в питательной среде DMEM-GlutaMAX, содержащей 10% бычьей сыворотки, а также пенициллин-стрептомицин. Смешанную глиальную культуру инкубировали в течение 11–14 дней при +37ºС в инкубаторе в атмосфере 5% CO2 и 95% воздуха, питательная среда менялась два раза в неделю. Клетки микроглии и олигодендроцитов отделяли от астроцитов с помощью шейкера (250 об/мин, при +37ºС), после чего культуру чистых астроцитов выращивали в течение 72 ч при +37ºС в инкубаторе в атмосфере 5% CO2 и 95% воздуха и рассаживали на покровные стекла. Затем клетки на стеклах фиксировали 4%-ным параформальдегидом на натрий-фосфатном буфере, промывали 3 раза буфером по 10 мин и инкубировали 8 ч в 5%-ном растворе бычьего альбумина с добавлением 0,01% тритона Х в течение 10 ч при +4ºС. По завершении инкубации проводили иммуногистохимическое окрашивание с помощью поликлональных антител кролика к GFAP (ab7260) и моноклональных антител мыши к GS (ab64613) в концентрации 1:1000 в течение 10 ч при +4ºС с последующей инкубацией со вторичными антителами к кролику с флуоресцентной меткой Alexa 647 (ab150075) и к мыши с флуоресцентной меткой Alexa 555 (ab150114) в концентрации 1:1000 в течение 2 ч при комнатной температуре на шейкере. Препараты окрашенных клеток готовили по общепринятой методике, в качестве заливочной среды использовали Fluoroshield с добавлением маркера нуклеиновых кислот DAPI.
Полученные препараты сканировали на конфокальном лазерном микроскопе LSM 780 (Zeiss, Германия) с использованием ультрафиолетового, аргонового и гелий-неонового лазеров. Всего было сделано по 15 фотографий в режиме z-stack для каждого региона мозга. Подсчет интенсивности флуоресценции проводили в режиме maximum intensity projection в программе ImageJ с учетом параметров «площадь клетки» и «интегрированная плотность». Скорректированную интенсивность флуоресценции для каждой клетки определяли отдельно по двум каналам и с учетом площади клетки и интенсивности флуоресценции фона. Измерения уровня флуоресценции GFAP и GS проводили на 200 клетках из каждого региона мозга. Статистическую обработку полученных данных осуществляли в программе GraphPad Prism 8 с использованием one-way ANOVA с последующим Sidak тестом для множественных сравнений. Статистически значимыми считали различия при р≤0,05. Анализ корреляции проводился с помощью вычисления коэффициента Пирсона.
Результаты исследования и их обсуждение
Астроциты, выделенные из разных регионов мозга, демонстрируют гетерогенность экспрессии GFAP и GS in vitro (рис. А-В). При анализе интенсивности флуоресценции было обнаружено, что между астроцитами из церебральной коры и гиппокампа нет статистически значимых различий в количестве белка GFAP (р=0,09), в то время как в астроцитах из ствола мозга экспрессия GFAP значительно выше (p<0,0001) (рис. Г). При этом следует отметить, что если в культурах коры и гиппокампа практически все клетки можно было охарактеризовать как GFAP+, то в культуре из ствола мозга наблюдалось большое количество GFAP-. Отсутствие GFAP не позволяет сделать однозначный вывод о принадлежности этих клеток к тому или иному типу, поэтому они не учитывались при анализе флуоресценции. Однако, если ранее в исследованиях GFAP рассматривали как универсальный маркер для всех астроцитов, на сегодняшний день известно, что существуют популяции астроцитов, не экспрессирующие этот белок. Более того, было показано, что в культурах клеток из мозга взрослого человека количество GFAP+ невелико, на экспрессию этого белка в культуре могут влиять концентрация сыворотки в питательной среде и эпигенетические модификации, как, например, в случае GFAP- клеток глиомы человека. Таким образом, астроциты, выделенные из ствола мозга, вероятно, подразделяются на две большие популяции in vitro: GFAP- и GFAP+, причем последние характеризуются повышенной экспрессией белка по сравнению с астроцитами, выделенными из церебральной коры и гиппокампа.
GFAP представляет собой белок промежуточных филаментов цитоскелета, основной функцией которого считается поддержание формы клетки. Интересно, что при подсчете площади клеток в культуре из трех регионов мозга значимой разницы между площадью астроцитов из церебральной коры и гиппокампа не выявлено, в то время как GFAP+ астроциты из ствола мозга значительно крупнее. Помимо механической функции поддержания формы клетки, GFAP также принимает участие в митозе, процессах миелинизации [8], взаимодействует с белками MEN1 и PSEN1. Последний, как предполагается, играет роль в накоплении β-амилоида и, возможно, связан с прогрессированием болезни Альцгеймера [9]. Мутации в гене GFAP приводят к развитию болезни Александера, которая характеризуется формированием волокон Розенталя, состоящих из иррегулярных скоплений филаментов GFAP и некоторых других белков, а также демиелинизацией и повышенным уровнем аутофагии. У мышей с нуль-мутацией по GFAP тоже наблюдается демиелинизация, а кроме того – нарушение функционирования гематоэнцефалического барьера (ГЭБ) [8]. Возможно, что в обоих случаях демиелинизация является следствием повышенной проницаемости ГЭБ, которая в свою очередь является следствием отсутствия GFAP или абнормальностей в его структуре.
Интересно, что мутации GFAP также приводят к нарушениям взаимодействия между астроцитами и нейронами. Известно, что астроциты в сером веществе характеризуются пониженной экспрессией GFAP по сравнению с астроцитами из белого вещества [7], и тогда можно предположить, что, так как в стволе мозга много проводящих путей, в нашей культуре большая часть GFAP+ астроцитов представляют собой клетки из белого вещества мозга. При травме мозга, развитии нейродегенеративных заболеваний или процессов нейровоспаления происходят изменение морфологии астроцитов, увеличение размеров клеток и увеличение количества GFAP [3]. Можно предположить, что астроциты из ствола мозга реагируют посредством увеличения экспрессии GFAP на какие-то факторы среды, например на компоненты сыворотки, то есть являются к этим компонентам более чувствительными, чем клетки из других регионов мозга.
Также стоит отметить, что существуют несколько изоформ GFAP: α, β, γ, δ/ε, κ, Δ135, Δ164, Δexon6, Δexon7, ζ [10], и вполне возможно, что с помощью антител, использованных в настоящей работе, были идентифицированы не все изоформы, а только те, которые наиболее полно представлены в астроцитах из ствола мозга. Таким образом, если раньше GFAP рассматривали исключительно как компонент цитоскелета и астроцитарный маркер, на сегодняшний день очевидно, что этот белок связан со многими жизненно важными функциями. Астроциты, выделенные из ствола мозга крысы, отличаются от астроцитов из коры и гиппокампа более высокой экспрессией GFAP, которая либо конститутивно высокая для этого региона мозга, либо является следствием региональной гетерогенности в чувствительности астроцитов к условиям in vitro.
Анализ интенсивности флуоресценции в отношении количества синтетазы глутамина (GS) in vitro показал, что астроциты из церебральной коры демонстрируют существенно более высокий уровень GS по сравнению с астроцитами из гиппокампа (р=0,038) и ствола мозга (p<0,0001) (рис. Д). При этом все GFAP+ клетки также можно охарактеризовать как GS+, хотя уровень синтетазы глутамина варьируется. Глутамат – основной возбуждающий нейротрансмиттер в ЦНС, и его концентрация во внеклеточном пространстве поддерживается на низком уровне благодаря работе астроцитарных транспортеров. GS в астроцитах синтезирует глутамин из потенциально токсичного в высоких концентрациях глутамата, при этом принимая участие в обезвреживании ионов аммония в нервной ткани. Было показано, что при отсутствии астроцитов культивируемые нейроны церебральной коры крысы значительно чаще погибают от эксайтотоксичности, вызванной чрезмерно высоким уровнем глутамата. Более того, при отсутствии астроцитов и/или недостаточном количестве глутамина в питательной среде нейроны начинают также экспрессировать GS [11], что указывает на важность этого фермента в метаболизме глутамата и аммония.
При некоторых патологических состояниях наблюдаются изменения экспрессии GS в астроцитах, однако характер изменений зависит от исследуемого региона. Например, при шизофрении происходит снижение экспрессии GS в церебральной коре, в то время как в таламусе экспрессия значительно повышается по сравнению с контролем [12]. При эпилепсии астроциты в гиппокампе демонстрируют пониженную экспрессию GS, что, вероятно, способствует поддержанию высокого уровня глутамата во внеклеточном пространстве и возникновению приступов. В моделях индуцированной гипераммониемии астроциты, находящиеся в непосредственной близости от глутаматергических нейронов, претерпевают морфологические изменения (происходят отек тела и отростков и общее увеличение площади клетки), а также компенсаторное увеличение экспрессии GS [13]. Так как ионы аммония свободно проникают через ГЭБ в паренхиму мозга, увеличение количества синтетазы глутамина наблюдается и в астроцитарных отростках, находящихся в периваскулярном пространстве. Таким образом, изменения в экспрессии GS при различных патологических состояниях свидетельствуют об изменении нормального функционирования астроцитов, причем они могут носить как адаптивный, так и маладаптивный характер.
Региональная гетерогенность экспрессии транспортеров, рецепторов и ферментов, участвующих в транспорте и метаболизме глутамата в здоровом мозге и при нормальном старении, еще мало изучена. Известно, что в церебральной коре и гиппокампе много глутаматергических нейронов и синапсов, поэтому повышенный уровень GS в астроцитах, выделенных из церебральной коры, по сравнению с уровнем GS в астроцитах в стволе мозга представляется логичным. Однако интересно, что астроциты в культуре сохраняют регионально гетерогенную экспрессию GS даже в отсутствие нейронов. Мы растили клетки на питательной среде, содержащей дипептид L-аланин-L-глутамин, который более стабилен в среде, чем L-глутамин, и позволяет избежать сильных колебаний в концентрации ионов аммония. Поэтому полученные нами данные свидетельствуют о регионально гетерогенном конститутивном уровне экспрессии GS в астроцитах in vitro.
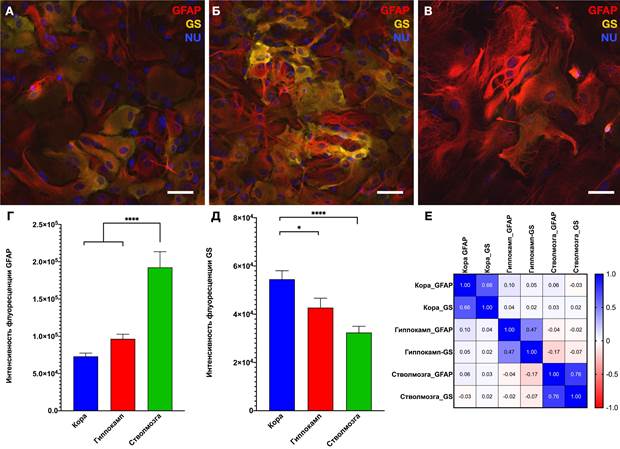
Региональная экспрессия GFAP (красный) и GS (желтый) в астроцитах из церебральной коры (А), гиппокампа (Б) и ствола мозга (В). NU (синий) – DAPI – маркер нуклеиновых кислот. Масштаб 50 мкм. Г, Д – интенсивность флуоресценции GFAP (Г) и GS (Д) в астроцитах из церебральной коры, гиппокампа и ствола мозга (ANOVA и Sidak тест).
Е – Тепловая карта корреляции экспрессии GFAP и GS
Интересно, что при анализе интенсивности флуоресценции между экспрессией GFAP и GS наблюдается положительная корреляция для астроцитов из церебральной коры (r=0,66), гиппокампа (r=0,47) и ствола мозга (r=0,76) (рис. Е). Исследования показывают, что активация рецепторов глутамата на астроцитах стимулирует фосфорилирование GFAP как в культуре клеток, так и в переживающих срезах [14]. Предполагается, что долговременная стимуляция глутаматом приводит к реорганизации цитоскелета клетки и, возможно, к изменению функционального состояния астроцитов. При этом увеличение концентрации глутамата во внеклеточном пространстве вызывает увеличение экспрессии GS. Корреляция экспрессии GFAP и GS наблюдается в условиях гипераммониемии [15], хотя молекулярные механизмы регуляции экспрессии этих белков являются предметом дискуссии. Таким образом, наши данные свидетельствуют о том, что астроциты из церебральной коры, гиппокампа и ствола мозга регионально гетерогенны в отношении экспрессии GFAP и GS in vitro.
Заключение
Астроциты демонстрируют региональную гетерогенность экспрессии GFAP и GS in vitro. Астроциты, выделенные из ствола мозга, отличаются от астроглии из коры и гиппокампа более высокой экспрессией GFAP, которая либо конститутивно высокая для этого региона мозга, что может быть связано с большим числом GFAPhi фиброзных астроцитов, либо является следствием региональной гетерогенности в чувствительности астроцитов к условиям in vitro. В отношении GS анализ флуоресценции показал, что астроциты из церебральной коры демонстрируют существенно более высокий уровень синтетазы глутамина по сравнению с астроцитами из гиппокампа и ствола мозга, что может быть связано с большим числом глутаматергических синапсов. При этом между экспрессией GFAP и GS наблюдается положительная корреляция для всех исследованных регионов мозга. Таким образом, астроциты представляют собой гетерогенную популяцию глиальных клеток, и исследование молекулярных механизмов этой гетерогенности необходимо для лучшего понимания нейрон-глиальных взаимодействий в здоровом мозге, а также при развитии различных патологических состояний.



