Несмотря на активное внедрение протезирующей пластики, совершенствование оперативной техники и вариантов размещения сетки, проблема эффективного лечения пациентов c грыжами больших размеров далека от своего решения [1]. Сохраняется высокая частота послеоперационных осложнений и рецидивов заболевания в данной категории больных [2]. Во многом это связано с формирующимися анатомическими и функциональными изменениями живота [3]. По данным компьютерной томографии у ряда пациентов с большими грыжами определяются редукция объема брюшной полости (loss of domain) и неполноценность мышечного каркаса брюшной стенки [4–6]. Данная категория пациентов нуждается в особом подходе, предоперационной подготовке, коррекции сопутствующей патологии и применении современных возможностей оперативного лечения. Для реконструкции брюшной стенки разработаны методы, в основе которых лежит техника разделения компонентов, использование которой позволяет успешно завершить пластику в ситуации потери домена [7, 8]. Принято различать переднюю (anterior components separation technique – ACST) и заднюю (posterior components separation technique – PCST) сепарацию [9]. В российских клиниках применение передней сепарационной пластики остается редким. Например, использование техники Ramirez описано в работе 2016 г. у 2 пациентов [10] и в публикации 2017 г. у 40 пациентов [11]. Это связано с техническими сложностями и недостаточным опытом проведения передних сепарационных пластик у большинства хирургов, высоким риском развития послеоперационных осложнений, а также с отсутствием рандомизированных контролируемых исследований с большим размером выборки и последующим длительным наблюдением. Несмотря на актуальность и сложность рассматриваемой проблемы, неоднозначность мнений экспертов, ограниченность и противоречивость клинических данных, при изучении литературы мы не нашли исследований ACST на экспериментальных животных.
Цель исследования: оценить техническую возможность и изучить особенности выполнения операции Ramirez II в остром эксперименте.
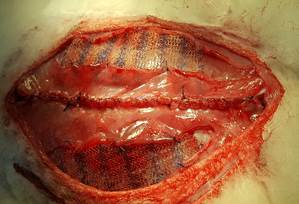
Материал и методы исследования. Работа выполнена в рамках вариативного цикла «Экспериментальная хирургия» на базе кафедры общей, оперативной хирургии и топографической анатомии им. А.И. Кожевникова на 17 половозрелых кроликах породы «Калифорнийский» и «Русская шиншилла» разного пола, массой 2,5–7 кг с разрешения локального этического комитета – протокол № 7 от 05.07.2018 г. Исследование проведено в соответствии с законодательством РФ («Правила гуманного обращения с лабораторными животными», «Деонтология медико-биологического эксперимента») и концепцией 3R (reduction, refinement, replacement), актуальной в экспериментальной хирургии и биологии [12]. В остром эксперименте создавали дефект брюшной стенки 5 см шириной и 15 см длиной. Операции выполнены в условиях общей анестезии препаратами Золетил 100 (25 мг/кг) и Ксилавет (3 мг/кг) внутримышечно. Животным проводили измерение длины паховой связки, реберной дуги до задней подмышечной линии, определяли расстояние от мечевидного отростка до симфиза, а также между концами 11 ребер и передними остями подвздошных гребней, окружность талии. Вычисляли площади передней стенки живота и грыжевого дефекта. Измеряли продолжительность оперативного вмешательства, внутрибрюшное давление (ВБД) – исходное и после ACST – аналогично I. Kron Последовательность этапов операции соответствовала передней сепарационной пластике Ramirez II. Рассекали кожу и клетчатку в проекции белой линии живота. Латеральнее последней на 2 мм осуществляли доступ во влагалища прямых мышц на протяжении 18–20 см билатерально. Создавали дефект 15х5 см, для этого иссекали задний влагалищный листок вместе с брюшиной (рис. 1). Далее выполняли препаровку в ретромускулярном пространстве (рис. 2). Затем производили диссекцию в подкожном слое, отступив 5 мм от латерального края прямой мышцы, проводили продольный разрез апоневроза наружной косой мышцы длиной до 18 см (рис. 3) и выполняли сепарацию между наружной и внутренней косыми мышцами в латеральном направлении до поясничных сосудов, что составляло около 6 см. Все этапы последовательно осуществляли билатерально. Края грыжевого дефекта ушивали непрерывным швом викрилом 2/0 (рис. 4). На восстановленный задний листок укладывали сетку, которую фиксировали узловыми швами викрилом 4/0 в двух местах. Затем укрепляли боковые поверхности живота, укладывая сетки в форме полуэллипса между наружной и внутренней косыми мышцами (рис. 5). Медиальный широкий край эндопротеза фиксировали узловыми швами викрилом 4/0 к латеральному краю прямой мышцы, а отсеченный край наружной косой мышцы фиксировали к латеральному полуовальному краю сетки. Ушивали передние листки влагалищ прямых мышц живота непрерывным швом нитью Monoplus 2/0, восстанавливая их медиальное анатомическое положение (рис. 6). Послойно ушивали рану. Этапы вмешательства показаны на рисунках 1–6. Для выведения животных из эксперимента применяли способ воздушной эмболии 7 мл/кг в краевую вену уха под наркозом. Результаты эксперимента обрабатывали средствами Statistica 10.0. Распределение количественных данных изучали методом Shapiro–Wilk. Использовали t-критерий Wilcoxon в зависимых выборках и тест Mann–Whitney – в независимых. При анализе количественных данных применяли корреляционный анализ Spearmen для выявления взаимосвязи с целью определения силы и направления последней использовали шкалу Чеддока. Различия считали статистически значимыми при p <0,05.
|
|
|
|
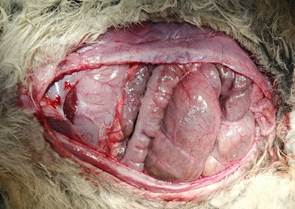
Рис. 1. Создание дефекта брюшной стенки |
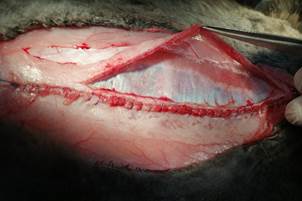
Рис. 2. Ретромускулярная диссекция. Пинцетом захвачена прямая мышца, рассечен апоневроз наружной косой |
|
|
|
|
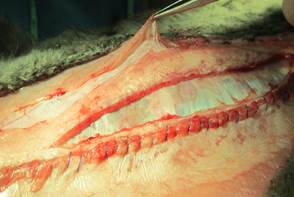
Рис. 3. Начало диссекции в наружных слоях передней брюшной стенки. Пинцетом захвачена наружная косая мышца |
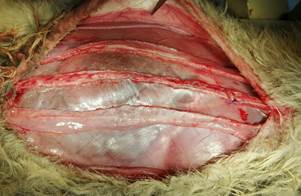
Рис. 4. Выполнена диссекция в ретромускулярном пространстве и в боковых областях живота. Задние листки влагалищ ушиты непрерывно |
|
|
|
|
Рис. 5. Размещение сеток, их фиксация и шов передних листков влагалищ прямых мышц |
Рис. 6. Белая линия восстановлена, прямые мышцы аппроксимированы в их естественной медиальной позиции |
Результаты исследования и их обсуждение. В результате эксперимента установлено, что выполнение передней сепарационной пластики на кролике вполне возможно. Тем не менее имелись технические трудности на определенных этапах, связанные как с особенностями анатомии передней брюшной стенки кролика, так и с опытом и мануальными навыками оператора. Площадь грыжевого дефекта у каждого животного была стандартной и составляла 58,875 см2. Данные отражены в таблице 1.
Таблица 1
Данные эксперимента
|
Измеренные параметры |
Min |
Q1 |
Median |
Mean |
SD |
Q3 |
Max |
|
Масса животного, кг |
2,5 |
3 |
3 |
3,5 |
1,04 |
3,5 |
7 |
|
Исходная окружность талии, см |
26 |
31 |
33 |
34,35 |
4,99 |
37 |
46 |
|
Окружность талии после операции, см |
26 |
30 |
33 |
33,18 |
4,79 |
35 |
45 |
|
Уменьшение объема талии в см |
0 |
0 |
1 |
1,18 |
0,95 |
2 |
3 |
|
Площадь брюшной стенки, см2 |
194 |
228 |
249,5 |
265,65 |
57,95 |
283,5 |
423,5 |
|
Отношение площадей дефекта и передней брюшной стенки, % |
13,9 |
20,77 |
23,59 |
23,01 |
4,28 |
25,82 |
30,35 |
|
ВБД до операции, мм рт. ст. |
2,9 |
3,8 |
4,4 |
4,16 |
0,76 |
4,4 |
5,5 |
|
ВБД после операции, мм рт. ст. |
4,4 |
5,2 |
5,9 |
6,25 |
1,28 |
7,4 |
8,8 |
|
Увеличение ВБД, мм рт. ст. |
0,6 |
1,5 |
2,1 |
2,09 |
1,13 |
3 |
4,5 |
|
Длительность операции, мин |
85 |
100 |
120 |
114,88 |
16,99 |
121 |
150 |
Примечание. Min – минимальное значение; Q1 – первый квартиль; Median – медиана; Mean – среднее арифметическое; SD – стандартное отклонение; Q3 – третий квартиль; Max – максимальное значение.
Выявлено статистически значимое уменьшение объема талии после операции в среднем на 1,18 см с интерквартильным размахом (ИКР 0–2 см), Т-критерий Wilcoxon р=0,002218. Результаты отражены на рисунке 7. Установлено повышение внутрибрюшного давления ВБД после передней сепарационной пластики в среднем на 2,09 мм рт. ст., ИКР 1,5–3 мм рт. ст., Т-критерий Wilcoxon р=0,000293 (рис. 8). По шкале Чеддока обнаружена сильная прямая корреляционная взаимосвязь: чем больше объем талии животного, тем больше площадь передней брюшной стенки, коэффициент корреляции Spearmen r=0,911019 при р=0,00000. Установлена умеренная прямая взаимосвязь между массой животного и площадью передней стенки живота, коэффициент корреляции Spearmen r=0,634235 при р=0,00001.
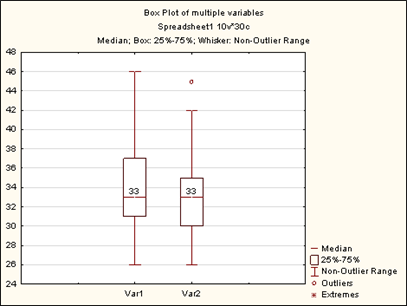
Рис. 7. Изменение объема талии животных в ходе эксперимента
По горизонтали: Var 1– объем талии животного до эксперимента медиана 33 см (ИКР 31–37 см); Var 2 – объем талии животного после эксперимента медиана 33 см (ИКР 30–35 см), по вертикали в см
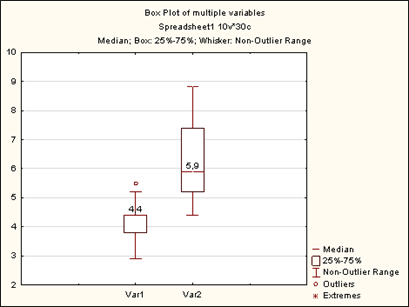
Рис. 8. Динамика ВБД в ходе эксперимента
По горизонтали: Var 1 – ВБД до эксперимента медиана 4,4 мм рт. ст. (ИКР 3,8–4,4 мм рт. ст.); Var 2 – ВБД после эксперимента медиана 5,9 мм рт. ст. (ИКР 5,2–7,4 мм рт. ст.), по вертикали шкала в мм рт. ст.
Рассмотренная модель ACST не только подходит для отработки и дальнейшего изучения данного вмешательства, но и может использоваться в учебных целях для совершенствования техники операции шаг за шагом, возможности работать с живыми тканями, позволяет видеть ошибки и исправлять их в ходе операции. Ранее зарубежные авторы изучили эластичность брюшной стенки кролика и человека [13]. Продемонстрирована взаимосвязь, позволяющая сопоставить ВБД кролика и человека. Выявлено, что стенки живота исследуемого объекта более эластичны, чем у человека. ВБД в нашем исследовании после операции Ramirez II в среднем составляло 6,25 мм рт. ст., что соответствует ВБД человека 12,3 мм рт. ст. (граница внутрибрюшной гипертензии) [14]. По анатомическому строению передняя брюшная стенка кролика в целом соответствует человеческой, но имеются особенности. Присутствует дополнительный мышечный слой – большая подкожная мышца (musculus subcutaneous). Последняя располагается непосредственно под кожей и простирается от шеи до паховых связок, а по бокам – до лопаток и боковых поверхностей живота. Из-за тонкого мышечного каркаса, где толщина каждой мышцы живота не более 1 мм, выполнение ретромускулярной диссекции было проблематичным. Особенно тонким оказался задний листок влагалища прямой мышцы ниже дугообразной линии, что иногда при неверном движении инструментом приводило к перфорации и проникновению в брюшную полость или повреждению эпигастральной артерии.
Заключение
В рамках настоящей работы впервые была выполнена операция Ramirez II у кроликов. Выбранная модель обладает достаточным размером передней брюшной стенки, ее строение соответствует строению таковой у человека. Продемонстрирована возможность и изучены особенности экспериментальной передней сепарации. Дана оценка сложности выполнения данного оперативного вмешательства на определенных этапах и его продолжительности, изучена динамика внутрибрюшного давления. Получены навыки выполнения ACST step by step. Следует полагать, что описанная модель может быть использована для дальнейшего изучения передней сепарационной пластики с целью закрытия больших грыжевых дефектов в хроническом эксперименте.