Профилактика факторов риска хронических неинфекционных заболеваний (ФР ХНИЗ) является приоритетным направлением развития здравоохранения Российской Федерации [1]. Данные факторы риска непосредственно влияют на развитие сердечно-сосудистых заболеваний, смертность от которых, по данным Всемирной организации здравоохранения, по-прежнему занимает первое место [2]. Ранней диагностике ФР ХНИЗ уделяется пристальное внимание. Так, 23 сентября 2018 г. в городе Нью-Йорке прошло «Третье Совещание высокого уровня Организации Объединенных Наций по неинфекционным заболеваниям», где были определены основные механизмы воздействия для профилактики ХНИЗ, а именно борьба с курением, злоупотреблением алкоголя, НФА и нездоровым питанием [3]. Как биологические, так и поведенческие факторы риска ассоциированы с развитием и тяжестью сердечно-сосудистых заболеваний, в частности ишемической болезни сердца [4–6]. При этом не только показана прямая взаимосвязь ФР ХНИЗ с развитием инфаркта миокарда (ИМ), но и продемонстрировано, что первый ИМ у мужчин наступает на 9 лет раньше, чем у женщин [7]. Однако данных о взаимосвязи биологических и поведенческих ФР ХНИЗ и их ассоциации с коронароангиографическим статусом при остром коронарном синдроме недостаточно.
Цель исследования: изучить особенности и взаимосвязи ФР ХНИЗ и их кумулятивное влияние на степень и распространенность коронарных стенозов у мужчин с острым коронарным синдромом (ОКС).
Материалы и методы исследовани. Были обследованы 98 мужчин, госпитализированных с 2014 по 2018 гг. в отделение кардиологии № 2 ГБУЗ «Челябинская областная клиническая больница» с диагнозом «острый коронарный синдром (ОКС)». Средний возраст пациентов составил 57,3±0,8 года. Промежуточный диагноз «ОКС» выставлялся на основании типичного болевого синдрома за грудиной и данных электрокардиографии согласно клиническим рекомендациям по ведению больных с ОКС (2016, 2018 гг.) [8, 9]. При последующей диагностике при повышении тропонина I или креатинфосфокиназы фракции МВ устанавливался диагноз «инфаркт миокарда» (n=73; 74%), а при их референсных значениях – «нестабильная стенокардия» (n=25; 26%).
У всех мужчин в соответствии с Национальными рекомендациями «Кардиоваскулярная профилактика» (2017 г.) оценивались биологические и поведенческие ФР ХНИЗ [4].
Для диагностики поведенческих ФР ХНИЗ все обследованные заполняли стандартизованный опросник «Countrywide Integrated Noncommunicable Disease Intervention Programmе» (1996 г.). По результатам анкет были выделены такие ФР ХНИЗ, как употребление в пищу фруктов/овощей <400 г/сут., злоупотребление алкоголем (более 20 мл/сут. в перерасчете на чистый спирт), табакокурение и низкая физическая активность (менее 150 минут в неделю).
Окружности талии (ОТ) и артериальное давление измерялись по методикам, изложенным в Национальных рекомендациях «Кардиоваскулярная профилактика» (2017 г.) [4]. Абдоминальное ожирение (АО) диагностировалось при ОТ >94 см. Артериальная гипертензия (АГ) выставлялась при повышении систолического артериального давления (САД) ≥ 140 мм рт. ст. и/или диастолического артериального давления (ДАД) ≥90 мм рт. ст. на 2 или более визитах при 2-кратном измерении, а также при нормальных значениях АД при установленном факте приема антигипертензивных препаратов. При измерении АД соблюдались условия и техника измерения, изложенные в Национальных рекомендациях [4].
Уровень триглицеридов (ТГ) (n=95) в сыворотке крови определяли энзиматическим колориметрическим методом (GPO/PAP) с глицерол фосфат оксидазой и 4-aminophenazone, общий холестерин (ОХС) (n=97) плазмы – колориметрическим ферментативным методом, ХС-ЛПВП (n=97) – гомогенным энзиматическим колориметрическим методом на биохимическом анализаторе AU480 (Beckman Coulter, США). Холестерин липопротеинов низкой плотности (ХС-ЛПНП) рассчитывался по формуле Friedwald, холестерин липопротеинов очень низкой плотности (ХС-ЛПОНП) – по формуле: ХС-ЛПОНП=ОХС – (ХС – ЛПНП + ХС – ЛНВП). Нарушения липидного обмена (НЛО) диагностировали при повышении ОХС >5,0 ммоль/л, ХС-ЛПНП >3,0 ммоль/л, ТГ ≥1,7 ммоль/л или снижении ХС-ЛПВП <1,0 ммоль/л. Также был оценен индекс атерогенности (ИА) по формуле Климова (1995 г.). Референсные значения ИА составляли ≤3,0 Ед.
Скорость клубочковой фильтрации (СКФ) рассчитывалась по формуле CKD – EPI. Снижением СКФ считалось значение <60 мл/мин/1,73 м2.
Уровень глюкозы определяли в сыворотке венозной крови натощак с помощью ферментативного гексокиназного метода на биохимическом анализаторе AU480 (Beckman Coulter, США). Гипергликемия диагностирована при повышении уровня глюкозы плазмы ≥6,1 ммоль/л.
Всем больным в экстренном порядке выполнена коронароангиография (КАГ) на аппаратах Artis Zee Floor (Siemens, Германия) и Infinix CF-i/SP (Toshiba, Япония) посредством правого или левого трансрадиального или бедренного доступа с использованием контрастного вещества (Ультравист, Оптирей) под местной анестезией 2%-ным лидокаином.
Дизайн исследования – сплошное когортное по мере поступления пациентов в стационар.
Критерии включения: достоверный диагноз «острый коронарный синдром», мужской пол, возраст от 18 до 74 лет, согласие на участие в исследовании, проведенная экстренная КАГ.
Критерии исключения: отказ от участия в исследовании, антифосфолипидный синдром, ранее установленный диагноз «сахарный диабет», женский пол, семейная гиперхолестеринемия, уровень триглицеридов ≥4,5 ммоль/л.
Научно-исследовательская работа выполнена в соответствии с Хельсинской декларацией и одобрена этическим комитетом ФГБОУ ВО ЮУГМУ Минздрава России. От всех обследованных получено информированное согласие на участие в исследовании.
При расчете статистических данных использовалась программа «SPSS 22.0» (IBM, США). При нормальном распределении количественные показатели представлялись в виде средней арифметической и ее средней ошибки (M±m), при отличном от нормального – в виде медианы и интерквартильного размаха (Me [25–75%]). Качественные переменные описывались абсолютным количеством больных (n) и их процентными долями (%). Межгрупповые различия по количественным показателям оценивались с применением U-критерия Манна–Уитни, по качественным признакам – Хи-квадрата Пирсона (при частоте признака менее 5 использовался метод Фишера). Статистические взаимосвязи определены непараметрическим корреляционным анализом по Спирмену. Рассчитывались отношение шанса (ОШ) и его 95%-ный доверительный интервал (ДИ). Достоверными считались различия при р≤0,05.
Результаты исследования и их обсуждение. В когорте мужчин с ОКС чаще всего встречалось недостаточное употребление в пищу овощей и/или фруктов (n=80). Около 80% больных имели АГ (n=81) и нарушения липидного обмена (НЛО) (n=78). Две трети больных курили (n=68) или имели АО (n=59). У 30% больных была отмечена гиподинамия (n=28). У 15% (n=15) определялось снижение СКФ <60 мл/мин/1,73 м2, в 10% случаев − гипергликемия натощак (n=10) и злоупотребление алкоголем (n=10) (рис. 1).
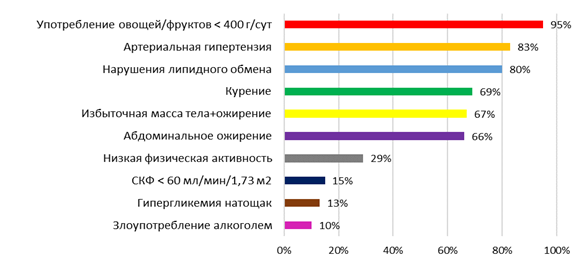
Рис. 1. Частота встречаемости ФР ХНИЗ у мужчин с ОКС
При анализе частоты встречаемости сочетаний биологических и поведенческих ФР ХНИЗ установлено, что реже всего имело место сочетание двух факторов риска, несколько чаще – трех факторов риска. Почти три четверти больных имели сочетание четырех и более ФР (рис. 2).
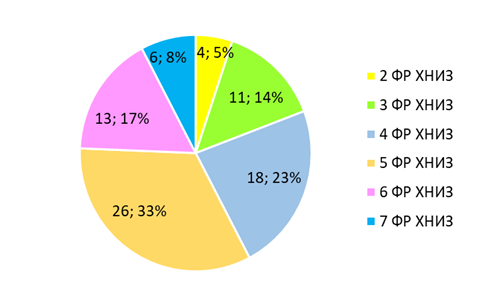
Рис. 2. Структура сочетаний биологических и поведенческих ФР ХНИЗ при ОКС у мужчин на основании числа ФР
При анализе сочетаний более шести биологических и поведенческих ФР ХНИЗ продемонстрировано, что сниженное употребление овощей/фруктов, НЛО, АО и АГ встречалось в 100% случаев (рис. 3).
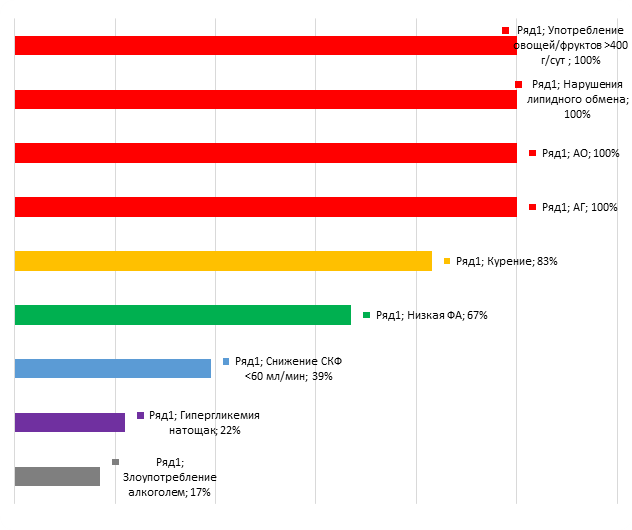
Рис. 3. Частота встречаемости ФР при сочетании 6 и более биологических и поведенческих ФР ХНИЗ у мужчин с ОКС
Сопоставление поведенческих и биологических ФР ХНИЗ выявило ряд ассоциаций.
При употреблении алкоголя 1 раз в неделю и чаще уровни ХС-ЛПОНП (0,8 [0,6–1,0] ммоль/л), ТГ (1,9 [1,4–2,3] ммоль/л) были выше, а диастолическое артериальное давление (90 [80–100] мм рт. ст.) – ниже, чем при приеме алкоголя реже 1 раза в неделю (0,6 [0,5–0,8] ммоль/л; р=0,008; 1,4 [1,1–1,7] ммоль/л; р=0,008 и 100 [90–100] мм рт. ст.; р=0,031 соответственно). При приеме алкогольсодержащих напитков ≥1 раза в неделю гипертриглицеридемия была диагностирована чаще (n=16; 59%), чем при приеме алкоголя <1 раза в неделю (n=18; 25%; р=0,002); (ОШ=4,0 ДИ 95% [1,6–10,3]).
У мужчин, употреблявших алкогольные напитки, независимо от их количества (n=80; 82%) факт повышения ОХС установлен чаще (n=52; 66%), а средний уровень ОХС (5,4 [4,5–5,5] ммоль/л) имел тенденцию к более высокому значению, чем у пациентов, не употреблявших алкоголь (n=7; 39%; р=0,035 и 4,8 [4,0–5,5] ммоль/л; р=0,072). У пациентов, употреблявших алкоголь, шанс наличия гиперхолестеринемии возрастал в 3 раза (ОШ=3,0 ДИ 95% [1,0–8,7]) по сравнению с лицами, не употреблявшими алкогольсодержащие напитки.
При анализе такого ФР, как курение, выявлено, что у курящих мужчин содержание ХС-ЛПВП было ниже (1,2 [1,0–1,3] ммоль/л), чем у некурящих пациентов (1,3 [1,1–1,5] ммоль/л; р=0,032). Лица, курившие в прошлом, имели более низкие показатели СКФ (63,2 [53,6–72,0] мл/мин/1,73 м2), чем никогда не курившие пациенты (69,7 [59,0–97,7] мл/мин/1,73 м2; р=0,050). Также обнаружена обратная корреляционная взаимосвязь между стажем курения и СКФ (rs=–0,262; р=0,010).
Пациенты с гиподинамией имели больший стаж курения (480 [300–574] месяцев), чем лица с нормальной физической активностью (360 [240–480] месяцев); р=0,041. У лиц с НФА чаще было диагностировано общее ожирение (n=10; 36%), чем у пациентов без гиподинамии (n=12; 17%; р=0,047).
У лиц, употребляющих в пищу овощей/фруктов < 400 г/сут., ОТ была больше (103,5 [93–111] см), чем у мужчин, которые употребляли овощи/фрукты в достаточном количестве (84,5 [76,5–100] см); р=0,026.
При анализе взаимосвязи биологических ФР ХНИЗ выявлено, что при СКФ <60 мл/мин/1,73 м2 ОТ (109 [103–115] см) и АД (САД: 170 [155–190] мм рт. ст. и ДАД: 100 [95–100] мм рт. ст.) имели более высокие показатели, чем при СКФ ≥60 мл/мин/1,73 м2 (99 [90,7–109,2] см; р=0,021; САД: 150 [140–170] мм рт. ст.; р=0,008 и ДАД: 95 [90–100] мм рт. ст.), р=0,042 соответственно. Обращает на себя внимание тот факт, что при СКФ <60 мл/мин/1,73 м2 в 100% случаев установлена АГ.
По данным КАГ в общей массе пациентов почти у каждого второго мужчины диагностированы окклюзия КА (n=43; 44%), у каждого третьего пациента – стеноз ≥75% (n=32; 33%), и каждый пятый имел сужение венечных артерий <75%: стеноз 50–74% (n=13; 13%) или сужение КА <50% (n=10; 10%). У половины обследованных мужчин с ОКС диагностирован один стеноз КА ≥75% (n=47; 62%). Каждый пятый имел два стеноза КА ≥75% (n=17; 22%), каждый десятый пациент – три коронарных стеноза ≥75% (n=9; 12%). Сужения ≥75 % в четырех КА встречались в единичных случаях (n=3; 4%).
При сопоставлении коронароангиографических данных с наличием ФР ХНИЗ установлено, что при НЛО (99 [89–100]%), ХС-ЛПНП >3 ммоль/л (99 [90–100]%), ИА >3 Ед (100 [90–100]%) диагностированы более выраженные стенозы КА по сравнению с лицами без НЛО (70 [45–100]%; р=0,027); ХС-ЛПНП <3 ммоль/л (90 [61–100]%; р=0,057) и ИА <3 Ед (85 [55–100]%; р=0,009). Такая же тенденция прослеживалась у мужчин, употреблявших алкоголь (99 [86–100]%), по сравнению с лицами, не употреблявшими спиртные напитки (87,5 [56,2–100]%); р=0,065.
При НЛО (n=65; 83%), ХС-ЛПНП >3 ммоль/л (n=53; 84%), ИА >3 Ед (n=55; 86%) и употреблении алкоголя (n=65; 81%) частота встречаемости стеноза КА ≥75% была выше, чем отсутствии данных ФР (n=9; 47%; р=0,001; n=19; 59%; р=0,008; n=19; 56%; р=0,002 и n=10; 55%; р=0,020 соответственно). Вероятность сужения КА ≥75% была выше в 5,6 раза при НЛО (ОШ=5,6 ДИ 95% [1,9–16,3]), в 4,5 раза при повышении ИА (ДИ 95% [1,7–12,1]), в 3,5 раза у мужчин, употреблявших алкогольсодержащие напитки (ДИ 95% [1,2–10,3]), в 3,6 раза при повышении ХС-ЛПНП (ДИ 95% [1,4–9,6]).
У мужчин с низкой физической активностью стеноз КА ≥50% встречался в 100% (n=28) случаев (р=0,058). В группе пациентов с ОКС и нормальной физической активностью гемодинамически значимые стенозы диагностированы в 86% случаев (n=60).
При анализе ФР ХНИЗ в зависимости от количества коронарных стенозов ≥75% показано, что стенозы ≥3 КА встречались чаще при СКФ <60 мл/мин/1,73 м2 (n=5; 33%), чем при СКФ ≥60 мл/мин/1,73 м2 (n=7; 8%; р=0,007), а также при повышении ИА ≥3 Ед (n=11; 17%), чем при его референсном значении (n=1; 3%; р=0,054). При этом шанс сужения ≥3 КА на ≥75% у мужчин с СКФ менее 60 мл/мин/1,73 м2 был в 5 раз выше, чем при СКФ ≥60 мл/мин/1,73 м2 (ОШ=5,4 ДИ 95% [1,4–20,4]).
При анализе данных КАГ у пациентов с сочетанием биологических и поведенческих ФР ХНИЗ установлено, что при одновременном наличии пяти и более ФР ХНИЗ частота коронарного стеноза ≥75 % в трех и более крупных КА была достоверно выше (n=9; 19%) у лиц с меньшим числом ФР. Шанс наличия стеноза ≥75 % в трех и более КА у пациентов второй группы был в 9,2 раза выше, чем у больных первой группы (n=1; 2%; р=0,018); (ОШ=9,2; ДИ 95% [1,116–76,473]).
При сочетании шести и более биологических и поведенческих ФР ХНИЗ одномоментный стеноз как правой, так и левой КА диагностирован чаще (n=16; 89%), чем при сочетании ФР ХНИЗ <6 (n=43; 61%; р=0,026). Вероятность одновременного стеноза как правой, так и левой КА при комбинации ФР ХНИЗ ≥6 была в 5,2 раза выше, чем у лиц с меньшим количеством ФР ХНИЗ (ДИ 95% [1,111–24,424]).
Таким образом, у мужчин с ОКС наблюдалась высокая частота встречаемости и сочетания факторов риска, которые были тесно взаимосвязаны и потенцировали влияние друг друга на развитие атеросклероза КА. Так, показано, что пациенты с НЛО, АГ и АО потребляли недостаточное количество овощей/фруктов, курящие имели НФА и НЛО. Употребляющие алкоголь пациенты больше курили и чаще имели такие НЛО, как гиперхолестерин- и гипертриглицеридемия. В то же время именно эти факторы риска и их сочетание ассоциировались с более тяжелым коронарным атеросклерозом.
Заключение. У мужчин с острым коронарным синдромом установлены значимые взаимосвязи между поведенческими и биологическими факторами риска развития хронических неинфекционных заболеваний. Тяжелые стенозы коронарных артерий чаще диагностированы при комбинациях биологических и/или поведенческих факторов риска хронических неинфекционных заболеваний.



