По данным ВОЗ, ежегодно около 11 млн человек нуждаются в медицинской помощи после ожогов, многие из них имеют временное ограничение трудоспособности, в 2018 г. в мире от ожогов умерли более 200 тыс. человек [1; 2]. На долю термической травмы (ТТ) приходится около 80% от всех ожогов. Наиболее частыми причинами ТТ являются горячая жидкость и пламя, у 2/3 больных площадь ожога составляет менее 10% поверхности тела, а преимущественный контингент больных – молодые мужчины, в детском возрасте половые различия отсутствуют [3]. Согласно сведениям ООН, средняя смертность при ТТ в низкоразвитых странах по сравнению с высокоразвитыми в 3 раза выше, особенно у мужчин. При этом ТТ является третьей по частоте причиной смерти детей в возрасте от 5 до 9 лет [4].
Несмотря на значительные достижения в лечении ожогов, применение пересадки кожи, стволовых клеток и др. методов, медленное заживление, присоединение инфекции и образование рубцов, в том числе патологических, составляют ключевые проблемы в комбустиологии, приводящие к удлинению сроков госпитализации, пожизненным физическим дефектам, снижению качества жизни и эмоциональным расстройствам [5]. Электролитный дисбаланс, инфекционные осложнения, сепсис, острое повреждение почек, полиорганная недостаточность и депрессия представляют основные осложнения, развивающиеся в ранние сроки после ТТ [6]. До 70% всех осложнений после ТТ связаны с инфекцией – это, прежде всего, пневмония, инфекции мочевыводящих путей [7]. Кроме указанных, внимание привлекают долгосрочные неблагоприятные последствия ТТ: патологическое рубцевание, изменения метаболизма в виде гиперметаболического и гипервоспалительного ответов, SIRS, риск развития заболеваний сердечно-сосудистой системы (ИБС), заболеваний ЖКТ, опорно-двигательного аппарата (артропатии, дорсопатии и остеопатии, особенно у женщин), нервной системы (повышение частоты возникновения мигрени и эпилепсии, цереброваскулярной патологии), тревоги и депрессии, синдрома хронической усталости, сахарного диабета, злокачественных новообразований (пациенты после ТТ независимо от пола и возраста чаще страдают раком полости рта, гортани, печени, дыхательных путей и пищевода) и др. патологии [8]. К долгосрочным последствиям относят и повышенную восприимчивость к инфекционным заболеваниям спустя несколько месяцев после перенесенной ТТ, в частности бактериальной и вирусной пневмонии, гриппу и другим ОРВИ [9]. По мнению комбустиологов, основными факторами снижения смертности от ТТ выступают детальное понимание патофизиологии ожогов, разработка патогенетически обоснованных методов терапии и нутритивной поддержки [10].
Цель работы – провести критический анализ современных данных литературы, индексированных в базах данных Pubmed, посвященных патофизиологии термической травмы и ее ранних и долговременных осложнений.
Понимание патофизиологии ТТ основано на изучении изменений гомеостаза у больных с ожогами различной степени тяжести и площади поражения, а также при экспериментальном моделировании термических поражений. В качестве основных экспериментальных объектов при моделировании ТТ выбирают крыс, мышей, кроликов или свиней, каждый из них имеет свои преимущества и недостатки. Многие исследователи при моделировании ТТ в качестве экспериментального животного выбирают мышь в связи с экономичным содержанием, эффективным воспроизводством, коротким временем заживления, наличием генетически модифицированных линий с измененными компонентами иммунной системы [11]. Однако использование мышей не позволяет получать достаточный для всестороннего изучения иммунного статуса и других показателей гомеостаза объем крови, имеются различия с человеком в структуре цитокинов и их рецепторов, в нейтрофилах мыши отсутствуют дефенсины, тонкая кожа заживает большей частью за счет сокращения, а не реэпителизации и грануляции, как у людей, обилие волосяных фолликулов со стволовыми клетками ускоряет заживление и практически исключает вероятность формирования патологических рубцов. Продолжительность жизни кожного волоса у мышей составляет 3 недели, что значительно меньше по сравнению с человеком, кроме этого, в коже мышей и свиней при моделировании ТТ не формируются пузыри [12].
Кожа крыс также имеет ряд особенностей по сравнению с человеческой, прежде всего, заслуживают внимания меньшая эластичность и низкая адгезия с подкожными структурами, заживление раны путем сокращения, меньшая подверженность послеожоговой иммуносупрессии и инфекционным осложнениям. Заживление кожи у крыс не зависит от экзогенного поступления витамина С, необходимого для синтеза коллагена, так как в организме крысы синтезируется витамин С за счет наличия L-глюконолактона, превращающего L-глюконогаммалактон в витамин С [13]. Многие исследователи полагают, что крыса как экспериментальный объект при моделировании ТТ вполне приемлема и во многом превосходит мышь, особенно в отношении системных метаболических изменений [14]. Кролик довольно редко применяется для моделирования ТТ, однако это подходящий объект для изучения при ТТ изменений энергетического обмена, мышечной дистрофии, гиперметаболических последствий, особенно нарушений липидного обмена, так как имеет сходство в составе липопротеинов с человеком [15]. Анатомические и физиологические параметры кожи свиньи очень похожи на человеческие: толщина эпидермиса, связь с подкожными элементами, волосы, размер, ориентация и распределение кровеносных сосудов в дерме, эпидермальные ферменты, липидная пленка и др. Все это делает свинью идеальным объектом для изучения ожогов в эксперименте, однако подверженность инфекционным осложнениям, а также стоимость и условия их содержания и воспроизводства являются ограничивающими факторами [16]. В настоящее время широко применяются методы математического моделирования (in silico) изменений гомеостаза при ТТ с использованием мощных компьютеров и соответствующего программного обеспечения, в том числе таким образом изучают при ТТ про- и противоспалительные реакции, гиперметаболизм, перекрестные реакции цитокинов, межклеточную коммуникацию и др. особенности. Важно, что моделирование in silico также позволяет оценивать терапевтические вмешательства при ТТ до их применения на доклиническом этапе [17].
В качестве этиологического фактора при экспериментальном моделировании ТТ используют нагретую воду с температурой от 50 °С и выше, горячий воздух, пламя, нагретый металл, электричество и др. факторы для контакта, как правило, с кожей в области спины [18]. Основным недостатком применения металлического стержня является неоднородность его температуры во время контакта с кожей, модель электрического ожога очень сложна и требует крупных животных. Модель с использованием горячей воды является наиболее частой и рассматривается некоторыми исследователями как стандарт ТТ, кроме того, ожоги от горячих жидкостей – это основная причина ТТ у детей и пожилых людей [19]. По результатам систематического обзора с оценкой 116 исследований, подходы экспериментаторов в отношении времени контакта воды с кожей крайне вариабельны: от 10 до 25 с для воды различной температуры. Контрольные точки исследования при экспериментальной ТТ определяются поставленной задачей: для изучения фазы воспаления и пролиферации – до 14-20 суток, фазы ремоделирования – до 10 недель и дольше [14].
В патогенезе ожогов традиционно выделяют три фазы: воспаления, пролиферации и ремоделирования [12]. В ответ на термическое повреждение в очаге ТТ высвобождаются медиаторы воспаления (гистамин, провоспалительные цитокины и др.) и свободные радикалы (активные формы кислорода (АФК) и азота), которые расширяют зону повреждения, приводят к вазодилатации и отеку, затем в результате хемотаксиса в очаг мигрируют нейтрофилы и моноциты, последние трансформируются в макрофаги, их эффект – фагоцитоз некротических тканей и патогенов, синтез факторов роста. Важно, что в ходе вторичной альтерации первичный очаг ТТ может быть значительно расширен за счет эффектов аутокоидов клеточного и плазменного генеза, АФК, нарушения васкуляризации [20]. Формирование струпа также ограничивает кровоток в очаге ТТ и способствует расширению зоны повреждения. В этом отношении определенный интерес вызывают экспериментальные терапевтические стратегии в ранние сроки ТТ, направленные на блокаду аутокоидов, в частности IFN-γ, однако эти данные противоречивы [21]. Отек формируется в первые 8 ч после ТТ и сохраняется в течение не менее 18 ч. Чрезмерная и длительная воспалительная фаза усиливает боль и ухудшает заживление.
В пролиферативную фазу увеличивается количество резидентных клеток – кератиноцитов, фибробластов, эндотелиоцитов, формируется грануляционная ткань [22]. Фибробласты дифференцируются, в том числе за счет эффектов ИЛ-22, в миофибробласты, участвующие в сокращении кожи при закрытии раневого дефекта, синтезе коллагена преимущественно III типа [23]. Всего в настоящее время в дерме выделяют 12 подгрупп фибробластов. При заживлении раны в регенерации эпидермиса, пролиферации и дифференцировке эпителиальных клеток, и противовирусной защите показана роль ИЛ-27 [24]. Эта фаза заканчивается распадом временного внеклеточного матрикса, снижением количества гиалуроновой кислоты, увеличением – хондроитинсульфата в очаге ТТ [25]. В фазу ремоделирования, которая длится не менее 1 года, разворачиваются события, направленные на восстановление архитектуры поврежденной ткани [26]. Многие клетки погибают путем апоптоза, матриксные металлопротеиназы (ММР), продуцируемые макрофагами, удаляют избыток коллагена, коллаген III типа заменяется на коллаген I типа, его волокна перекрестно связываются для повышения прочности и стабильности.
Морфологически ожоговая рана делится на три зоны в зависимости от разрушения тканей и изменения кровотока (рис. 1): 1) коагуляции (область первичной альтерации, некроз тканей, денатурация и коагуляция белков); 2) ишемии (снижение перфузии, окислительный стресс, обратимые до 24-48 ч изменения, аутофагия в течение первых часов, позднее – апоптоз и некроз); 3) гиперемии (усиленный кровоток обеспечивает восстановление клеток за исключением случаев присоединения инфекции или дополнительных повреждений) [27].
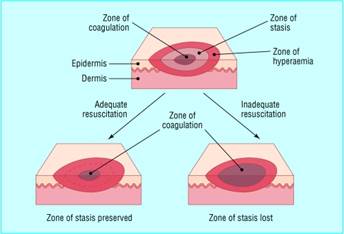
Рис. 1. Области повреждения в ожоговой ране (по [27])
Тучные клетки, в большом количестве присутствующие в коже в норме, одними из первых реагируют на термическое повреждение и рассматриваются как резидентные воспалительные клетки, содержащие в гранулах широкий спектр преформированных медиаторов и синтезирующие их de novo после ТТ. Медиаторы тучных клеток регулируют не только сосудисто-экссудативные реакции, болевые ощущения, но и активируют пролиферацию фибробластов, синтез коллагена, участвуют в ремоделировании рубца и др. процессах (рис. 2), а ингибирование функции мастоцитов при ТТ рассматривается как перспективное направление ограничения избыточного рубцевания [12]. Показана роль симпатических нервов в дегрануляции тучных клеток в ожоговой ране. Дегрануляция тучных клеток и высвобождение гистамина, ТНФ-альфа, IL-1β, IL-6 приводит к артериальной и венозной гиперемии, экссудации, активации фагоцитов, а высвобождение фактора роста кератиноцитов, VEGF активирует фибробласты, синтез коллагена, зачастую избыточный с образованием гипертрофических рубцов. Протеаза-4 из тучных клеток выступает в роли хемоаттрактанта для лейкоцитов в воспалительную фазу раневого процесса [28]. Активация синтеза коллагена в том числе связана с активацией химазы мастоцитов сигнального пути TGF-β1/Smads и пролиферации фибробластов. Серотонин, ключевым источником которого в очаге ТТ являются тучные клетки, снижает апоптоз, повышает выживаемость и миграцию фибробластов и кератиноцитов, участвуя таким образом в регуляции заживления ожоговой раны, а применение блокаторов высвобождения эндогенного серотонина приводит к замедлению эпителизации [29].
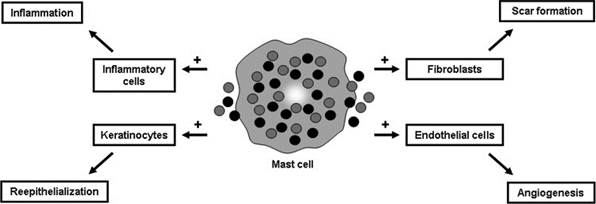
Рис. 2. Функции тучных клеток при заживлении раны (по [30])
Все большее внимание при обсуждении механизма репарации кожных ран и разработке новых эффективных методов регенеративной медицины уделяется микроРНК [31]. Так, miR-21, miR-29, miR-210, miR-155, miR-31 и др. экспрессируемые в кератиноцитах и фибробластах и др. клетках, участвуют в регуляции заживления раны [32]. miR-155 регулирует IL-17/IL-9 – зависимые воспалительные реакции, и ускоряет миграцию кератиноцитов в очаге повреждения в связи с повышением уровня ММР-2.
Значительную роль в заживлении ожоговой раны отводят HIF-1-альфа, индуктором синтеза которого выступает гипоксия, он активирует ангиогенез и пролиферацию клеток, в том числе через повышение синтеза эритропоэтина, а снижение его уровня в очаге ухудшает репаративные реакции [33]. Ранее нами успешно продемонстрировано влияние эритропоэтина после системного введения и локального применения в составе оригинальной трансдермальной пленки на выраженность воспалительного процесса, редокс-статус и репаративные реакции при экспериментальной ТТ у крыс. Репаративные реакции в ожоговой ране зависят от сенсорной и симпатической иннервации. В эксперименте на животных показано, что сенсорная денервация приводит к задержке заживления раны, в том числе в связи со снижением уровня ИЛ-6, а симпатическая денервация, напротив, ускоряет заживление.
Показано влияние половых гормонов на течение и исход ТТ. У женщин вероятность развития инфекционных осложнений, сепсиса, мультиорганной недостаточности, а также показатели летальности значимо ниже, чем у мужчин [34]. Это обусловлено наличием рецепторов для тестостерона и эстрогена на клетках миелоидных и лимфоидных костного мозга, селезенки, тимуса, зрелых нейтрофилах, лимфоцитах, моноцитах/макрофагах, мастоцитах [35]. В эксперименте показаны противоспалительные и иммуносупрессивные эффекты тестостерона: повышение синтеза ИЛ-10, снижение – провоспалительных цитокинов, активности NK-клеток, снижение экспрессии на фагоцитах TLR4. Эстрадиол, напротив, усиливает клеточный и гуморальный иммунный ответ: активность NK-клеток, синтез IL-1β, IL-6 и TNF-α, ингибирует продукцию IL-10, снижает апоптоз иммунных клеток [36].
Любое повреждение кожи, в том числе ТТ, вызывает изменение поверхностного отрицательного заряда клеток кожи, создавая градиент напряжения между областью повреждения и окружающими тканями, что имеет значение для активации молекул межклеточного взаимодействия интегринов, рецепторов ЭпФР и др. сигнальных молекул, миграции клеток по механизму гальванотаксиса, включая эпителиоциты, фибробласты, лимфоциты, макрофаги, эндотелиоциты и др., что имеет решающее значение для эффективного заживления ран. Указанные факты явились предпосылкой для разработки биоэлектрических пластырей, применения локальной электротерапии, которые показали свою эффективность при повреждении кожи у животных [37].
Скорость заживления ожоговой раны зависит от площади и глубины повреждения, инфильтрации очага нейтрофилами (при тяжелых ожогах она начинается позднее и сохраняется дольше), уровня провоспалительных цитокинов в крови (при тяжелых ожогах выше и устойчивее), своевременной активации клеток Лангерганса, дермальных дендритных клеток и др. факторов [38]. Полагают, что интенсивность и длительность воспалительной фазы является ключевым фактором формирования осложнений в виде инфицирования, системного воспаления и сепсиса, гипертрофических и келлоидных рубцов.
Неблагоприятный исход и формирование осложнений при ТТ определяются выраженностью не только воспалительного, острофазового ответа и иммунных реакций, но и активацией метаболизма в целом, а некоторые биомаркеры могут использоваться в качестве предикторов прогнозирования летальности, в частности сывороточные уровни IL-6, IL-8, Г-КСФ, МСР-1, С-РБ, глюкозы, инсулина, мочевины, креатинина, билирубина [39]. Скорость метаболизма при ТТ возрастает в три раза, а сердечный выброс – в 1,5 раза по сравнению с здоровыми людьми. Синдром гиперметаболизма приводит к потере мышечной массы и плотности костей, повышенный катаболизм белка и потеря аминокислот сохраняются до 1 года, а мышечная слабость – до 5 лет после ТТ [40]. Кроме этого, формируется резистентность к инсулину и гипергликемия, а также усиление липолиза. Изменение метаболизма белой жировой ткани после ТТ, одним из механизмов которого выступает активация NLRP3-зависимых путей, способствует развитию стеатоза печени и печеночной недостаточности [39]. В целом гиперметаболизм рассматривается как фактор ухудшения репарации при ТТ, повышения вероятности инфекционных осложнений, а достижения метабономики должны использоваться при разработке терапевтических стратегий при ТТ [41].
Ключевым механизмом поражения сердца при ТТ выступает дисфункция митохондрий, их деструкция в результате окислительного стресса, накопление цитохрома С в цитоплазме кардиомиоцитов наблюдается уже в первые 24 ч после ожога [42]. Гиперкатехоламинемия при ТТ приводит к увеличению ЧСС и усугубляет гипоксию миокарда, повышается чувствительность ГМК сосудов к вазоконстрикторному действию вазопрессина [43]. Ингибитор миграции макрофагов (MIF) при ТТ оказывает прямое кардиодеструктивное действие, а применение анти-MIF в эксперименте восстанавливает сердечную функцию при ТТ в течение 24 ч [44].
Острое поражение почек при ТТ возникает с частотой от 1 до 30%, связано с ранней полиорганной дисфункцией или осложнением сепсиса и сопряжено с высоким риском смерти [42]. Поражение почек при ТТ в ходе сепсиса обусловлено генерализованной вазодилатацией и гиперкоагуляцией. К органам ЖКТ после ТТ приток крови редуцируется на 60% как минимум на 4 часа, что приводит к формированию синдрома интраабдоминальной гипертензии и синдрома абдоминального компартмента у ожоговых больных [44]. У больных после ТТ выявляют признаки гепатоцитолиза и печеночной недостаточности [45].
В патогенезе патологического рубцевания после ТТ, кроме глубины и площади повреждения, кровоснабжения кожи в области ТТ, эффектов половых и др. гормонов, генетических особенностей механобиологии дермы и др. факторов, имеет значение эндотелиальная дисфункция, приводящая к гиперпроницаемости сосудов в воспалительную фазу ожога, пролонгации эмиграции лейкоцитов в очаг повреждения, дисфункции фибробластов. Более того, гипертрофические и келлоидные рубцы рассматривают в контексте единого фибропролиферативного нарушения кожи, которые отличаются только степенью эндотелиальной дисфункции. Ряд исследователей полагают, что патологическое рубцевание является следствием хронического воспаления в дерме с избыточной экспрессией IL-1α, IL-1β, IL-6, ТНФ-альфа и др. провоспалительных цитокинов, увеличением количества воспалительных клеток, фибробластов, новообразованных сосудов и коллагена, снижением активности коллагеназы, высоким уровнем TGF-β и его рецептора [46].
Инфекционные осложнения после ТТ связаны с колонизацией раневой поверхности микроорганизмами, в том числе лекарственно устойчивыми формами. Устойчивость микробов к факторам иммунобиологического надзора и антимикробным лекарственным средствам зачастую обусловлена формированием биопленок [47]. Наиболее частыми инфекционными агентами, выделяемыми из ожоговых ран, являются Klebsiella pneumoniae, Acinetobacter baumanii, Pseudomonas aeruginosa и S. aureus, биопленкообразование и повышенная резистентность этих возбудителей может приводить к бактериемии и сепсису, септическому шоку, полиорганной недостаточности и смерти [48]. Многие исследователи связывают формирование инфекционных осложнений, включая сепсис, после ТТ с избыточными иммуносупрессивными реакциями, в том числе как компенсацию на длительный, устойчивый провоспалительный ответ. В частности, обусловленными гиперпродукцией и эффектами IL-10, IL-4, TGF-β и PDGF. В последнее время внимание исследователей инфекционных осложнений после ТТ привлекает функциональная гетерогенность нейтрофилов крови и очага ожоговой раны: зрелые сегментоядерные нейтрофилы (CD16 bright / CD62L bright), незрелые нейтрофилы (CD16 dim / CD62L bright), гиперсегментированные нейтрофилы (CD16 bright / CD62L dim), клетки-супрессоры миелоидного происхождения (MDSCs) [49].
Глубокая ТТ может приводить к повреждению нервов, разрушению дистальных аксонов (дегенерация Валлера) и формированию ростового конуса на поврежденном нерве, как правило, под влиянием факторов роста, продуцируемых иммунными клетками [12]. Такие изменения нервов сопровождаются частичной или полной потерей сенсорных или моторных функций, появлением парестезии и боли. Кроме этого, ряд медиаторов воспаления в очаге ТТ сами связаны с болью (брадикинин) или снижают механический порог С-ноцицепторов (ТНФ-альфа).
Динамика изменений количества и функциональной активности клеток и гуморальных факторов в очаге ТТ определяет уже через 4 ч формирование провоспалительных реакций, при максимальной выраженности – синдрома системного воспалительного ответа (SIRS) и одновременно компенсаторного противовоспалительного ответа (CARS), которые сохраняются до 90 суток после ТТ и отражают активность реакций врожденного и адаптивного иммунитета, дизрегуляцию иммунного ответа; их клинические последствия отражены на рис. 3.
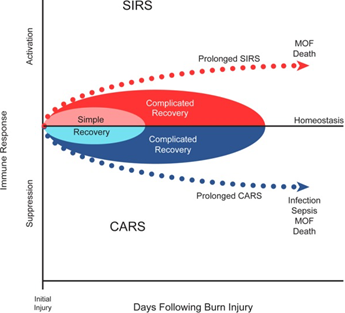
Рис. 3. SIRS и CARS как отражение изменений иммунного ответа после ТТ и их клинические последствия (по [50])
Выводы
1. ТТ - актуальная медико-социальная проблема в связи с высокой распространенностью, полным или временным ограничением трудоспособности, ранними и поздними осложнениями и недостаточной эффективностью используемых терапевтических подходов.
2. Для изучения патогенеза изменений гомеостаза при ТТ используют данные клинического наблюдения за больными с ожогами различной степени тяжести и площади поражения и методы моделирования in silico и in vivo (с использованием мышей, крыс, кроликов, свиней) с разными повреждающими агентами и временем экспозиции.
3. Чрезмерная и длительная воспалительная фаза ТТ расширяет область альтерации, удлиняет время болевого синдрома и ухудшает репарацию, повышает вероятность инфекционных осложнений и патологического рубцевания, в связи с чем перспективным может быть применение блокаторов аутокоидов и антиоксидантов. Ключевыми участниками фазы пролиферации и фазы ремоделирования являются макрофаги, кератиноциты, фибробласты, эндотелиоциты, функция которых направлена на восстановление поврежденных тканей, повышение прочности и стабильности ожогового рубца. На всех этапах раневого процесса при ТТ продемонстрирована регуляторная роль тучных клеток, микроРНК, эритропоэтина, половых гормонов, поверхностного заряда клеток кожи и др. факторов.
4. Синдром гиперметаболизма при ТТ связан с потерей мышечной массы, остеопенией, резистентностью к инсулину, гипергликемией, печеночной недостаточностью. Дисфункция митохондрий и симпатикотония при ТТ приводят к нарушению сердечной деятельности, а генерализованная вазодилатация и гиперкоагуляция – к почечной недостаточности. Патологическое рубцевание при ТТ связывают с масштабами повреждения и особенностями кровоснабжения, механобиологии кожи, наличием эндотелиальной дисфункции и цитокиновой дизрегуляции. Патогенез инфекционных осложнений при ТТ включает особенности иммунного статуса организма, включая избыточные иммуносупрессивные реакции, нарушение субпопуляционного состава нейтрофилов, а также микрофлоры кожи, в том числе лекарственно устойчивыми микроорганизмами, способными к образованию биопленок. Эскалация провоспалительных реакций при ТТ сопряжена с формированием SIRS (синдром системного воспалительного ответа) и полиорганной недостаточности, а противовоспалительных – с CARS (синдром компенсаторного противовоспалительного ответа) и сепсисом.



