Современная онкология достигла значительных успехов в лечении колоректального рака [1–3], а лучевая терапия давно входит в состав комбинированного лечения рака прямой кишки [4, 5]. Многие исследования доказывают важную роль предоперационной лучевой терапии в комплексном лечении рака прямой кишки. Так, в США с 2004 по 2011 гг. доля больных, получивших неоадъювантную лучевую терапию, повысилась с 57% до 75%, а доля больных, получивших послеоперационную лучевую терапию, наоборот, снизилась с 39% до 18% [6, 7]. Такие же тенденции отмечены в странах Европы и в России.
По данным авторов, применение предоперационной лучевой терапии приводит к снижению в 2 раза 5-летней частоты безрецидивной выживаемости при раке прямой кишки – с 10,9% до 5,6% [8–10]. В последнее время установлено, что основным прогностическим признаком эффективности лучевой терапии при злокачественных опухолях является степень регресса опухоли. Так, 3-летняя безрецидивная выживаемость при Dworak 4 составляет 95%, при Dworak 3 – 82%, при Dworak 2 – 64%, а при Dworak 1 – лишь 53% [11]. Достижения фундаментальной онкологии последних лет позволяют оценить степень регресса опухоли как на тканевом и клеточном уровнях, так и на молекулярном.
Цель исследования: выявление молекулярно-морфологических эффектов периоперационной лучевой терапии при раке прямой кишки.
Материал и методы исследования. Нами были проанализированы данные о 45 пациентах с раком прямой кишки T3-4N0-1M0, которым было проведено лечение в условиях клиники ФГБУ «Национальный медицинский исследовательский центр онкологии» МЗ РФ. У всех больных опухоль характеризовалась как аденокарцинома (чаще встречалась умеренно дифференцированная (75%)). В основную группу вошли 20 пациентов, которым был проведен курс неоадъювантной лучевой терапии на опухоль, а также на пути метастазирования (19 сеансов 5 раз в неделю с разовой очаговой дозой 2,4 Гр до суммарной очаговой дозы 50 изоГр). В дни проведения терапии осуществлялась радиомодификация капецитабином 1600 мг2/сутки. Спустя 7–8 недель после лучевой терапии проводилось хирургическое лечение. Контрольная группа – 25 больных, которые имели противопоказания к лучевой терапии на первом этапе, а также отказались от лечения. Послеоперационный материал опухоли отправлялся на патоморфологическое исследование. Степень лечебного патоморфоза опухоли определялась по Г.А. Лавниковой. Для анализа ДНК в ткани использовали CycleTESTTMPLUS DNA ReagentKit (кат. № 340242, BectonDickinson). Полученные данные были статистически обработаны с помощью программы ModFit LT. Данная программа позволяет анализировать плоидность и распределение клеток опухоли по фазам клеточного цикла. Также вычислялся процент клеток с различным содержанием ДНК. Индекс пролиферации (ИП) мы определяли как суммарное число клеток опухоли, находящихся в S- и (G2+М)-фазах клеточного цикла. При обработке данных использовался t-критерий Стьюдента.
Результаты исследования и их обсуждение. Результаты морфологического исследования показали, что изменения в опухолях после лучевой терапии характеризовались развитием деструктивных очагов. В основной группе площадь некроза составила 36,4±4,2%, а признаки необратимых форм дистрофии варьировались от 24% до 68%. В нашем исследовании не был выявлен лечебный патоморфоз I и IV степени, II степени определялся у 25% больных, III степени – у 70% пациентов. Он проявлялся отсутствием опухолевых клеток, выраженным фиброзом и гиалинозом соединительной ткани, наличием очаговых кальцинатов и гигантских многоядерных клеток типа инородных тел. Посредством использования проточной цитометрии были изучены количество ДНК в опухолевых клетках, а также их распределение по фазам клеточного цикла и пролиферативная активность опухолевой ткани под влиянием курса неоадъювантной лучевой терапии. На сегодняшний день доказано, что содержание ДНК в нормальной клетке непостоянно. Известным является и то, что опухоль гетерогенна. Рост опухоли обеспечивается активно пролиферирующей фракцией клеток. Менее чувствительны к радиационному действию клетки в фазе синтеза (S) и пресинтетической фазе (G1), а наиболее чувствительны – в фазе митоза (М) и премитоза (G2).
Действие препаратов различно: так, многие алкилирующие препараты действуют на клетки в синтетической фазе, фазе премитоза, цитостатики растительного происхождения – в фазе митоза, ингибиторы синтеза белка – в пресинтетической фазе и фазе премитоза, а действие препаратов группы антиметаболитов отмечается в синтетической и пресинтетической фазах. Изучение ДНК-цитометрических параметров ректальных опухолей под влиянием лучевой терапии выявило преобладание анеуплоидных опухолей, доля которых составила 60%, а диплоидных – 40%. Доля опухолей с индексом ДНК свыше 1,5 составила 16,7%. В контрольной группе доля анеуплоидных опухолей составила 64%. Большинство опухолей гетерогенны, т.е. они содержат как анеуплоидные, так и диплоидные клетки. Основным фактором, определяющим биологическое поведение опухоли, является характеристика среднего содержания анеуплоидных клеток в опухоли. Проведя анализ, мы не выявили достоверных различий в содержании анеуплоидных клеток в опухоли (51,9±4,7% и 51,4±5,3% соответственно). Анеуплоидия не только связана с изменением содержания ДНК в клетках, но и сопряжена с изменением в геноме. Для ее характеристики используется индекс ДНК, который характеризуется отношением интенсивности флуоресценции пика анеуплоидных клеток к диплоидному. Результаты анализа индекса в группах показали, что опухолей с индексом ДНК менее 1,0 не встречались, он находился в диапазоне от 1,1 до 1,9.
Средний показатель в контрольной группе составил 1,5±0,08, а в основной – 1,2±0,07. Также в основной группе опухоли с индексом больше 1,5 определялись лишь в 16,7% случаев (р<0,05).
В таблице 1 отражено распределение опухолевых клеток в зависимости от фаз клеточного цикла. Мы установили, что в основной группе значительная масса опухолевых клеток находилась в G0/1-фазе клеточного цикла – 86,2±3,7%, в G2+M-фазе – 2,7±0,6%. Скорость пролиферации клеток составила 11,2±3,2%, в то время как пролиферативная активность – 13,5±3,2%. В контрольной группе наблюдалось примерно такое же распределение: наибольшая доля клеток находилась в G0/1-фазе – 87,96±2,18%, в S-фазе – 9,98±1,6%, а доля клеток в G2+M-фазе – 2,12±0,4%.
Таблица 1
Распределение клеток по фазам клеточного цикла (%)
|
Группы |
G0/G1-фаза |
G2+M |
S-фаза |
|
Основная группа |
86,2±3,7 |
2,7±0,6 |
11,2±3,2 |
|
Контрольная группа |
87,96±2,18 |
2,12±0,4 |
9,98±1,6 |
Анализ пролиферативной активности показал практически одинаковое значение индекса в обеих группах больных: 13,5±3,2% и 12,1±1,4% соответственно. Нами также был проведен анализ соотношения клеток диплоидных и анеуплоидных опухолей, результат которого представлен в таблице 2.
Таблица 2
Соотношение клеток по фазам клеточного цикла диплоидных и анеуплоидных опухолей толстой кишки (%)
|
Тип опухоли |
G0/G1-фаза |
G2+M-фаза |
S-фаза |
Индекс пролиферации |
|
Диплоидные |
86,3±4,3 |
0,11±0,008 ↓* |
13,7±4,3 |
14,4±3,4 |
|
Анеуплоидные |
86,2±5 |
3,5±0,9 |
10,4±2,1 |
13,9±3,4 |
Примечания: * – отличия показателей достоверны по отношению к анеуплоидным опухолям (p≤0,05).
При диплоидных и анеуплоидных опухолях прямой кишки определяется преобладание клеток, которые находятся в G0/1-фазе клеточного цикла. В ходе работы нами выявлены достоверно значимые отличия диплоидных опухолей от анеуплоидных (p≤0,05): в 32 раза ниже доля клеток в М-фазе и в G2-фазе при диплоидных опухолях.
Скорость пролиферации диплоидных опухолей превышала подобный показатель анеуплоидных.
Индекс пролиферации (как диплоидных, так и анеуплоидных опухолей) был на равном уровне.
На рисунках 1–4 представлены гистограммы соотношения опухолевых клеток в исследуемых группах.
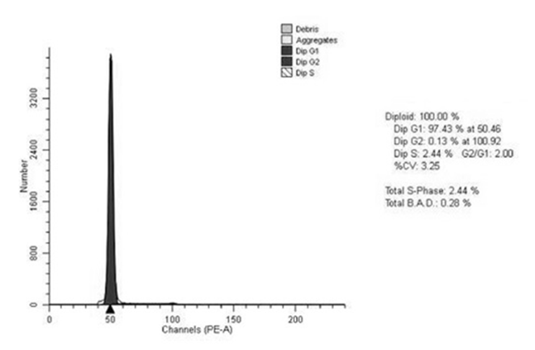
Рис. 1. Гистограмма распределения клеток по фазам клеточного цикла диплоидной опухоли прямой кишки основной группы. Больная М., 62 года, гистологически – G2 аденокарцинома
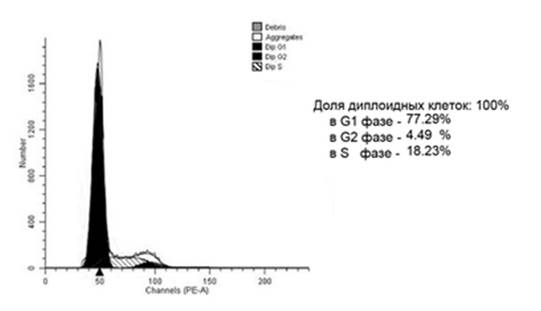
Рис. 2. Гистограмма распределения клеток по фазам клеточного цикла диплоидной опухоли прямой кишки контрольной группы. Больной М., 61 года, гистологически – G2 аденокарцинома
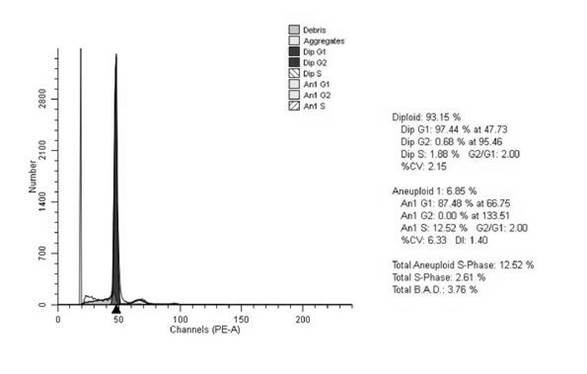
Рис. 3. Гистограмма распределения клеток анеуплоидной опухоли прямой кишки основной группы по фазам клеточного цикла. Больной К., 55 лет, гистологически – G2 аденокарцинома
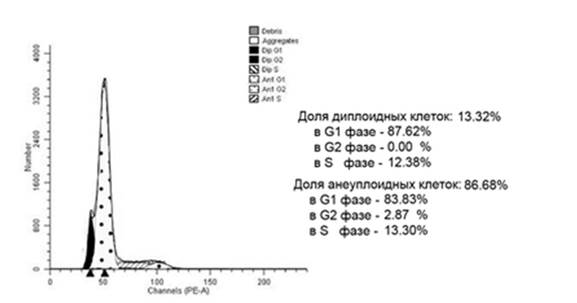
Рис. 4. Гистограмма распределения клеток анеуплоидной опухоли прямой кишки контрольной группы по фазам клеточного цикла. Больная Ш., 47 лет, гистологически – G2 аденокарцинома
Исходя из того фактора, что основной целью проведения предоперационной лучевой терапии при колоректальном раке является в первую очередь уменьшение размеров первичной опухоли, нами также была осуществлена и оценка клинической эффективности проводимой лучевой терапии (табл. 3).
Было выявлено, что в группе больных, которым проводилась пролонгированная лучевая терапия, опухоль уменьшилась с 6,8±0,6 см до 4,5±0,5 см (р<0,05), а расстояние от ануса до нижнего края опухоли увеличилось с 6,3±0,6 см до 7,6±0,6 см (р<0,05).
Таблица 3
Характеристика опухоли прямой кишки после курса лучевой терапии
|
Характеристики опухоли |
Основная группа |
Контрольная группа |
|
Протяженность опухоли: до после |
6,8±0,6 см 4,5±0,5 см* |
6,0±0,9 см |
|
Расстояние от ануса до опухоли: до после |
6,3±0,6 см 7,6±0,6 см* |
7,8±0,8 см |
Примечание: * – различия в группе достоверны (р<0,05).
Итак, нами выявлен клинико-морфологический эффект проведения предоперационной пролонгированной лучевой терапии при раке прямой кишки. Так, клиническая эффективность терапии проявлялась уменьшением протяженности опухоли прямой кишки в 1,5 раза и увеличением расстояния от ануса до нижнего края опухоли в 1,2 раза (р<0,05). Морфологически эти данные были подтверждены развитием лечебного патоморфоза III степени у 70% больных. Исследование на более тонком, молекулярном уровне выявило значительные изменения содержания ДНК в клетках опухоли прямой кишки под влиянием лучевой терапии: преобладание в 1,5 раза опухолей с индексом ДНК до 1,5 и снижение в 2,6 раза опухолей с индексом ДНК свыше 1,5 в основной группе больных. Также достоверно выявлено снижение индекса ДНК с 1,5±0,08 в контрольной группе до 1,2±0,07 в основной группе (p≤0,05). Достоверно значимых различий по доле клеток в различных фазах клеточного цикла в опухолях основной и контрольной групп нами выявлено не было. Тем не менее проведение лучевой терапии привело к достоверно значимым отличиям диплоидных опухолей от анеуплоидных по доле клеток в фазе митоза (М) и премитотической (G2) клеточного цикла, которых при диплоидных опухолях выявлено в 32 раза меньше, чем при анеуплоидных (p≤0,05). Проведение предоперационной лучевой терапии при раке прямой кишки в основной группе больных не выявило достоверно значимых отличий по доле анеуплоидных опухолей и среднему содержанию анеуплоидных клеток в опухоли в сравнении с контрольной группой. Для анеуплоидных опухолей основной и контрольной групп характерным оказалось отсутствие опухолей с индексом ДНК до 1,0. Полученные нами данные свидетельствуют о том, что через 6–8 недель после проведения пролонгированной лучевой терапии наблюдается выраженный клинико-морфологический эффект, а изменения на молекулярном уровне в этот срок по многим параметрам уже соответствуют необлученной опухоли. Следовательно, превышение периода между окончанием курса лучевой терапии и оперативным вмешательством может привести к возобновлению роста опухоли и нивелированию эффекта неоадъювантной терапии. Этот факт следует учитывать при планировании комбинированного лечения у больных раком прямой кишки.
Выводы
1. Снижение потенциала злокачественности рака прямой кишки стало главным молекулярно-морфологическим эффектом периоперационной лучевой терапии. Он проявился в лечебном патоморфозе III степени (70%), а также в увеличении частоты опухолей с индексом ДНК до 1,5 в 1,5 раза.
2. Клиническая эффективность предоперационной лучевой терапии проявлялась в уменьшении протяженности опухоли прямой кишки в 1,5 раза, а также в увеличении расстояния от ануса до нижнего края опухоли в 1,2 раза (р<0,05).



