Сахарный диабет (СД) 2-го типа является одной из крупнейших мировых эпидемий. В 2015 г. во всем мире около 420 млн человек страдали СД 2-го типа. Согласно прогнозам к 2040 г. их число увеличится до 640 млн [1, 2].
Хорошо известно, что повышенный риск сердечно-сосудистых заболеваний имеют пациенты с СД 2-го типа. Их пораженность ишемическими инсультами в 2,5–3,5 раза выше по сравнению с пациентами, не страдающими сахарным диабетом [3]. При изучении популяции больных с каротидных стенозом пациенты с СД 2-го типа встречаются в 45% случаев. За развитие атеросклероза ответственны множественные патофизиологические механизмы, способствующие воспалению сосудов и тромбозу. Вопрос, с чем связаны стремительный атерогенез и более тяжелое течение заболевания при сахарном диабете, широко обсуждается в научных кругах [4–6]. Риск развития атеросклероза у больных СД соотносят с нарушением липидного обмена, с прямым действием инсулина на стенку артерий, с изменениями в системе гемостаза и гемореологии. Пациенты с СД 2-го типа особенно подвержены воспалительным процессам, которые играют решающую роль в нестабильности бляшки [7]. Развитие нестабильных «взрывающихся» атеросклеротических бляшек указывают как одну из особенностей атеросклероза при сахарном диабете [8]. Интересен факт, что ремоделирование сонных артерий у пациентов с СД 2-го типа и у пациентов с СД 2-го типа и метаболическим синдромом происходит одинаково и не имеет морфологических отличий [9].
Установлено, что повышение жесткости стенки сонной артерии у больных СД 2-го типа связано с утолщением комплекса интима-медиа, что ускоряет процесс возникновения нестабильной атеросклеротической бляшки [10]. Помимо прочего, немаловажную роль играет наличие у пациентов с СД 2-го типа артериальной гипертензии [11], которая приводит к нарушению реологии крови и гемодинамики кровоснабжения головного мозга. Известен факт, что у больных СД 2-го типа на фоне артериальной гипертензии отмечаются повышение скорости кровотока в диастолу и снижение индекса пульсации, индекса цереброваскулярной реактивности, что связано с морфологическими изменениями в стенке сонной артерии и приводит к значительному снижению адаптационно-компенсаторных возможностей артерий головного мозга. Помимо утолщения комплекса интима-медиа, наблюдаются атрофия эластическо-мышечного каркаса среднего слоя сонной артерии и замещение специализированных элементов коллагеновыми волокнами, что влияет на демпфирующую функцию артерий и повышает количество осложнений [12]. Ключевыми факторами в ускоренном развитии атеросклероза внутренних сонных артерий считают употребление никотина, неконтролируемую гипергликемию, что приводит к повышению показателей маркеров воспаления, таких как С-реактивный белок и металлопротеиназа-9 [13]. Исходя из этого понятной становится неэффективность только коррекции гликемического профиля на жесткость артерии и скорость образования атеросклеротической бляшки [14], поэтому терапия данной категории пациентов должна включать не только гипотензивные, антиангинальные и липидоснижающие препараты, но и обязательно ингибиторы дипептидилпептидазы-4 [15].
Цель исследования: обосновать роль сахарного диабета как лидирующего фактора в развитии атеросклероза брахиоцефальных сосудов у больных сахарным диабетом 2-го типа по сравнению с пациентами, не страдающими диабетом.
Материал и методы исследования. В основу работы положен анализ результатов обследования и лечения 149 больных, которые находились на лечении в отделении сосудистой хирургии отдела неотложной и восстановительной сосудистой хирургии ИНВХ им. В.К. Гусака в период с 2008 по 2013 гг. У всех пациентов имелось мультифокальное поражение сосудов атеросклерозом, т.е., помимо поражения брахиоцефальных сосудов, были клинические признаки, подтвержденные инструментально, патологии сосудов нижних конечностей и сердца. Всем пациентам были выполнены операции на сонных артериях по поводу их атеросклеротического поражения. Пациенты были разделены на две группы. В группу сравнения вошел 51 пациент с сахарным диабетом. В качестве контроля была сформирована группа из 98 пациентов без сахарного диабета.
Обследование больных включало физикальное, общеклиническое исследования, ультразвуковое триплексное сканирование для определения морфологии бляшек и степени стеноза, СКТ головного мозга или магнитно-резонансную томографию мозга.
В ходе триплексного сканирования проводилась оценка:
· спектральных и линейных характеристик кровотока в зоне стеноза и в постстенотических отделах;
· свойств атеросклеротической бляшки, ее эмболоопасности (определялись форма бляшки, ее структура, характер поверхности);
· протяженности поражения (и выявление тандемных стенозов в сонной артерии);
· наличия у больного извитости, ее гемодинамической значимости.
В работе нами использовалась классификация, разработанная C.M. Stefen и соавторами (1989) и дополненная G. Geroulakos и соавторами (1993) [5], для характеристики состояния атеросклеротических бляшек:
· I тип (гомогенные) – полностью гипоэхогенная бляшка с тонкой эхогенной покрышкой;
· II тип (гетерогенная) – преимущественно гипоэхогенная бляшка с наличием гиперэхогенных зон;
· III тип (гетерогенная) – преимущественно гиперэхогенная бляшка с наличием гипоэхогенных зон;
· IV тип (гомогенная) – полностью гиперэхогенная бляшка;
· V тип – бляшка, не поддающаяся идентификации из-за выраженного кальциноза, вызывающего акустическую тень.
По распространенности бляшки подразделялись на локальные (протяженностью 1–1,5 см) и пролонгированные (более 1,5 см); по локализации – локальные (занимают одну стенку сосуда), эксцентрические и концентрические; по форме поверхности – гладкие и с неровной поверхностью (рис. 1).
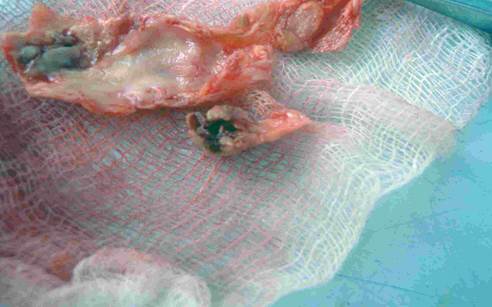
Рис. 1. Атеросклеротическая бляшка с изъязвлением у пациента с сахарным диабетом
Кроме этого, было выполнено патогистологическое исследование атеросклеротических бляшек с частью стенки артерии, удаленной во время операции. Нами проведены параллели между гистологическим строением атеросклеротической бляшки и ультразвуковой картиной.
Статистический анализ полученных результатов проводили с помощью набора лицензированных статистических программ Microsoft Office 2010 и STATISTICA 10.0.
Результаты исследования и их обсуждение. Мы не выявили значимых различий в распространенности бляшек между пациентами основной и контрольной групп. Среди пациентов с сахарным диабетом у 76,5% (39 пациентов) были пролонгированные бляшки, у 23,5% (12 пациентов) – локальные. Среди пациентов контрольной группы процент пролонгированных и локальных бляшек составил 77,5% (76) и 22,5% (22) соответственно. Средняя протяженность бляшки в основной группе составила 25,6±2,33 мм, в контрольной – 22,9±1,39 мм.
В литературе нет единого мнения по поводу влияния гипергликемии на процесс атеросклероза и нестабильности атеросклеротической бляшки, а также на кальциноз атеросклеротических бляшек. В ряде работ кальциноз, фиброз, некротический сердечник, внеклеточные липиды указываются как характерные особенности атеросклеротических бляшек у пациентов с сахарным диабетом [4].
На основании анализа данных триплексного сканирования нами не было установлено четких различий в частоте деструкции между сравниваемыми группами: в группе больных с сахарным диабетом деструкция бляшки встречалась в 51% случаев (26 пациентов), в группе контроля – в 43,9% случаев (43 пациента). Кальциноз бляшки был более распространен у пациентов без сахарного диабета – в 40,8% случаев (40 пациентов), чем у пациентов с сахарным диабетом – 23,5% случаев (12 пациентов) (р<0,001).
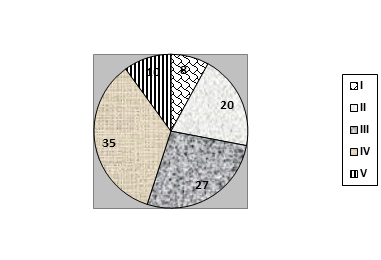
Сравнительная характеристика состояния атеросклеротических бляшек показала следующие результаты (рис. 2). В группе контроля суммарное количество пациентов с гетерогенными бляшками (II и III тип) составило 47%, чаще всего встречались полностью гиперэхогенные бляшки (35%). В 8% случаев выявляли полностью гомогенные бляшки, в 10% случаев структура бляшки не поддавалась идентификации из-за кальциноза.
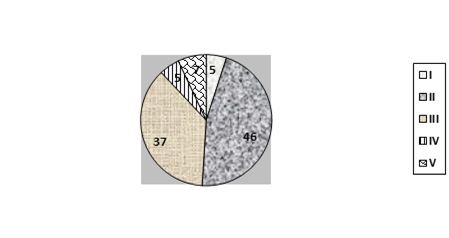
В группе пациентов с сахарным диабетом обращает на себя внимание высокий процент гетерогенных бляшек: 46% бляшек II типа и 37% бляшек III типа. Полностью гиперэхогенные бляшки были обнаружены в 5% случаев, полностью гипоэхогенные – также в 5% случаев, в 7% случаев не удалось установить структуру бляшки из-за кальциноза.
А
Б
Рис. 2. Распределение бляшек по типам согласно классификации C.M. Stefen и G. Geroulakos (А – пациенты без сахарного диабета; Б – с сахарным диабетом)
Несколько иную картину показало патогистологическое исследование. Наличие нестабильной бляшки было выявлено у 68% больных с сахарным диабетом и у 54% больных контрольной группы. В 26% случаев были определены очаги кровоизлияния в бляшку. Было установлено, что при наличии нестабильной атеросклеротической бляшки отмечаются преобладание атероматозных масс, истончение, изъязвление и разрушение покрышки, а также ее инфильтрация липофагами и лимфоцитами, нахождение на ее поверхности потенциально эмбоологенного материала (рис. 3).
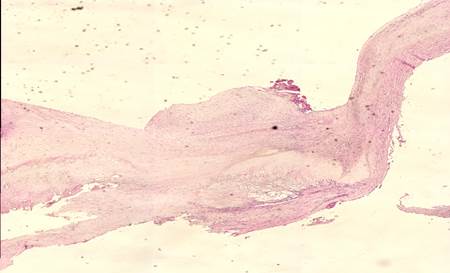
Рис. 3. Микропрепарат. Больной Р., 51 год. Атеросклеротическая бляшка из ВСА.
Окраска гематоксилином и эозином, х30
Исходя из вышеизложенного мы видим, что верный на 100% диагноз можно установить только по данным гистологического исследования.
В Донецкой области зарегистрированы 15213 больных с инфарктом головного мозга, из них 4107 (27%) страдают сахарным диабетом. Летальность в течение первого года после инсульта составляет 35–38%, а в целом нарушения мозгового кровообращения являются причиной четверти всех смертельных исходов у больных сахарным диабетом. На Украине зарегистрированы 1 млн больных диабетом, среди них 11–14% инсулинозависимых. В возрасте старше 40 лет острые нарушения мозгового кровообращения возникают у больных сахарным диабетом в 1,5–2 раза чаще, чем без диабета, а в возрасте до 40 лет – в 3–4 раза чаще, причем со значительным преобладанием женщин.
Таким образом, несмотря на то, что существуют достоверные факторы влияния гипергликемии на развитие инсультов головного мозга, ее роль как фактора риска интра- и послеоперационных осложнений при выполнении каротидной эндартерэктомии остается спорной. Нами установлено, что больные сахарным диабетом с изъязвленными бляшками имели повышенные уровни D-димера и матриксной металлопротеиназы-8, чем те же больные с фиброзными бляшками (р=0,02, р=0,01 соответственно).
У больных сахарным диабетом уровень плазменного фибриногена был выше у пациентов с гипоэхогенными бляшками (р=0,007). Таким образом, была выявлена значительная корреляционная связь между уровнем внутритканевого фактора и D-димера у больных сахарным диабетом с симптомным заболеванием.
В соответствии с результатами нашего исследования установлено, что диабет является основным независимым фактором увеличения длины бляшки у пациентов, подвергающихся каротидной эндартерэктомии. Вследствие этого артериотомический разрез был более длинным, увеличивалось время пережатия внутренней сонной артерии. Диабет по сравнению с другими факторами риска оказывает значительно большее влияние на гистологическую структуру и число осложнений со стороны атеросклеротической бляшки. Следовательно, для этих пациентов целесообразно максимально раннее оперативное пособие.
При сахарном диабете наиболее выражено поражение внутренней сонной артерии, что проявляется в увеличении длины бляшки и выраженном кальцинозе. Сахарный диабет является зависимым фактором риска для развития сердечных и неврологических осложнений после каротидной эндартерэктомии.
Выводы
1. Результаты УЗДГ не выявили статистически значимых различий в протяженности и частоте встречаемости деструкции бляшки у пациентов с сахарным диабетом и без него.
2. Наличие у пациента сахарного диабета 2-го типа относит его в группу риска образования нестабильной атеросклеротической бляшки, что значительно повышает риск возникновения тромбоза и соответственно ишемического инсульта.
3. Нами подтвержден факт особенности морфологического строения атеросклеротической бляшки, что необходимо учитывать при выполнении каротидной эндартерэктомии.



