В настоящее время различные формы патологии, связанные с обструкцией дыхательных путей, привлекают широкое внимание различных исследователей в области пульмонологии. Среди них особое место занимает хроническая обструктивная болезнь легких, значительная доля которой представлена хроническим обструктивным бронхитом (ХОБ) [1]. ХОБ – это заболевание неаллергической природы, связанное с диффузным воспалительным поражением воздухоносных путей, которое приобретает хронический характер. Оно характеризуется бронхиальной обструкцией, что приводит к нарушению легочной вентиляции и газообмена. Клинически ХОБ проявляется кашлем, одышкой и выделением мокроты [2].
Известно, что в развитии хронической обструктивной болезни ключевую роль играют следующие факторы: высокие концентрации различных газов и пыли в воздухе, табачный дым, врожденная недостаточность фермента a1-антитрипсина, инфекционные заболевания дыхательных путей, возрастающая аллергизация населения [2]. Было показано, что ведущую роль в патогенезе ХОБ может играть окислительный стресс, развивающийся на фоне воспалительной реакции и гипоксии. Он способствует гиперпродукции активных форм кислорода (АФК) и интенсификации свободнорадикальных процессов (СРП), в результате которых происходит повреждение молекулярных и клеточных структур [1; 3]. Нейтрализацию АФК в клетках может осуществлять антиоксидантная система (АОС), однако с возрастом активность её компонентов снижается, что, возможно, является основной причиной высокой частоты встречаемости ХОБ у пожилых людей [2].
Несмотря на большое количество имеющихся в настоящее время литературных данных об интенсивности СРП у больных с ХОБ, вопрос о том, как они зависят от степени тяжести заболевания и антиоксидантного статуса организма, остается открытым. Вместе с тем комплексное определение уровней индикаторов свободнорадикального повреждения клеточных структур и некоторых компонентов антиоксидантной системы позволило бы более детально раскрыть молекулярные механизмы деструкции дыхательных путей у больных ХОБ и их зависимость от стадии развития заболевания. Целью данной работы явилось исследование содержания некоторых маркеров СПР и активности ключевых компонентов АОС в крови больных с ХОБ различной степени тяжести.
Материалы и методы исследования
В исследование были включены больные (мужчины) с диагнозом ХОБ (II, III и IV степени тяжести) и возрастом от 50 до 80 лет. Все они находились на стационарном лечении в Республиканской клинической больнице города Махачкалы. Критерием исключения из исследования служило наличие в анамнезе больных перенесенного инфаркта миокарда и инсульта, нестабильной стенокардии, сердечной недостаточности II-IV степени, эндокринных заболеваний, заболеваний органов выделительной и пищеварительной систем. Для контроля были проведены исследования у доноров-мужчин того же возрастного диапазона без выраженных патологий со стороны различных органов и систем.
Содержание МДА в сыворотке крови определяли спектрофотометрически по его реакции с тиобарбитуровой кислотой (ТБК). Оптическую плотность образующегося окрашенного комплекса определяли при длине волны 532 нм. Для расчёта использовали коэффициент молярной экстинкции ТБК-реагирующих продуктов, равный 1,56·105 моль-1см-1. Содержание мочевой кислоты в сыворотке крови определяли на биохимическом анализаторе Indiko (Thermal Fisher, Финляндия) энзиматическим (уриказным) методом.
Содержание карбонильных групп в белках сыворотки крови определяли спектрофотометрически по их реакции их с 2,4-динитрофенилгидразином. Оптическую плотность образующегося окрашенного комплекса определяли при длине волны 370 нм. Для расчета использовали коэффициент молярной экстинкции, равный 22000 М-1·см-1.
Содержание сульфгидрильных (SH) групп и глутатиона в белках сыворотки крови измеряли по содержанию продуктов их взаимодействию с 5,5'-дитио-бис 2-нитробензойной кислотой (ДТНБ) с помощью спектрофотометрического метода. Для расчета использовали коэффициент молярного поглощения, равный 13600 (М/л)-lcm-1 [4].
Определение активности глутатионпероксидазы производили спектрофотометрическим методом путем регистрации убыли восстановленного глутатиона в среде инкубации, содержащей пероксид водорода [5]. Расчёты производили, используя коэффициент молярной экстинкции, равный 13600 М-1 • см-1.
Статистическую обработку полученных данных проводили с помощью пакета компьютерных программ Statistica. Достоверность различий между контрольной и экспериментальными группами определяли с помощью критерия Стьюдента на уровне значимости р < 0,05.
Результаты исследования и их обсуждение
В развитии ХОБ различают 4 степени его тяжести. Причем последняя (IV) стадия – очень тяжелая, которая переходит в ХОБЛ, может заканчиваться необратимой обструкцией дыхательных путей и легочной эмфиземой [2]. В наше исследование были включены больные, имеющие различную степень тяжести заболевания. Из 59 пациентов - 20 (33,9%) имели II степень тяжести, 24 (40,7%) – III и 15 (25,4%) – IV степень. Больные с I степенью заболевания не были включены в исследование, так как за период проведения нашего исследования пациенты такой категории не поступили на стационарное лечение.
Ключевой клинической манифестацией ХОБ является обструкция дыхательных путей, которая снижает количество как вдыхаемого, так и выдыхаемого воздуха. Вследствие нарушения легочной вентиляции у больных может развиваться артериальная гипоксемия и гиперкапния. Это может привести к ситуации недостаточного поступления кислорода в ткани - гипоксии, результатом которой станет активация анаэробных процессов и ацидоз [6]. Гипоксия сопровождается накоплением восстановительных эквивалентов в митохондриальных цепях переноса электронов, что приводит к гиперпродукции супероксидного радикала [7]. Поскольку мембрана митохондрий непроницаема для супероксида, там он может быстро нейтрализоваться с помощью фермента супероксиддисмутазы, превращаясь в пероксид водорода (H2O2). В условиях недостаточно высокой активности H2O2 - расщепляющих ферментов (каталазы и глутатионпероксидазы) пероксид в реакции с ионами двухвалентного металла или супероксидом может образовать более реактивный вид АФК – гидроксильный радикал [8].
Источниками АФК могут стать нейтрофилы, генерирующие супероксидный радикал в НАДФН-оксидазной реакции. Известно, что при воспалительных заболеваниях нижних дыхательных путей и легких происходит повышенная инфильтрация их нейтрофилами. Обнаружено, что у пациентов с острыми обострениями хронического бронхита потребление кислорода и продуцирование АФК нейтрофилами периферической крови и мокроты увеличивается [1].
АФК могут стимулировать перекисное окисление липидов (ПОЛ) и способствовать окислительной модификации как растворимых, так и мембранносвязанных белков (ОМБ), что приводит к потере их функциональной активности. Среди липидов преимущественному окислению подвергаются полиненасыщенные жирные кислоты мембран митохондрий, что может привести к нарушению их проницаемости и развитию каскада патобиохимических процессов на уровне клеток и тканей.
Об интенсивности ПОЛ можно судить по содержанию его конечных продуктов, в частности малонового диальдегида (МДА). Результаты проведенного нами исследования свидетельствуют о низком уровне МДА в крови больных ХОБ с II степенью (табл.). При этом у больных с III степенью ХОБ содержание МДА в крови увеличивается на 64,17% относительно контроля, а у больных с IV степенью оно достигает значений, превышающих уровень нормальных значений в 2,5 раза.
Содержание маркеров СРП в сыворотке крови больных с ХОБ различной степени тяжести
|
Исследованные группы |
МДА (мкМ/л) |
Мочевая кислота (мкМ/л) |
|
Контроль (n=15) |
12,56±1,07 |
262,3±13,2 |
|
II степень ХОБ (n=20) |
14,04±2,04 |
253,2±21,9 |
|
III степень ХОБ (n=24) |
20,62±1,64* |
362,7±20,6* |
|
IV степень ХОБ (n=15) |
32,0±0,54* |
405,8±31,4* |
Примечание: * - Р<0,05 относительно контроля.
Свободные радикалы кислорода и продукты ПОЛ могут способствовать окислительным повреждениям белков. Результатом окислительных деструкций белков является денатурация или конформационные переходы, которые существенно изменяют их функциональные характеристики. Главной мишенью активных форм кислорода и азота являются тиоловые группы белков, принадлежащие остаткам аминокислоты цистеина. В условиях окислительного стресса SH-группы белков депротонируются с образованием дисульфидов [9]. Исследование динамики изменений содержания сульфгидрильных групп в белках сыворотки крови у больных с ХОБ показало, что состояние тиолдисульфидной антиоксидантной системы определяется степенью тяжести заболевания (рис. 1). Уже на начальных стадиях заболевания (II степень) концентрация SH-групп у больных ХОБ незначительно снижается. Переход заболевания в III степень сопровождается статистически значимым падением уровня тиоловых групп (на 24,4% относительно контроля). При этом содержание сульфгидрильных групп у больных с IV степенью ХОБ достигает минимального уровня, составляющем 61,0% от уровня контроля.
В белках содержатся аминокислотные остатки лизина, аргинина и гистидина, способные подвергаться окислительной модификации с образованием карбонильных групп [9]. У пациентов со II степенью ХОБ нами была обнаружена тенденция к повышению уровня карбонилов в белках сыворотки крови (на 14,1%) (рис. 1). Переход болезни в среднетяжелую (III) степень значительно увеличивает содержание карбонильных групп (на 48,8% относительно контроля). Максимальные уровни карбонилирования аминокислот в белках крови обнаружены у больных с IV степенью ХОБ - они примерно в 2 раза превышают таковые показатели у относительно здоровых доноров той же возрастной категории.
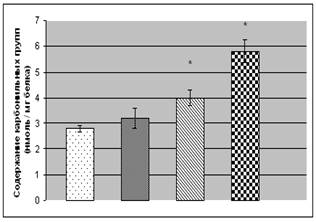
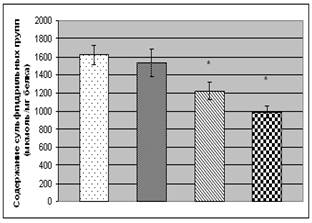
Рис. 1. Содержание карбонильных и сульфгидрильных групп в белках сыворотки
крови больных с ХОБ различной степени тяжести:
 - контроль,
- контроль,  - II степень,
- II степень,  - III степень,
- III степень,  - IV степень.
- IV степень.
Примечание: * - Р<0,05 относительно контроля
Известно, что при гипоксических состояниях АТФ подвергается деградации до аденина и ксантина. Ксантин в дальнейшем метаболизируется с образованием мочевой кислоты – конечного продукта обмена пуриновых нуклеотидов. Данная реакция может катализироваться двумя формами ксантиноксидоредуктаз - ксантиндегидрогеназой и ксантиноксидазой, которые способны конвертироваться друг в друга. При этом в результате ксантиноксидазной реакции образуется супероксидный анион, который может образовать другие АФК. Было показано, что гипоксия может способствовать конвертации фермента ксантиндегидрогеназы в ксантиноксидазу [10]. Таким образом, высокие уровни мочевой кислоты в крови могут опосредованно указывать на интенсивность генерации АФК в ксантиноксидазной реакции. Результаты исследования, представленные в таблице, демонстрируют, что у больных со II степенью ХОБ содержание мочевой кислоты не претерпевает существенных изменений. Однако в динамике прогрессирования заболевания происходит существенное повышение содержания мочевой кислоты, составляющее относительно контроля у пациентов с III степенью - 38,7%, а у пациентов с IV степенью - 54,8%.
Интенсивность СРП зависит от содержания и активности различных неферментативных и ферментативных звеньев антиоксидантной системы. Ключевую роль в защите клеток от АФК играет низкомолекулярная тиолдисульфидная система на основе восстановленного глутатиона. Восстановленный глутатион – это трипептид, содержащий свободную тиольную группу [11]. Он может проявлять свою антиоксидантную активность как самостоятельно, так и в сочетании с реакцией, катализируемой глутатионпероксидазой. Восстановление окисленного глутатиона осуществляется глутатионредуктазой, которая в качестве донора восстановленных эквивалентов использует НАДФН, образующийся в пентозофосфатном пути окисления углеводов [12]. Исследование содержания глутатиона в сыворотке крови больных с ХОБ показало, что снижение его содержания в крови у больных с ХОБ, составляющее 24,5%, происходит даже у больных со средней (II) степенью тяжести ХОБ (рис. 2). Переход болезни в среднетяжелую степень способствует еще более выраженному снижению уровня восстановленного глутатиона (на 33,5%). При тяжелой форме ХОБ это снижение становится драматическим, составляя 43,1% относительно такового здоровых людей.
Одним из наиболее эффективных ферментативных антиоксидантов крови является глутатионпероксидаза. Она обеспечивает нейтрализацию и деградацию органических перекисей и перекиси водорода, используя в качестве субстрата восстановленный глутатион. Результаты нашего исследования показали, что на начальных этапах развития ХОБ (II степень) происходит достоверное повышение глутатионпероксидазной активности, составляющее 18,5% от уровня контроля (рис. 2). Переход заболевания в III степень приводит к незначительному снижению активности фермента. Однако по мере дальнейшего прогрессирования ХОБ снижение активности глутатионпероксидазы становится выраженным и составляет относительно контроля 31,5%.
Таким образом, активность глутатионпероксидазы на начальных этапах развития ХОБ, когда в крови уже появляются первые интермедиаты ПОЛ, увеличивается. Это позволяет снизить количество неорганических и органических пероксидов, которые способны осуществлять окислительную модификацию белков и нарушать барьерные функции биологических мембран. В этом отношении повышение каталитической эффективности глутатионпероксидазы у больных c ХОБ II степени носит компенсаторно-приспособительный характер. И оно отрицательно коррелирует с уменьшением уровня восстановленного глутатиона.
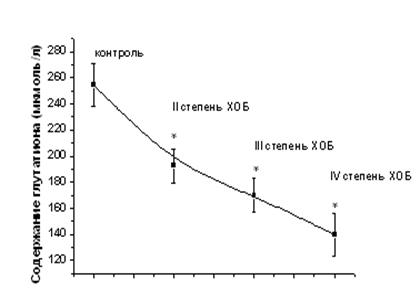
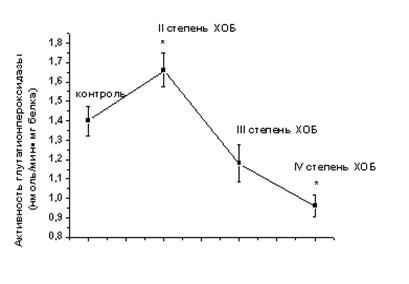
Рис. 2. Динамика изменения содержания глутатиона и активности глутатионпероксидазы в сыворотке крови больных ХОБ различной степени тяжести. Примечание: * - Р<0,05 относительно контроля
Результаты проведенного исследования позволяют предположить, что по мере прогрессирования степени бронхиальной обструкции у больных ХОБ происходит истощение низкомолекулярных компонентов антиоксидантной системы организма, что на фоне нарастающей генерации АФК приводит к нарушению баланса прооксиданты/антиоксиданты. При этом образующиеся в избытке свободные радикалы кислорода могут способствовать окислению глутатионпероксидазы и снижению её активности. В совокупности это способствует повышению концентрации гидроперекисей липидов и продуктов их метаболизации, в частности МДА.
Заключение
Результаты проведенного исследования указывают на прогрессирующую в динамике отягощения степени обструкции бронхов активацию СРП у больных с ХОБ. Это выражается в увеличении уровня МДА, карбонильных групп в белках сыворотки крови и снижении сульфгидрильных групп. Высокие уровни мочевой кислоты, обнаруженные у больных со среднетяжелой и тяжелой степенью ХОБ, указывают на весомый вклад ксантиноксидазной реакции в генерацию АФК. По мере прогрессирования ХОБ происходит снижение активности глутатионпероксидазы и концентрации глутатиона. Это свидетельствует об истощении ключевых компонентов тиолдисульфидной антиоксидантной системы, играющей важную роль в детоксикации АФК. Обнаруженная нами зависимость различных маркеров СРП и компонентов антиоксидантной системы от степени бронхиальной обструкции позволяет рекомендовать их в качестве диагностикумов для количественной оценки тяжести ХОБ, наряду со стандартными клиническими показателями.



