На протяжении долгих лет наиболее перспективным и эффективным методом лечения рака пищевода являлся хирургический [1]. Однако ввиду значительных инновационных достижений последних лет в области химиолучевого лечения рака пищевода, а также отрицательных тенденций в неспособности ряда лечебных учреждений эффективно реализовывать имеющиеся диагностические методы для эффективного стадирования рака пищевода различия в лечебных стратегиях, уровнях хирургической техники, отсутствие единой концепции оценки резектабельности пищеводной карциномы делают дискутабельным вопрос о целесообразности хирургического этапа лечения рака пищевода [2; 3]. Ввиду недостаточностей реализации средств медицинской визуализации на дооперационном этапе стадирования рака пищевода остро стоит вопрос об интраоперационном стадировании рака пищевода, так как это имеет принципиальное значение для выбора объема резекции, лимфодиссекции, использования пластического материала. От точности интраоперационной оценки распространенности опухолевого процесса во многом зависит радикализм вмешательства, а следовательно, отдаленные результаты лечения [4-6]. Традиционно интраоперационное стадирование опухолевого процесса с определением группы sTNM производится по результатам интраоперационной физикальной ревизии, изучения макропрепаратов с использованием или без уточняющих методов исследования и визуализации [7]. Специальные вспомогательные методики края резекции опухоли, срочное гистологическое исследование биоптата, интраоперационное ультразвуковое исследование (УЗИ), радиоизотопная визуализация лимфоузлов радиотрассерами, экспресс-цитология не могут удовлетворять современным тенденциям и требованиям в онкохирургии пищевода. Эти трудоемкие, порой недостаточно точные методы не обеспечивают непрерывного интраоперационного мониторинга ситуации в реальном времени [8]. А в результате стоит вопрос о достаточно эффективной, экономически целесообразной и простой в использовании альтернативе данным методикам. На сегодняшний день методика интраоперационной флуоресцентной визуализации опухолей верхних отделов желудочно-кишечного тракта – это многообещающая альтернатива существующим методам, обладающая высокой чувствительностью и специфичностью в определении границ опухоли, визуализации лимфатических узлов в инфракрасном спектре флуоресценции [9-11]. На сегодняшний момент в литературе практически отсутствуют литературные данные о диагностической ценности интраоперационной фотодинамической диагностики в определении инвазии первичной опухоли, лимфогенного распространения рака пищевода. Исследования в этом направлении представляются актуальной задачей, решение которой способно сделать этот метод простым и надежным диагностическим инструментом, что позволит значительно оптимизировать, «возродить» хирургическую стратегию лечения рака пищевода [12-14]. Все это определяет актуальность дальнейшего поиска и внедрения высокочувствительных и безопасных методик интраоперационного стадирования рака пищевода в нашем исследовании.
Цель исследования: оценить возможности метода интраоперационной фотодинамической диагностики в сравнении с диагностической эффективностью традиционной методики интраоперационной физикальной ревизии органов грудной, брюшной полостей в оценке местной распространенности карциномы пищевода.
Материалы и методы исследования. В работе проведен сравнительный анализ диагностической эффективности двух методов интраоперационного стадирования рака пищевода (РП). Изучению подлежали стандартный метод физикальной оценки распространенности эзофагеальной карциномы на основе макроскопической визуализации, пальпации и ревизии органов брюшной полости (ОБП) и органов грудной клетки (ОГК), использованный опытным хирургом у 109 оперированных больных (группа ИО физикального стадирования), и метод интраоперационной фотодинамической (флуоресцентной) диагностики РП (группа ИО ФДД), примененный у 101 пациента во время выполнения резекций пищевода по поводу рака.
Результаты ИО стадирования опухолевого процесса по правилам TNM классификации 8-го издания, 2017 г., являлись основанием для выбора уровня резекции пищевода, формирования эзофагогастроанастомоза, объема резекции желудка, варианта лимфодиссекции и эзофагопластики. Методикой сравнения – эталоном стадирования явились результаты патоморфологического исследования образца резекции по категориям pTNM 8th ed., 2017. В качестве флуорофора для ИО ФДД использовали фотосенсибилизаторы (ФС) хлоринового ряда 2-го поколения «Радахлорин» и «Фотодитазин» в дозировках 1,2-1,5 мг/кг, которые вводили внутривенно за 120-180 минут до сеанса ИО ФДД. Для получения картины пространственного накопления ФС в опухолевых тканях использовано устройство для визуализации флуоресценции «Флуовизор» (ООО «Аткус», Санкт-Петербург, Россия), который представляет собой спектрально-селективную систему регистрации флуоресцентного излучения с оптическими фильтрами, пропускающими свет только в полосе флуоресценции ФС, не прозрачными для возбуждающего флуоресценцию излучения. Для возбуждения индуцированной флуоресценции в качестве излучателя в аппарате используется диодный источник узкополосного света в диапазоне 652-672 нм. Блок цифровой регистрации флуоресценции состоит из персонального компьютера и специального программного обеспечения «Фотодиагност 5.2», которое обеспечивает работу системы в режиме реального времени. Устройство позволяет отстроиться от фонового излучения, в результате чего изображение опухолевых очагов на мониторе имеет четкие границы, что позволяет определить его площадь. Имеется возможность настраивать визуализацию и задавать параметры количественного анализа изображений.
Степень инвазии первичной опухоли - sT статус - оценивалась до момента удаления препарата по флуоресцентным границам опухолевого очага и его распространению на соседние органы путем сравнения границ ярко флуоресцирующего очага относительной интенсивностью ≥ 0,3 Ед. на мониторе «Флуовизора» с анатомическими границами пораженного органа в средостении и/или верхнем этаже брюшной полости. Таким образом стадировались опухоли sT3 и sТ4. Флуоресцентным признаком инвазии РП sT2 было появление любого очага флуоресценции с интенсивностью ≥ 0,3 Ед. в проекции пальпируемой/видимой опухоли. Инвазия sT1 интраоперационно верифицировалась при появлении вышеописанного флуоресцентного очага на экране «Флуовизора» в зоне предполагаемой локализации не пальпируемой через пищеводную стенку, визуально не определяемой опухоли пищевода. Отрицательным результатом (sT0, sTx) считали отсутствие границ опухоли на мониторе аппарата, сине-голубой цвет спектра на псевдоцветных изображениях и гистограммах и/или низкоинтенсивная флуоресценция < 0,3 Ед. в проекции очагов предполагаемой опухоли на экране устройства.
Лимфогенное распространение - sN статус карциномы определялся путем подсчета и суммирования числа флуоресцентных очагов с интенсивностью ≥ 0,3 Ед. в проекции регионарных лимфоколлекторов средостения, брюшной полости и в мягких тканях шеи при выполнении шейного доступа. Градации критерия sN (1,2,3) определялись суммой выявленных очагов. Так, при выявлении 1-2 флуоресцентно активных лимфоузлов регистрировалась градация sN1, сумме 3-6 соответствовала градация sN2, а при сумме очагов ≥7 регистрировался sN3-статус больного РП. При отсутствии флуоресцентных очагов на мониторе «Флуовизора» интенсивностью ≥ 3 Ед. в проекции региональных лимфоколлекторов статус карциномы принимался за sN0.
После получения результатов патоморфологического исследования образца резекции, на основании сравнения sTN и pTN-статусов каждого стадированного больного РП проводился подсчет истинноположительных (ИП), истинноотрицательных (ИО), ложноположительных (ЛП) и ложноотрицательных (ЛО) результатов. По количеству ИО, ИП, ЛО, ЛП результатов для изучаемых методик интраоперационного стадирования рассчитывались процентные показатели чувствительности (ИП/ИП+ЛО)*100, специфичности (ИО/ИО+ЛП)*100, и точности (ИО+ИП/ИП+ИО+ЛО+ЛП)*100 с 95% доверительным интервалом (ДИ). Для категорий sN проводился анализ классификации кривых ошибок (ROC-кривых) с использованием количественного показателя площади под ROC-кривой (AUC). Согласно классификации экспертной шкалы значение AUC в интервале 0,5-0,6 интерпретировалось как непригодное качество моделирования. Показатель AUC 0,6-0,7 расценивался как среднее качество диагностической модели; 0,7-0,8 – хорошее качество предсказания; а больше 0,8 – как очень хороший метод диагностики.
Результаты исследования и их обсуждение
Показатели точности и чувствительности метода физикальной интраоперационной ревизии ОГК и ОБП при определении градаций глубины инвазии первичного очага РП составили 61,4% (ДИ 54,8 - 68,4%) и 92,8% (ДИ 87,2 - 96,5%) соответственно (рис. 1). Показатель специфичности метода в оценке T-статуса пищеводной карциномы не рассчитывался в связи с отсутствием ИО результатов в исследуемой выборке, так как все больные оперировались по поводу верифицированного рака пищевода T1 и выше. Аналогичные расчеты выполнены применительно к методике ИО ФДД. Дополнительно рассчитана точность метода ИО ФДД в зависимости от градаций критерия T (табл. 1), выявлены преимущества, ограничения и недостатки изучаемого диагностического подхода применительно к оценке T-критерия.
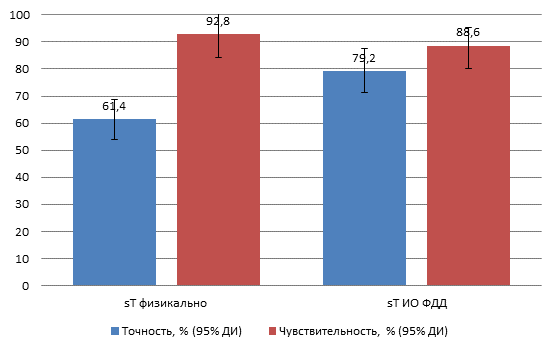
Рис. 1. Точность и чувствительность (%) методик интраоперационного стадирования больных РП по критерию T с указанием 95% ДИ
Точность оценки глубины инвазии пищеводной карциномы (критерия T) при интраоперационном стадировании РП с использованием ИО ФДД приведена в таблице 1.
Таблица 1
Распределение больных РП с ИО ФДД по градациям критерия sT, градациям pT и их сравнение
|
Глубина инвазии РП pT (ypT) |
Число больных с критерием T, полученным |
Совпадение стадии sT с pT (ypT) |
||
|
с ИО ФДД - sT |
патоморфологически - pT (ypT) |
Число больных |
Точность (95% ДИ), % |
|
|
T0 |
10 |
2 |
2 |
100 |
|
T1b |
1 |
3 |
0 |
0 |
|
T2 |
1 |
14 |
1 |
7,1 |
|
T3 |
24 |
26 |
22 |
84,6 |
|
T4a |
59 |
50 |
49 |
98,0 |
|
T4b |
6 |
6 |
6 |
100 |
|
T1b-4b |
101 |
101 |
80 |
79,2 (70,0-86,6) |
Так, из приведенной выше таблицы 1 видно, что при гистопатологически верифицированном отсутствии опухолевых тканей в стенке пищевода (ypT0) после полного ответа опухоли на предоперационную терапию система «Флуовизор» со 100% точностью показала отсутствие интенсивной ≥ 0,3 Ед. флуоресценции в проекции первичного очага, физикально подозрительного на первичный очаг рака. ИО ФДД в оценке глубины инвазии карцином T1-2 оказалась неточной в силу расположения небольшого первичного очага со стороны слизистой оболочки и невозможности возбуждающего флуоресценцию света проникать на необходимую глубину к первичному очагу опухолевого роста. Возбуждающий флуоресценцию красный свет с длиной волны 662±10 нм, проникающий на глубину ткани 0,6-0,9 см, не всегда позволял идентифицировать очаг накопления ФС, расположенный на большей глубине от облучаемой поверхности. В этих случаях источником ЛО результатов в 9 случаях (8,9%) являлись опухоли пищевода pT1b и pT2. Поэтому чувствительность флуоресцентной методики в определении T-статуса больных РП, составившая 88,6%, оказалась ниже, чем чувствительность T-стадирования методом физикальной ревизии без использования «Флуовизора» (92,8%). Таким образом, достаточно высокая чувствительность и точность методики ИО ФДД отмечена только при высоких степенях инвазии опухоли пищевода T3-4. При эзофагеальных поражениях, не выходящих за пределы органа (T1 и T2), возможности флуоресцентной верификации глубины инвазии первичной опухоли оказались ограниченны. Также относительным недостатком методики флуоресцентной диагностики является трудность разграничения первичного очага рака с близкорасположенными метастатическими лимфоузлами. В этих случаях методика являлась наименее чувствительной (74,2%) в отношении Т-статуса местнораспространенных опухолей средне- и нижнегрудного отделов пищевода (pT3-4N1-3), а ЛП результаты по критерию T получены в 9 случаях из 36, что составило 25%.
Точность интраоперационного определения sN-статуса методом физикальной ревизии, опирающегося почти исключительно на зрение хирурга и возможности пальпаторной оценки исследуемых тканей, составила 51,4% (ДИ 44,5-58,4%), чувствительность – 79,4% (ДИ 70,3-86,8%) при специфичности всего 25% (ДИ 17,2-34,3%). Полученные неудовлетворительные результаты физикального стадирования объясняются объективной трудностью макроскопической визуализации и тактильной оценки метастатического поражения лимфоузлов, в частности лимфатических узлов, расположенных в верхнем средостении и апертуре грудной клетки.
Оценка N-статуса больных РП с применением ИО ФДД показали, что точность, чувствительность и специфичность метода в оценке градаций критерия N составила 85,2% (ДИ 76,7-78,9%), 86,6% (ДИ 76,2-93,6%) и 82,3% (ДИ 99,6-71,1%) соответственно (рис. 2).
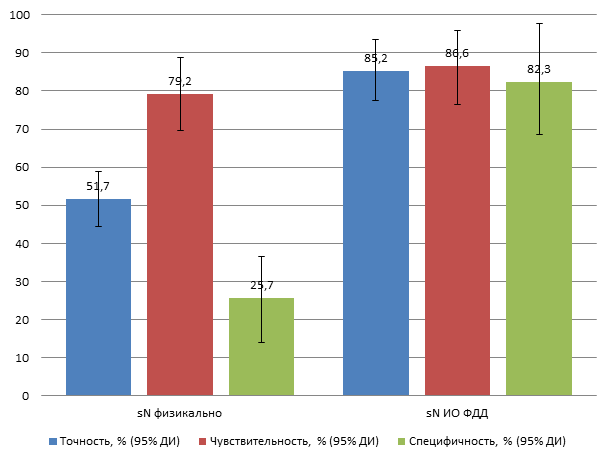
Рис. 2. Характеристики диагностической эффективности двух методик интраоперационного стадирования больных РП, % по критерию N с указанием 95% ДИ
Таким образом, точность метода ИО ФДД в определении градаций метастатической лимфоаденопатии (sN) оказалось существенно выше, чем точность метода физикальной ревизии, что применительно к каждой категории sN отображено в таблице 2.
Таблица 2
Распределение больных по категориям опухолевой лимфоаденопатии (sN), установленным по результатам ИО ФДД, по патоморфологическим данным (pN) и их сравнение
|
Категория лимфоаденопатии |
Число больных с критерием N, полученным |
Совпадение критерия sN и pN (ypN) |
||
|
при ИО ФДД - sN |
Патоморфологически - pN (ypN) |
Число больных |
Точность, % (95% ДИ) |
|
|
N0 |
35 |
29 |
28 |
96,6 |
|
N1 |
11 |
20 |
10 |
50,0 |
|
N2 |
23 |
21 |
18 |
85,7 |
|
N3 |
32 |
31 |
30 |
96,8 |
|
Всего N0-3 |
101 |
101 |
86 |
85,2 (76,7-91,4) |
Из представленной таблицы 2 следует, что при общей точности метода флуоресцентной диагностики, составившей 85,2%, наиболее высокая точность ИО ФДД отмечена при крайних градациях N: N0 и N3. Отсутствие флуоресцентных очагов в проекции региональных лимфоколлекторов с 97% точностью предсказывало N0 статус больного РП. Специфичность ИО ФДД при N0-статусе составила 82,3%.
Интраоперационная оценка градаций sN1-sN2 статуса оказалась менее точна, составляя всего 50%, поскольку флуоресцентный метод не предусматривает возможности дифференцировать границы между близкорасположенными метастатически пораженными лимфоузлами и узлами вблизи первичного опухолевого очага. Меньшая точность в определении N-статуса при N1-N2 статусе также объясняется трудностью точного учета количества флуоресцентно активных (≥ 0,3 Ед. интенсивности) лимфоузлов одной группы. Так, в одной группе лимфатических узлов плановое гистологическое исследование может выявить несколько (до 5-7) лимфоузлов с метастазами рака, что на экране «Флуовизора» представляется единым очагом высокоинтенсивной флуоресценции. Выявление 7 и более очагов активного накопления ФС на экране флуоресцентной системы в проекции пальпируемых или видимых лимфоузлов позволяет с 97% точностью определить обширное лимфогенное метастазирование рака пищевода с регистрацией у больного РП статуса N3. Патоморфологическое подтверждение метастатического поражения лимфатических узлов при их интенсивной флуоресценции на экране «Флуовизора» получено в 58 pN+ из 66 sN+ случаев РП. Общая точность ИО ФДД в диагностике метастатического поражения лимфоузлов (N+ статуса) больных РП составила 87,9%.
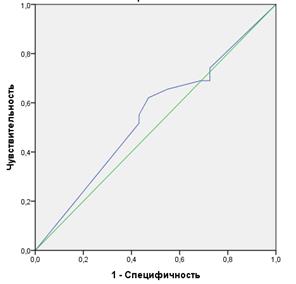
Дополнительно проведенный ROC-анализ (рис. 3) подтвердил неудовлетворительное качество моделирования N-статуса больных РП методом физикальной ревизии ОГК и ОБП при AUC=0,543.
 А.
А. 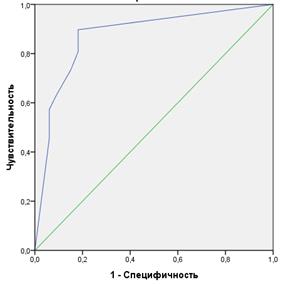 Б.
Б.
|
Площади под кривой (AUC) |
||||
|
Площадь |
Стандартная ошибкаa |
Асимптотическая знч.b |
Асимптотический 95% ДИ |
|
|
Ниж. граница |
Верх. граница |
|||
|
Переменные результата проверки: sN_physical |
||||
|
0,543 |
0,056 |
0,441 |
0,434 |
0,652 |
|
Переменные результата проверки: sN_IFID |
||||
|
0,873 |
0,040 |
0,000 |
0,794 |
0,952 |
Рис. 3. Кривые операционных характеристик (ROC-кривые) методики интраоперационного физикального (А) и фотодинамического стадирования (Б) в определении sN-статуса и переменные результата проверки AUC
В то же время при оценке результатов использования флуоресцентной диагностики показатель AUC=0,873 при чувствительности метода 86,6% (ДИ 76,4-93,8%), специфичности 82,3% (ДИ 64,5-93,0%) свидетельствует об очень хорошем качестве интраоперационного флуоресцентного моделирования N-критерия больных РП.
Заключение
Интраоперационная фотодинамическая диагностика сравнима с методом физикального стадирования в определении T-статуса больных локализованными формами РП по показателям чувствительности и точности, но значительно превосходит методику физикального определения N-статуса больных эзофагеальной карциномой по точности, чувствительности, специфичности и операционным характеристикам. ИО ФДД является перспективным методом интраоперационного стадирования РП, который может инициировать пересмотр устоявшихся взглядов в хирургической концепции лечения рака пищевода.



