По данным ВОЗ ежегодно рождается до 5–6% детей с пороками развития, из которых в течение первых 4 недель жизни умирают более 300 000. В России среди причин ранней неонатальной смерти врожденные аномалии занимают второе место и составляют 18,1% [1]. В их структуре аномалии желудочно-кишечного тракта (ЖКТ) находятся на второй позиции, уступая лишь порокам сердца. Самой частой причиной врожденной кишечной непроходимости является атрезия. Атрезии чаще локализуются в областях «сложного» органогенеза: пищеводе, двенадцатиперстной кишке, дистальном отделе подвздошной кишки, месте перехода тонкой кишки в толстую [2, 3]. Частота встречаемости атрезии тонкой кишки составляет 1:5000 новорожденных [4]. Пациенты с атрезией тощей кишки имеют повышенный риск развития синдрома короткой кишки [5].
Многообразие патоморфологических вариантов пороков кишечной трубки обусловливает сложности в выборе не только хирургической тактики лечения того или иного вида врожденной патологии, но и самой техники наложения межкишечных соустий [6]. Среди детских хирургов в настоящее время отсутствует единое понимание вопроса выбора методов оперативной коррекции врожденной кишечной непроходимости.
Цель исследования: определить структуру врожденной кишечной непроходимости, оценить эффективность и безопасность различных методов ее хирургической коррекции.
Материалы и методы исследования
Проведен ретроспективный анализ 45 историй болезни детей, госпитализированных в хирургическое отделение Нижегородской областной детской клинической больницы с 2011 по 2017 гг. с врожденной кишечной непроходимостью. Среди них: 21 пациент (47%) с высокой непроходимостью (13 девочек и 8 мальчиков) и 24 (53%) – с низкой (8 девочек и 16 мальчиков).
Этиология врожденной кишечной непроходимости представлена на рисунках 1, 2.
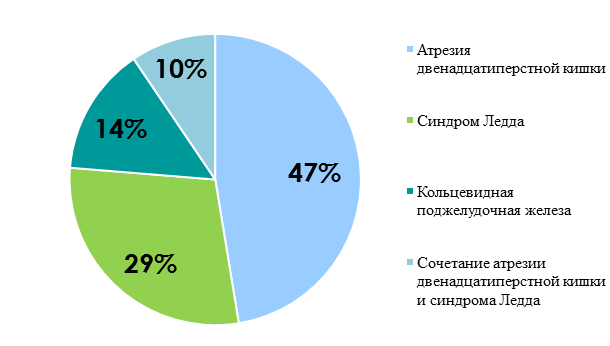
Рис. 1. Распределение пациентов с высокой врожденной кишечной непроходимостью по этиологии
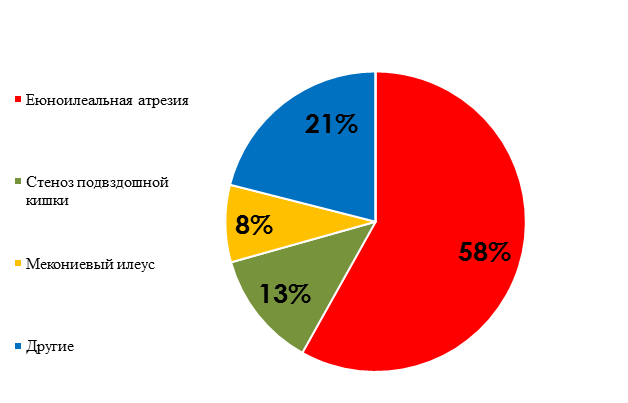
Рис.2. Распределение пациентов с низкой врожденной кишечной непроходимостью по этиологии
Все пациенты были оперированы. 10 больным (22%) был наложен дуодено-дуоденоанастомоз по Кимура, 3 детям (6,6%) выполнена дуоденотомия с иссечением мембраны, в 4 случаях (4,4%) был наложен анастомоз «конец-в-бок» (n=2) и «бок-в-бок» (n=2), в 3 случаях (6,6%) при синдроме Ледда проведена операция Ледда. 1 ребенку при сочетании стеноза двенадцатиперстной кишки с синдромом Ледда выполнены рассечение тяжей Ледда и дуоденоилеостомия.
7 пациентам (15,5%) с еюноилеальной атрезией наложен адаптированный анастомоз, 5 больным (11%) – анастомоз по типу «конец-в-бок». 4 пациентам (8,9%) выполнялась илеостомия (n=2 – при мекониевом илеусе, n=2 – при стенозе подвздошной кишки). Одному ребенку (2,2%) выполнялась еюностомия. Ребенку с синдромом «пагоды» (2,2%) был наложен пликационный анастомоз de Lorimier–Harrison. В случае множественной атрезии тонкой кишки выполнено наложение анастомозов «конец-в-конец» и «Т-образного» по Bishop–Koop (2,2%).
В ходе экспериментальной части исследования произведено наложение тонко-тонкокишечных пликационных анастомозов de Lorimier–Harrison 10 кроликам-самцам калифорнийской породы (n=5 – узловыми швами, n=5 – непрерывным швом). Средняя продолжительность операции составила 103 + 24,9 минуты. Операции проводились при наркотизации (нембутал, залетил, новокаин), применялись периоперационная антибиотикопрофилактика и антибиотикотерапия (гентамицин) в течение 3 суток, инфузионная терапия (5%-ный раствор глюкозы, мексидол) в объеме 40–50 мл в течение операции. Животных выводили из эксперимента на 7-е сутки путем воздушной эмболии.
Все исследования проводились в соответствии с Европейской конвенцией «О защите позвоночных животных, используемых для экспериментов или в иных научных целях» (Страсбург, 18.03.1986 г., ETS № 123). Получено разрешение ЛЭК.
Морфологические исследования осуществлялись с использованием микроскопа Nicon Eclipse 80 I, 10*22. Методом пневмопрессии определялась герметичность анастомозов. Выделялся участок кишки с зоной анастомоза, к дистальному концу фиксировалась трубка, через которую нагнетался воздух. К проксимальному участку подсоединялся манометр. Регистрировалось давление, необходимое для разгерметизации швов (рис. 3). Для оценки эластичности анастомоза рассчитывался индекс стенозирования (ИС) по следующей формуле (T. Irvin, 1977): 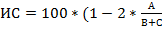 (%), где А – диаметр кишки в зоне соустья, В – диаметр кишки на 2 см выше соустья, С – диаметр кишки на 2 см ниже соустья.
(%), где А – диаметр кишки в зоне соустья, В – диаметр кишки на 2 см выше соустья, С – диаметр кишки на 2 см ниже соустья.
Статистический анализ включал в себя использование методик описательной статистики с расчетом в выборках показателей средней арифметической, медианы, ошибки средней арифметической, среднего квадратического отклонения. Достоверность параметрических данных оценивалась с помощью расчета t-критерия Стьюдента, непараметрических – с применением U-критерия Манна–Уитни. Достоверными считали различия при уровне значимости p<0,05. Значение указывалось с точностью до двух знаков после запятой.
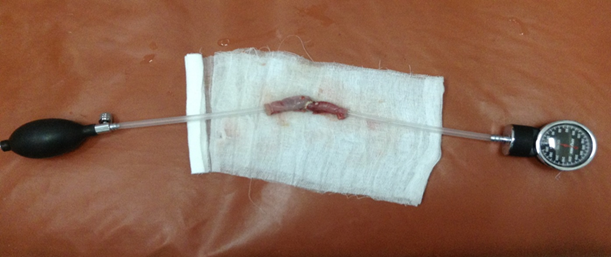
Рис. 3. Исследование герметичности анастомозов методом пневмопрессии
Результаты исследования и их обсуждение. Среди 10 оперированных при наложении дуодено-дуоденоанастамоза по Кимура отмечалось 1 осложнение в виде функциональной несостоятельности анастомоза. Спаечная непроходимость в 1 случае явилась осложнением при наложении анастомоза «бок-в-бок». При коррекции еюноилеальной атрезии методом наложения адаптированного анастомоза (n=7) у 1 пациента развилась функциональная несостоятельность анастомоза. При наложении анастомоза «конец-в-бок» возникли осложнения в 2 случаях: спаечная непроходимость и сочетание несостоятельности анастомоза со спаечной непроходимостью.
В ходе экспериментальной части было доказано, что при наложении пликационного анастомоза de Lorimier-Harrison однорядный непрерывный шов дает статистически лучшие результаты в отношении параметров эластичности и герметичности анастомоза (результаты представлены на рисунке 4 и в таблице).
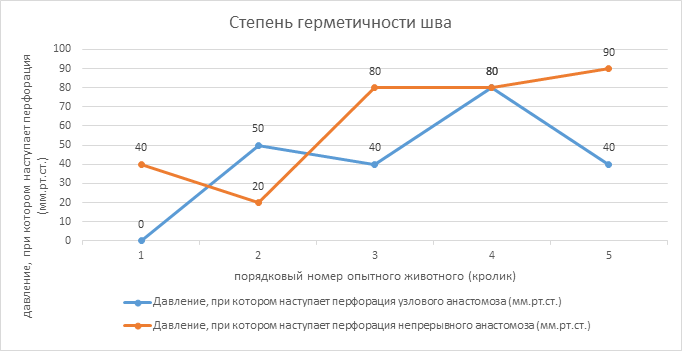
Рис. 4. Сравнительная оценка герметичности узлового и непрерывного швов
Результаты оценки степени герметичности швов (узловой/непрерывный)
|
Давление, необходимое для разгерметизации (узловой анастомоз), мм рт. ст. |
Давление, необходимое для разгерметизации (непрерывный анастомоз), мм рт. ст. |
|
|
Среднее |
42 |
56 |
|
Медиана |
40 |
60 |
|
Наблюдения |
5 |
5 |
|
Гипотетическая разность средних |
0 |
0 |
|
P (T<=t) одностороннее |
0,0418 |
|
Как видно из рисунка 4 и таблицы, при применении узлового шва перфорация зоны анастомоза происходила при достоверно меньшем давлении, чем при непрерывном шве. Среднее значение давления, необходимое для разгерметизации при использовании узлового шва, составило 42 мм рт. ст., в то время как при непрерывном – 56 мм рт. ст. (p<0,05).
Для оценки эластичности анастомозов путем расчета индекса стенозирования на 7-е сутки было выявлено, что при наложении непрерывного шва он составляет 15,2%+/–2,4%, а при наложении узлового – 19,1%+/–2,4%, что указывает на то, что узловой шов отличается большей ригидностью; в свою очередь непрерывный шов является более эластичным.
При морфологическом исследовании зон анастомозов отмечено, что при наложении узловых швов выявляются полное отсутствие кишечных ворсин, очаги кровоизлияния, некротизированные массы на поверхности (клеточный детрит), вакуольная дистрофия, а также значительно разрушенный эпителий и межмышечные нервные сплетения (рис. 5, 6).
В случае наложения непрерывного шва сохранены ворсинки со специфическим эпителием, бокаловидные клетки, функционирующие крипты, кровенаполнение и нервные ганглии, что говорит о меньшей травматичности данного шва (рис. 7, 8).

Рис. 5. Гистологическая картина зоны анастомоза при наложении узлового шва (отсутствие ворсин, очаги кровоизлияния)
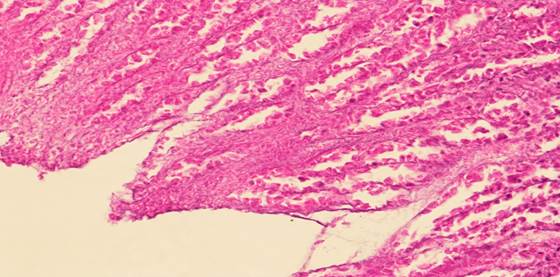
Рис. 6. Гистологическая картина зоны анастомоза при наложении узлового шва (полностью разрушенный эпителий)
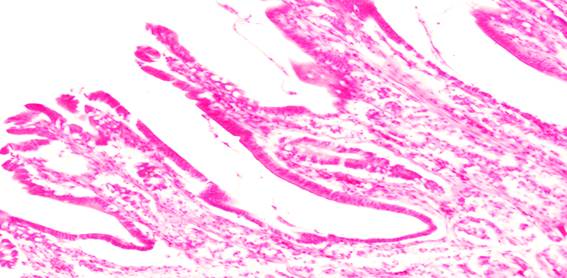
Рис. 7. Гистологическая картина зоны анастомоза при наложении непрерывного шва (ворсинки со специфическим сохраненным эпителием, бокаловидные клетки)
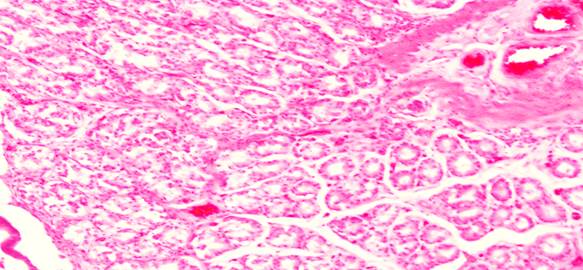
Рис. 8. Гистологическая картина зоны анастомоза при наложении непрерывного шва (сохраненное кровенаполнение)
Заключение
Таким образом, вопрос о способах хирургической коррекции врожденной тонкокишечной непроходимости остается открытым в связи с отсутствием единой тактики лечения данной патологии. Эффективность методик оперативной коррекции указанных заболеваний требует дальнейшего изучения с позиции доказательной медицины на выборках большего объема. Проведенное исследование показало, что методикой выбора при дуоденальной непроходимости можно считать создание дуодено-дуоденоанастомоза по Кимура, при мембранозном типе атрезии – иссечение мембраны, при еюноилеальной непроходимости лучшие результаты дает наложение адаптированных анастомозов, а при дисконгруэнтности сегментов тонкой кишки более 4:1 оптимально применение пликационного анастомоза, морфологические характеристики которого в настоящее время недостаточно освещены в мировой литературе. Использование однорядного непрерывного шва при наложении пликационного анастомоза увеличивает эластичность и герметичность зоны анастомоза, менее травматично и, следовательно, может быть рекомендовано при оперативном лечении детей с врожденной кишечной непроходимостью.



