Анемия является одним из наиболее частых патологических состояний [1]. Около трети населения в мире страдает от анемии, по оценкам ВОЗ, в 2011 году анемией страдали 42,6% детей в мире, что составляет 273 миллиона человек [2]. Наиболее частой причиной анемии является дефицит железа, однако за период с 1990 по 2010 год частота ЖДА значительно снизилась в экономически развитых регионах [2]. Такое снижение частоты ЖДА приводит к повышению значимости анемии хронических заболеваний, гемолитических анемий и анемий, связанных с дефицитом других нутриентов. Так, в странах Западной Европы и Южной Латинской Америки у лиц женского пола анемия, связанная с хронической болезнью почек (ХБП), занимает третье ранговое место среди всех анемий. В Австралии, высокоразвитых странах Азии и Северной Америки, а также в Центральной и Восточной Европе – четвертое место [2]. В Российской Федерации данные о распространенности нефрогенной анемии ограниченны, однако, по данным Жетищева Р.А. и соавт., уже при I-II стадии ХБП более половины детей имели анемию [3]. В связи с этим повышается значимость дифференциальной диагностики анемии, связанной с дефицитом железа, от других видов анемии, в первую очередь от нефрогенной анемии.
По критериям Kidney Disease Outcomes Quality Initiative (KDIGO) нефрогенная анемия понимается как снижение гемоглобина менее 110 г/л у детей старше двух лет и менее 100 г/л у детей младше двух лет или возникновение симптомов анемии [4]. Вероятный уровень снижения скорости клубочковой фильтрации (СКФ), при котором возможно формирование нефрогенной анемии – менее 60 мл/мин/1,73 м2. Такие же критерии приводятся и в клинических рекомендациях по диагностике и лечению анемии при хронической почечной недостаточности [5]. Ведущим патогенетическим фактором нефрогенной анемии является абсолютная или относительная недостаточность эритропоэтина (ЭПО). Несмотря на ведущую роль дефицита ЭПО, «классическая» нефрогенная анемия часто ассоциирована с дефицитом железа. Критериями нормального обмена железа у нефрологических больных считают уровень ферритина 200-500 мкг/л или процент насыщения трансферрина железом ≥ 20% [4]. Так как анемия при ХБП типично нормоцитарная и нормохромная, одним из способов ее дифференциальной диагностики от анемии, вызванной абсолютным или функциональным дефицитом железа, является определение процента гипохромных эритроцитов [5]. С другой стороны, некоторые исследования не обнаружили различий в традиционных эритроцитарных индексах у детей с ХБП с дефицитом железа и без него [6]. Другим способом выявления дефицита железа при ХБП является определение содержания гемоглобина в ретикулоцитах – CHr или его эквивалента – Ret-He [7]. Ret-He, в отличие от индексов эритроцитов, отражает запасы железа в костном мозге, доступного для эритропоэза в последние 48 ч, то есть быстрее реагирует на абсолютный и функциональный дефицит железа [8]. Однако, согласно данным Hatoun et al., применение данного параметра как единственного маркера дефицита железа в реальной практике привело к его гипердиагностике в детской популяции: при ожидаемой распространенности в 9-10% дефицит железа обнаружен у 61,1% детей [9].
В связи с этим целью нашего исследования была оценка диагностической ценности Ret-He в дифференциальной диагностике ЖДА и нефрогенной анемии.
Материалы и методы исследования
Одномоментное исследование проведено на базе областного уронефрологического центра ГБУЗ «СОКБ им. В.Д. Середавина», г. Самара.
Критерии включения: возраст от 0 до 18 лет, наличие анемии в ОАК при поступлении на стационарное лечение, согласие родителей или законных представителей на участие в исследовании.
Критерии исключения: отсутствие установленного клинического диагноза, тяжелое общее состояние ребенка, наличие в анамнезе известного гематологического заболевания за исключением ЖДА, наличие в анамнезе онкологического заболевания (нефробластома), уровень гемоглобина в ОАК при поступлении в пределах нормы, отказ родителей или законных представителей от участия в исследовании. Так как показатель уровня Ret-He высоко лабилен на фоне ферротерапии, в исследование не включались дети, принимавшие препараты железа в течение 1 месяца, предшествовавшего исследованию, а также получавшие терапию препаратами рекомбинантного человеческого ЭПО.
Анемией считалось снижение уровня гемоглобина ниже 110 г/л у детей от 6 месяцев до 59 месяцев, ниже 115 г/л у детей от 5 до 11 лет, ниже 120 г/л у детей от 12 до 14 лет, ниже 120 г/л у девушек 15 лет и старше, и ниже 130 г/л у юношей 15 лет и старше. Абсолютным дефицитом железа считался уровень сывороточного ферритина <30 нг/мл, нормальные запасы железа диагностировались при уровне сывороточного ферритина >100 нг/мл [4].
Всем детям проведен ОАК на автоматическом гематологическим анализаторе Sysmex XT-2000i (Sysmex, Япония) с определением концентрации Hb, числа эритроцитов (RBC), RBC-индексов (MCV, MCH, RDW-CV) и содержания гемоглобина в ретикулоцитах (Ret-Hе) и биохимический анализ крови на автоматическом биохимическом анализаторе Integra 400 plus (Roche, Швейцария) с определением С-реактивного белка количественным методом и методом иммуноферментного анализа сывороточного ферритина.
Анализ результатов исследования проведен с использованием ПО Microsoft Excel, Statistica 10.0 и SPSS 16.0. Полученные данные обрабатывали с применением методов статистики, использующих элементы основного вариационного и многофакторного анализа с достоверностью 95%. Проверку соответствия статистического распределения нормальному проводили с помощью критерия Пирсона χ-квадрат. Для оценки различий между двумя независимыми выборками (несвязанные группы) по признаку, измеренному в количественной шкале и имеющему отличное от нормального распределение, использовали непараметрический критерий Манна-Уитни. Для выявления взаимосвязи между количественными показателями рассчитывали ранговый коэффициент корреляции Спирмена и Кенделла.
Для количественных показателей (Ret-Hе) определяли пороговые значения, оптимальные для классификации изучаемого события (наличия ЖДА). За оптимальную точку разделения (cutoff point) принимали значение показателя, соответствующее максимальному значению индекса Youden (J). Диагностическую ценность количественных показателей оценивали, используя ROC-анализ, рассчитывая значения AUC (area under the curve, площадь под кривой) и 95% доверительный интервал (ДИ). Оценка диагностической ценности показателя проводилась в соответствии со следующими критериями: AUC 0,5-0,6 – неудовлетворительная, 0,6-0,7 – средняя, 0,7-0,8 – хорошая, 0,8-0,9 – очень хорошая, 0,9-1 – отличная.
В исследование всего включено 80 детей, из них 40 человек – с анемией на фоне абсолютного дефицита железа (сывороточный ферритин <30 нг/мл) и 40 человек – с нефрогенной анемией и отсутствием дефицита железа (сывороточный ферритин >100 нг/мл).
Половой состав групп не отличался: мальчиков в группе ЖДА было 37,5% (15 человек), тогда как в группе нефрогенной анемии – 42,5% (17 человек) (р=0,648). Средний возраст в группе ЖДА был в два раза меньше – 5,4 (5,4) года против 12,1 (6,0) года в группе нефрогенной анемии (р <0,001), что, вероятно, связано с особенностями этиологической структуры.
Результаты исследования и их обсуждение
Этиологическая структура представлена в таблице 1. Наиболее часто в группе ЖДА встречались инфекционно-воспалительные заболевания (инфекции мочевой системы, острый пиелонефрит, острый тубулоинтерстициальный нефрит), а также пороки развития почек до хирургической коррекции. В группе нефрогенной анемии основной причиной патологии почек являются различные пороки развития, на втором месте – хронический гломерулонефрит, что полностью соответствует как структуре нефрологической патологии уронефрологического центра, так и общемировым тенденциям. На данный момент в большинстве развитых стран CAKUT (Congenital anomalies of kidney and urinary tract) синдром является основной причиной развития терминальной стадии ХБП у детей, особенно младенцев и детей раннего возраста. Основные факторы риска прогрессирования ХБП у детей с CAKUT синдромом – протеинурия, быстрый соматический рост, наступление пубертатного периода, повышенное артериальное давление, в том числе асимптоматическое, отсутствие проведения ренопротективной терапии, снижение функционального резерва почек и анемия. В связи с этим особенно важна своевременная диагностика анемического синдрома и его адекватная терапия в группе детей с пороками мочевой системы.
Таблица 1
Этиологическая структура патологии мочевой системы в группах сравнения
|
Признаки |
Группа ЖДА, n=40, % (абс.) |
Группа нефрогенной анемии, n=40, % (абс.) |
р |
|
Инфекции мочевых путей в том числе: |
55,0% (22) |
17,5% (7) |
<0,001 |
|
острый пиелонефрит |
35,0% (14) |
0% (0) |
<0,001 |
|
острый цистит |
2,5% (1) |
0% (0) |
0,500 |
|
хронический пиелонефрит |
12,5% (5) |
17,5% (7) |
0,755 |
|
хронический цистит |
5,0% (2) |
0% (0) |
0,247 |
|
Пороки развития почек в том числе: |
37,5% (15) |
32,5% (13) |
0,640 |
|
вторичный мегауретр |
25,0% (10) |
10,0% (4) |
0,088 |
|
кистозная дисплазия |
10,0% (4) |
0% (0) |
0,058 |
|
множественные аномалии почек |
2,5% (1) |
15,0% (6) |
0,108 |
|
гидронефроз |
0% (0) |
7,5% (3) |
0,120 |
|
Дисметаболическая нефропатия |
7,5% (3) |
0% (0) |
0,120 |
|
Хронический тубулоинтерстициальный нефрит |
0% (0) |
22,5% (9) |
0,002 |
|
Хронический гломерулонефрит |
0% (0) |
27,5% (11) |
<0,001 |
Скорость клубочковой фильтрации рассчитана по модифицированной формуле Шварца. В соответствии с критериями KDIGO, наиболее часто у большинства детей с нефрогенной анемией установлена 3а (14 – 35,0%) стадия ХБП. 4-5 стадия ХБП установлена у 7 (17,5%) детей, 4 из них получали постоянный перитонеальный диализ в амбулаторных условиях. В группе ЖДА преобладала 1-2 стадия ХБП – 42,5% (17). Несмотря на то что в группе ЖДА реже встречалась 4 и 5 стадия ХБП: 7,5% (4) против 17,5% (7) в группе нефрогенной анемии, изучение произвольных таблиц сопряженности не обнаружило значимых различий между группами (χ2 (2, n=80) = 2,0 р=0,360). Также не отличалась и средняя СКФ: в группе ЖДА она составила 68,0 (42,0) мл/мин/1,73м2, в группе нефрогенной анемии – 56,9 (32,8) мл/мин/1,73м2 (р=0,193).
Сравнение основных показателей ОАК детей с ЖДА и нефрогенной анемией представлено в таблице 2.
Таблица 2
Сравнительная характеристика показателей ОАК у детей с ЖДА и нефрогенной анемией
|
Показатели |
Группа ЖДА, n=40 |
Группа нефрогенной анемии, n=40 |
р |
|
WBC, x109/л |
8,87 (3,9) |
7,15 (2,2) |
0,017 |
|
RBC, x1012/л |
4,19 (3,99; 4,37) |
3,67 (3,35; 3,74) |
<0,001 |
|
Hb, г/л |
102 (100; 106,5) |
99 (89,5; 102) |
0,001 |
|
MCV, фл |
77,1 (75,75; 79,15) |
87,05 (84,55; 89,3) |
<0,001 |
|
MCH, пг |
24,45 (24,1; 25,15) |
27,15 (26,55; 27,7) |
<0,001 |
|
Ret-He, пг |
24,05 (22,1; 25,9) |
27,8 (27,5; 28,35) |
<0,001 |
Примечание: в таблице для показателя WBC указано среднее значение (стандартное квадратичное отклонение), для других показателей – медиана (1; 3-й квартили).
Для детей группы нефрогенной анемии характерно более выраженное снижение уровня гемоглобина: анемия средней степени тяжести диагностирована у 7,5% (3) детей с ЖДА и у 22,5% (9) детей с нефрогенной анемией (р=0,070), кроме того, еще у одного ребенка обнаружена тяжелая анемия – Hb 65 г/л. Изучение индексов эритроцитов показало, что практически во всех случаях нефрогенной анемии без дефицита железа анемия была нормохромной (97,5%) и нормоцитарной (90,0%), в отличие от ЖДА, в большинстве случаев которой обнаружены типичные характеристики – гипохромия (90,0%) и микроцитоз (87,5%).
Для показателя Ret-He обнаружена прямая корреляция как с показателями красной крови (для RBC rS=0,564 р<0,001 для Hb rS=0,299 р=0,007), так и с уровнем сывороточного ферритина (rS=0,524 р<0,001).
При построении ROC-кривой для Ret-He получено очень хорошее качество модели, AUC 0,886±0,037 (95% ДИ 0,813-0,958; р=0,000) (рисунок). Расчет чувствительности и специфичности проводится на основе данных таблицы сопряженности. Sensitivity = 34 / 42 = 0,791 = 79,1%. Specificity = 31 / 43 = 0,974 = 83,8%. Оптимальная точка разделения, соответствующая наиболее высокому значению Youden's индекса (J = 67,5) – 27,35-27,50.
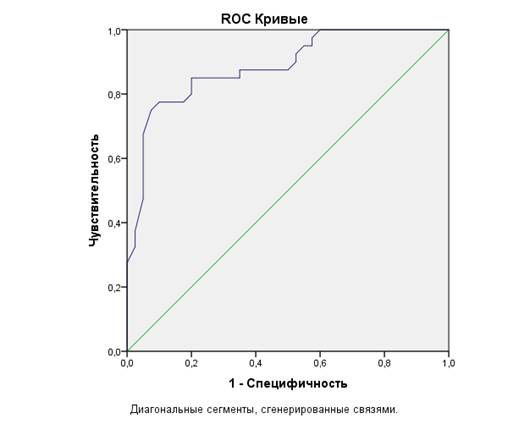
ROC-кривая Ret-He для дифференциальной диагностики ЖДА и нефрогенной анемии
Функциональный или абсолютный дефицит железа является частым состоянием при ХБП, которое не только имеет собственные клинические проявления, ухудшающие состояние и самочувствие пациента, снижает эффективность терапии препаратами ЭПО, но является прямым фактором прогрессирования патологического процесса в почках и независимым предиктором смертности [10]. Наиболее часто в качестве диагностического параметра дефицита железа используется уровень сывороточного ферритина, однако при ХБП его использование представляет определенные сложности. Концентрация сывороточного ферритина увеличивается на фоне хронического воспаления, таким образом, в ситуации дефицита железа на фоне ХБП его определение даст ложноотрицательный результат [11]. На концентрацию сывороточного ферритина также может влиять нутритивный статус пациента и некоторые сопутствующие заболевания, например патология печени [11]. Кроме того, исследование сывороточного ферритина требует дополнительных затрат, а также дополнительного забора крови. Ret-He не подвержен изменениям на фоне воспаления [12], не требует проведения дополнительных тестов кроме общего анализа крови, поэтому является перспективной альтернативой как минимум для скрининга пациентов с ХБП на дефицит железа. Исследования на взрослой популяции пациентов показали возможность применения CHr или Ret-He для диагностики дефицита железа у пациентов с ХБП, в том числе пациентов, получающих диализ. В исследовании Urrechaga et al. на популяции диализных пациентов показатель Ret-He, так же как и процент гипохромных эритроцитов, показал преимущество по сравнению с традиционными маркерами запасов железа в прогнозировании ответа на ферротерапию [13]. По данным Dalimunthe et al., в дифференциальной диагностике ЖДА и нефрогенной анемии Ret-He с пороговым значением 31,65 пг показал чувствительность 81,5% и специфичность 61,6%, а общая диагностическая ценность (по AUC) 0,818 (р<0,001) [14]. Также эффективен Ret-He в обнаружении ЖДА у пациентов, получающих терапию препаратами рекомбинантного человеческого ЭПО: чувствительность параметра – 78,3%, специфичность – 92,0%, AUC 0,864 [15]. Исследования Ret-He в детской популяции малочисленные и ограничены преимущественно классической ЖДА. Ретроспективное исследование, в которое были включены детей 45 на диализе, показало высокую эффективность Ret-He в диагностике абсолютного дефицита железа: при пороговом значении 28,9 пг, чувствительность Ret-He 90%, а специфичность 75% [16]. Выявлена корреляция между Ret-He и процентом насыщения трансферрина железом и Hb [16]. Таким образом, полученные нами результаты диагностической ценности Ret-He в выявлении абсолютного дефицита железа сопоставимы с данными других исследований. Основной сложностью в интерпретации полученных результатов как нашего, так и других исследований является влияние выбранных параметров для определения дефицита железа. Как было отмечено выше, сывороточный ферритин – суррогатный маркер запасов железа и, по данным Davidkova et al., отражает не столько состояние обмена железа, сколько уровень хронического воспаления [17]. В связи с этим важное значение имеет возможность применения Ret-He как маркера ответа на терапию препаратами ЭПО и железа.
Заключение. Эквивалент содержания гемоглобина в ретикулоцитах, учитывая удовлетворительную диагностическую ценность, простоту исполнения и стоимость, может использоваться в качестве скрининг-метода в диагностике абсолютного дефицита железа при ХБП у детей.



