Известно, что ишемия является одной из наиболее распространенных причин гибели и повреждения клеток. С этим связано наличие консервативных механизмов регуляции кислородного гомеостаза и гомеокинеза. Одна их этих систем, связанная с каскадом гипоксией-индуцируемого фактора, приводит к синтезу эритропоэтина (EPO), представляющего собой гликопротеин с молекулярной массой порядка 30,4 кДа [1, 2]. Данная молекула наиболее известна как положительный регулятор эритропоэза, который вырабатывается преимущественно в почках в ответ на снижение парциального давления кислорода. Однако спектр физиологических эффектов EPO довольно широк и позволяет рассматривать его как агент с универсальной цитопротекторной направленностью. Запускаемые им каскады приводят к повышению устойчивости клеток к повреждению, что было доказано на моделях ишемии почти всех органов [3–5]. При ишемических поражениях разных органов EPO обусловливает ангиогенное, антиоксидантное, противовоспалительное и антиапоптотическое действие [6, 7], что приводит к снижению площади повреждения [8]. Реализация клеточных эффектов EPO происходит при связывании его с двумя рецепторами (erythropoetin receptor – EPOR), в результате чего из них образуется гомодимер. Последнее приводит к активации многих внутриклеточных факторов, среди которых главную роль в цитопротекции отводят Akt, который инактивирует каспазы, приводящие к повреждению митохондрий, нарушению клеточного гомеостаза и инициации апоптоза. [9]. В то же время ввиду активации большого количества вторичных посредников EPO способен обусловливать развитие таких негативных эффектов, как увеличение продукции эндотелина, повышение концентрации тканевого ренина, изменение баланса простагландинов сосудистой ткани, стимуляция ангиогенеза и пролиферация клеток гладких мышц сосудов [10, 11].
Современная фармакология располагает несколькими принципиально отличающимися друг от друга поколениями лекарственных средств на основе эритропоэтина. Путем модификации углеводных остатков были предприняты попытки снизить влияние на гематокрит и артериальное давление, а также добиться улучшения фармакокинетики препаратов. Итогом послужило создание нескольких принципиально новых соединений, один из которых – карбамилированный дарбэпоэтин. Гармонично сочетая в себе лучшие качества препаратов предыдущих поколений, данная молекула является наиболее перспективной в указанной группе [12, 13]. Поэтому исследование острой лекарственной токсичности карбамилированного дарбэпоэтина актуально.
Материалы и методы исследования
Исследование острой токсичности проводилось согласно методу фиксированной дозы (по протоколу OECD 420 ГОСТ 32296-2013 «Методы испытаний по воздействию химической продукции на организм человека. Основные требования к проведению испытаний по оценке острой токсичности при внутрижелудочном поступлении методом фиксированной дозы»). Опыты проводили на белых лабораторных мышах линии BALB/c обоего пола массой 20±2 г и белых лабораторных крысах линии Wistar массой 200±20 г. Животные находились на кормлении полнорационным комбикормом и содержались в индивидуальных вентилируемых клетках с температурой 21–22°С и влажностью воздуха 55–60%. Работа была выполнена с соблюдением всех биоэтических норм согласно «Европейской конвенции о защите позвоночных животных, используемых для эксперимента или в иных научных целях» [Directive 2014/63/EU]. Все эксперименты были одобрены локальным Этическим комитетом (протокол № 7-2017 от 14 января 2017 г.).
На первом этапе исследования лабораторным мышам, самцам и самкам, по 6 животных каждого пола в группе, однократно подкожно в область холки или внутривенно в хвостовую вену вводили исследуемую готовую лекарственную форму карбамилированного дарбэпоэтина (ГЛФ CDEPO) в дозах 1000, 2000, 3000, 4000 и 5000 мкг/кг подкожно и 500, 1000, 1500, 2000, 2500 мкг/кг внутривенно. Контрольной группе воду раствор плацебо (буфер для приготовления готовой лекарственной формы) вводили однократно в эквивалентном объеме. Дозы были выбраны с учетом максимального объема вещества, разрешенного к введению мышам подкожно и внутривенно. Для исследуемого вещества максимальная доза составила для мышей 1 мл (100 мкг действующего вещества на 0,02 кг массы тела, или 5000 мкг/кг) при подкожном введении и 0,5 мл (50 мкг действующего вещества на 0,02 кг массы тела, или 2500 мкг/кг) при внутривенном введении. Исследуемое вещество вводили в готовой лекарственной форме.
В связи с отсутствием летальности животных на первом этапе исследования вторым этапом было проведено исследование острой токсичности на белых лабораторных крысах. Крысам однократно, по 6 животных каждого пола в группе, подкожно в область холки или внутривенно в хвостовую вену вводили исследуемое вещество в максимально допустимом объеме для подкожного введения 10 мл и 2 мл для внутривенного введения, что в пересчете на действующее вещество составило 5000 мкг/кг (10 мл по 100 мкг/мл = 1000 мкг действующего вещества на 0,2 кг массы тела животного, или 5000 мкг/кг) и 1000 мкг/кг (2 мл по 100 мкг/мл = 200 мкг действующего вещества на 0,2 кг массы тела животного, или 1000 мкг/кг) соответственно. Контрольной группе воду для инъекций вводили однократно в эквивалентном объеме. Исследуемое вещество вводили в готовой лекарственной форме.
В течение двух недель проводили мониторинг массы тела, потребления корма, оценку клинических признаков. Для оценки поведенческой активности использовались установка Harvard Apparaturs LE 8825 (Panlab) и оригинальное программное обеспечение Actitrack v2.7. На 15-е сутки эксперимента проводили эвтаназию животных и аутопсию места подкожного введения веществ. Для исследования местнораздражающего действия исследовались кожа и мышцы в месте введения. Для оценки состояния красного кровяного ростка было проведено цитологическое исследование крови и мазков костного мозга. По выживаемости и общему состоянию животных судили о токсическом действии исследуемого вещества. Оценка выживаемости проводилась в течение 3 суток после затравки. Расчет среднего арифметического и стандартной ошибки среднего значения осуществляли в программе MS Excel 2016. Оценку распределения проводили по критериям Шапиро–Уилка и Колмогорова–Смирнова. Межгрупповое статистическое сравнение осуществляли при помощи критерия Краскела–Уоллиса с подтестом Дана. Для статистического сравнения повторяющихся измерений применялся дисперсионный анализ. Различия были определены при 0,05 уровне значимости в программе GraphPad Prism 5.0.
Результаты исследования и их обсуждение
Проведенные исследования показали, что после однократного подкожного либо внутривенного введения лабораторным мышам и белым лабораторным крысам готовой лекарственной формы «карбамилированный дарбэпоэтин» (ООО «Фармапарк», Россия) в изучаемых дозах ухудшения общего состояния и гибели животных не наблюдалось.
После однократного внутривенного введения исследуемого вещества в максимальных дозах как у лабораторных мышей, так и у крыс наблюдалось снижение двигательной активности. Животные становились вялыми, апатичными, сонливыми. Данные изменения наблюдались в течение получаса от момента введения исследуемого вещества как в экспериментальных, так и в контрольных группах, что позволяет предположить их связь с одномоментным болюсным введением большого объема жидкости. Через 30 мин после введения исследуемого вещества в максимальных дозах поведение животных не отличалось от поведения животных всех остальных групп.
Особенностей поведения у опытных крыс и мышей других групп в первые 4 часа после острого введения вещества, отличных от контрольных животных, отмечено не было. При сравнении двигательной активности животных в тесте актиметрии на инфракрасном мониторе активности IR Actimeter достоверных отличий между опытной и контрольной группой установлено не было (табл. 1).
Таблица 1
Оценка поведенческой активности животных в тесте актиметрии, усл. ед. активности, рассчитываемые по встроенному в программу Actitrack v2.7 инструменту «Total Activiti» (М±m; n=6)
|
Критерии |
Группы |
|
|
Контроль |
Опыт |
|
|
Общая активность |
14006±1889 |
13586±48* |
|
Стереотипы движения |
239±62 |
298±41* |
|
Максимальная скорость |
67±19 |
96±26* |
Примечание:* (p>0,05) в сравнении с животными контрольной группы.
Интенсивность и характер двигательной активности не менялись в течение эксперимента. Судороги отсутствовали у всех животных, находившихся под наблюдением. Координация движений и тонус скелетных мышц у крыс и мышей в опытных группах не нарушались в течение первых 4 часов эксперимента и в течение последующего 14-дневного периода наблюдения и не отличались от соответствующих показателей контрольных животных. Отклонений в потреблении корма и воды не наблюдалось. Динамика массы тела и средние значения массы внутренних органов в опытных группах не имели статистически достоверных отличий от значений в соответствующих группах контроля (рис. 1, табл. 2)
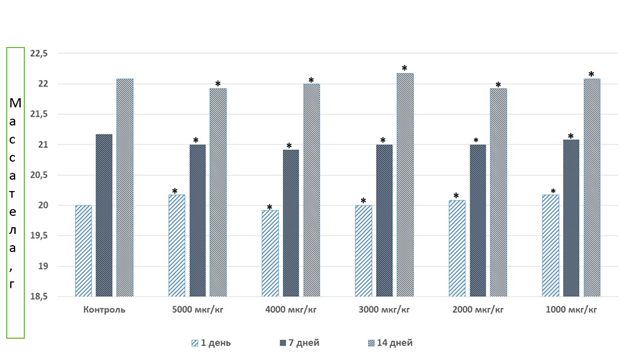
Примечание: * – отсутствие статистически значимых различий с группой контроля (p>0,2)
Рис. 1. Динамика массы тела мышей после однократного подкожного введения карбамилированного дарбэпоэтина (ООО «Фармапарк», Россия)
Таблица 2
Динамика массы внутренних органов мышей после однократного подкожного введения карбамилированного дарбэпоэтина (ООО «Фармапарк», Россия)
|
Масса органа на 14-е сутки |
|||||||
|
Группа |
Печень, мг |
Селезенка, мг |
Почки, мг |
Сердце, мг |
Легкие, мг |
Тимус, мг |
Мозг, мг |
|
Подкожное введение |
|||||||
|
5000 мкг/кг |
1213±40 |
49,6±2,7 |
228,1±8,1 |
128,5±26,5 |
130,9±1,8 |
27,2±2,5 |
425,3±4,4 |
|
4000 мкг/кг |
1202±30 |
49,3±3,6 |
220,8±7,7 |
121,5±4,5 |
131,1±1,3 |
25,8±3,1 |
426,6±4,4 |
|
3000 мкг/кг |
1200±28 |
50,4±3,3 |
227,1±7,1 |
123,6±3,6 |
132,3 ±1,5 |
26,8±2,9 |
426,6±3,8 |
|
2000 мкг/кг |
1197±25 |
50,9±2,6 |
221,6±9,4 |
122,5±3,5 |
132,8±1,3 |
26,5±2,4 |
426,4±3,4 |
|
1000 мкг/кг |
1200±29 |
51,1±3,0 |
224,3±11,8 |
120,7±4,7 |
133,1±1,2 |
26,2±2,9 |
423,1±3,2 |
|
Контроль |
1205±324 |
50,2±4,3 |
226,4±9,7 |
122,3±5,3 |
130,3±1,8 |
26,7±3,1 |
425,4±4,9 |
|
Внутривенное введение |
|||||||
|
2500 мкг/кг |
1198,6±18,1 |
54,1±1,1 |
229,5±4,2 |
125,8±2,6 |
128,9±2,8 |
26,8±1,8 |
425,1±2,8 |
|
2000 мкг/кг |
1194,0±8,8 |
53,8±1,8 |
227,4±3,3 |
126,1±1,83 |
130,8±2,8 |
26,3±1,7 |
427,8±2,9 |
|
1500 мкг/кг |
1199,3±23,2 |
53,4±1,5 |
225,3±2,7 |
126,3±2,4 |
131,1±3,2 |
28,0±1,5 |
426,0±4,3 |
|
1000 мкг/кг |
1203,6±12,1 |
54,2±1,5 |
226,9±2,9 |
124,0±1,2 |
131,3±2,9 |
27,3±1,7 |
424,8±2,7 |
|
500 мкг/кг |
1207,0±9,9 |
54,1±1,0 |
228,5±3,7 |
125,2±3,4 |
128,4±2,4 |
25,9±2,4 |
427,0±3,8 |
|
Контроль |
1197,1±21,0 |
53,6±0,9 |
228,3±4,3 |
123,3±1,9 |
129,8±2,9 |
27,5±2,1 |
427,3±2,9 |
Макро- и микроскопическое исследование внутренних органов выявило картину, соответствующую норме, как в опытной, так и в контрольной группе (рис. 2, 3). Гистологическое исследование места инъекции у мышей и крыс, которым ГЛФ CDEPO вводили подкожно, не выявило признаков патологических изменений и морфологических отличий от контрольной группы (рис. 2, 3)
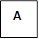
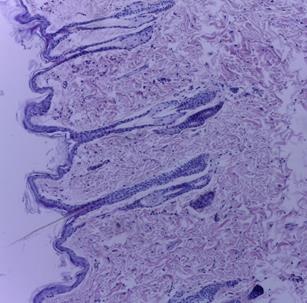
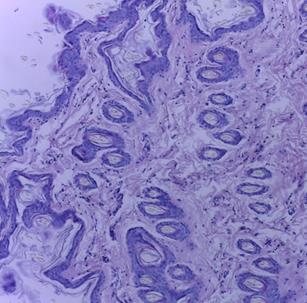

Рис. 2. Гистологическая картина кожи крыс. А – кожа крысы из группы контроля;
Б – кожа крысы, получавшей подкожно ГЛФ CDEPO (ООО «Фармапарк», Россия) в дозе 5000 мкг/кг. Окр. гематоксилином и эозином. х100
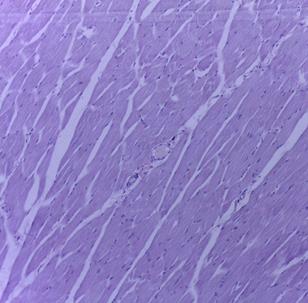
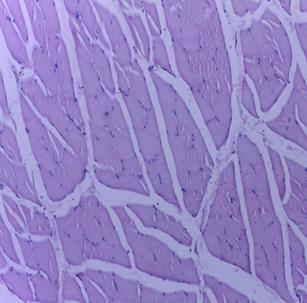

Рис. 3. Гистологическая картина скелетной мышцы крыс. А – мышца крысы из группы контроля; Б – мышца крысы, получавшей подкожно ГЛФ CDEPO (ООО «Фармапарк», Россия) в дозе 5000 мкг/кг. Окр. гематоксилином и эозином. х100
При цитологическом исследовании мазка костного мозга в соотношении нормобластов, пронормобластов, моноцитов, сегментоядерных эозинофилов, эозинофильных миелоцитов, сегментоядерных нейтрофилов, палочкоядерных нейтрофилов и нейтрофильных миелоцитов отличий в сравнении с контрольной группой не выявлено.
Исследование периферической крови показало, что в контрольной серии экспериментов число эритроцитов, ретикулоцитов и содержание гемоглобина в периферической крови крыс в среднем соответствовало нормальному уровню этих показателей в периферической крови данного вида животных.
Заключение
Проведенное исследование показало, что ГЛФ CDEPO (ООО «Фармапарк», Россия) при подкожном введении в дозах от 1000 мкг/кг до 5000 мкг/кг и внутривенном введении в дозе от 500 мкг/кг до 2500 мкг/кг не проявляет токсических свойств и не связан с летальностью у белых лабораторных мышей. Применение исследуемого ГЛФ CDEPO у белых лабораторных крыс в дозах 5000 мкг подкожно и 1000 мкг внутривенно сопровождалось 100%-ной выживаемостью в остром периоде (14 дней) и не приводило к макро- и микроскопическим изменениям со стороны внутренних органов, а также тканей в области инъекции. Состояние красного кровяного ростка также не претерпевало значимых изменений, что свидетельствует об отсутствии влияния ГЛФ CDEPO на эритропоэз.
На основании результатов проведенных экспериментальных исследований острой токсичности ГЛФ CDEPO карбамилированный дарбэпоэтин, раствор для инъекций (ООО «Фармапарк», Россия) можно отнести:
1) по классификации Globally Harmonised System (GHS) – к категории 5 GHS;
2) по классификации Hodge и Sterner – к классу 4 (малотоксично);
3) по классификации – к классу 5 (практически нетоксично);
4) по классификации ГОСТ 12.1.007-76 – к 3-му классу токсичности (умеренно опасно).
Определенные ограничения накладывают: растворимость лекарственной формы (высокомолекулярный белок), содержание активного вещества в объеме (особенности вспомогательных веществ), предельно допустимые объемы введения для данного вида лабораторных животных, что заведомо не позволит достичь максимальных доз, приемлемых для изучения острой токсичности [14].



