Вопрос послеоперационных вентральных грыж традиционно актуален для современной хирургической практики: проблема их эффективного лечения все еще актуальна. Также не разрешена проблема подбора экономически целесообразной методики лечения вентральных грыж [1; 2]. Существует более чем 150 способов пластики грыжевых дефектов, но даже такое количество методов не гарантирует отсутствие рецидивов, возникающих в 13-35% случаев [3].
Послеоперационные вентральные грыжи в структуре грыж передней брюшной стенки находятся на втором месте после паховых грыж. Возникновение их наблюдается примерно в 8-16% случаев после осуществления лапаротомных операций, проводимых по поводу иных патологий в брюшной полости. Большое количество клинических исследований, осуществленных за последние пятнадцать лет, обозначают количество послеоперационных вентральных грыж в пределах от 53 до 79% от общего количества вентральных грыж. Причиной этого является не только увеличение общего количества хирургических вмешательств на органах брюшной полости, но и увеличение количества работ, посвященных системному анализу всех имеющихся сведений [4; 5].
Так как материал, из которого изготавливаются герниоэндопротезы, является чужеродным для организма, то в зоне имплантации возникает локальное асептическое воспаление, препятствующее процессу нормального заживления послеоперационной раны и надежной фиксации импланта [6].
Несмотря на использование материалов, применение которых раньше в хирургии не представлялось возможным, исходы лечения грыж передней брюшной стенки сложно назвать удовлетворительными. Значительность воспалительных явлений в области грыжевых ворот выражается в результатах, которые не дают нам право называть аутопластику эффективным методом лечения данной патологии [4; 7; 8].
Первоначально введенные в хирургическую практику искусственные материалы вызывали чрезмерный иммунный ответ, что, по всей видимости, можно объяснить неудовлетворительными характеристиками самого материала, служившего основой эндопротеза, и одновременно отсутствием технической и теоретической баз выполнения операций с использованием имплантов [2; 5]. Хотя отрицательные результаты способствовали некоторому затиханию интереса научного сообщества к такого рода способу решения проблемы, исследования не были прекращены, и с момента первого применения герниоэндопротезы претерпели значительные изменения. Производители имплантов с учетом клинической практики совершенствуют имеющиеся эндопротезы, улучшая их характеристики и свойства [2; 8]. Имплант нового поколения представлен разработкой компании Covidien – эндопротез Parietene ProGrip. Он представляет собой полурассасывающийся, самофиксирующийся герниоэндопротез с размером пор, обеспечивающим оптимальное прорастание его соединительной тканью [7; 9; 10].
Концепция нарушения синтеза коллагена является базовой в современном представлении научного сообщества о грыжеобразовании. Диспропорция между коллагеном I и III типов является причиной ухудшения прочностных характеристик брюшной стенки, что негативно сказывается на ее механической функции [5; 6; 8].
Таким образом, конечного результата, удовлетворяющего потребностям современной абдоминальной хирургии, до сих пор не получено. Поиск способов превентивного лечения грыж передней брюшной стенки, а также разработка эффективного герниоэндопротеза для этих целей остаются актуальными целями [2]. Параллельно с этим существует задача поиска лекарственного препарата, имеющего способность к уменьшению экссудативных проявлений и ускорению наступления пролиферативной фазы воспалительной реакции в месте имплантации герниоэндопротеза для ускорения регенерации и улучшения качества прочности соединительной ткани; изучения и внедрения способа коррекции коллагенообразования, необходимого для стимуляции образования зрелого соединительного волокна [11; 12]. Решение перечисленных вопросов даст возможность снизить количество рецидивов и улучшить прогноз лечения вентральных грыж.
Целью данного исследования являлась оценка гистологических изменений в зоне имплантации герниоэндопротеза «Эсфил» с обработкой препаратом «Солкосерил».
Материал и методы исследования. Экспериментальная часть исследования выполнялась на 80 мышах мужского пола линии Vistar (по 40 мышей в каждой группе) средним весом 30 граммов. Исключение самок было необходимо для предотвращения беременности и исключения возможной разницы в гормональном фоне.
В эксперименте проводилась имплантация герниоэндопротеза «Эсфил», разработанного совместно с фирмой ООО «Линтекс» (г. Санкт-Петербург), при этом производилось деление на группы:
группа № 1 – без использования препарата «Солкосерил» (контрольная группа);
группа № 2 – с использованием препарата «Солкосерил».
«Эсфил» – сетка-эндопротез, предназначенная для укрепления мягких тканей, испытывающих максимальную нагрузку, при оперативном лечении грыж различных локализаций, после удаления опухолей, при повреждениях грудной стенки и в других областях пластической хирургии. Имплантированные эндопротезы-сетки служат каркасом для прорастания тканей и придают им дополнительную прочность во время и после заживления.
«Солкосерил» – препарат, представляющий собой депротеинизированный гемодиализат, содержащий широкий спектр низкомолекулярных компонентов клеточной массы и сыворотки крови молочных телят с молекулярной массой 5000 D, изготовленный компанией MEDA Pharmaceuticals Switzerland GmbH (Швейцария).
Эксперимент осуществлялся на базе НИИ экологической медицины ФГБОУ ВО «Курский государственный медицинский университет» в операционной лабораторного блока. Экспериментальное исследование на лабораторных животных проводилось в полном соответствии с Конвенцией Совета Европы от 1986 г. (Страсбург). Помимо этого выполнялись все Директивы Совета 86/609/ЕЕС от 24.11.86. по согласованию законов, правил и административных распоряжений стран–участниц в отношении защиты животных, применяемых в экспериментальных исследованиях.
Крысам по переднебоковой поверхности производился разрез кожи длиной 15 мм, после чего при помощи сосудистого зажима производилось разделение кожи и подкожно-жировой клетчатки от нижележащих мышц передней брюшной стенки. В образовавшемся пространстве размещали имплант размерами 10*5 мм, без его фиксации, таким образом, чтобы его края не попадали в рану. Это условие было необходимо для предупреждения повреждения импланта животными. Имплантация осуществлялась исследователями таким образом с целью моделирования пластики по методике on-lay. После имплантации рана ушивалась тремя или четырьмя узловыми швами (шовный материал – крученая капроновая нить). Животным интраоперационно 50%-ным раствором депротеинизированного гемодиализата обрабатывался имплант, а также область вокруг протеза. После этого раствор вводился интраперитонеально по 0.1 мл с помощью инсулинового шприца. Введение препарата производилось в течение 90 дней один раз в двое суток. Животные выводились из эксперимента на 10, 30, 60 и 90-е сутки. На указанных сроках после передозировки эфирного наркоза выполнялось иссечение тканей передней брюшной стенки, вместе с мышцами и имплантом. Полученный фрагмент размерами 15*15 мм помещали в емкость с 10%-ным раствором формалина. Данный материал заключали в парафиновые блоки, из которых получали срезы толщиной 4-5 мкм. Для определения характера и количества клеточных элементов применялась окраска гематоксилин-эозином.
Для выяснения микроструктурных характеристик нами был использован микроскоп «Альтами ПОЛАР 2» (ООО «Альтами», Российская Федерация, г. Санкт-Петербург), увеличение объективов которого составляло х25 и х40; увеличение окуляра х10. Окуляр имел вставку размерами 1*1 мм, ограничивающую поле зрения. Микрофотографии были получены с помощью цифровой окулярной камеры Altami USB 3150R6 1/2CMOS (CMOS матрица 3 Мпикс). При исследовании гистологических срезов в каждом изучали 10 «стандартных полей зрения». На каждом этапе выводили от 6 до 7 экспериментальных животных. Это было необходимо для получения статистически достоверных (p<0,05) результатов исследования. Для установления точного клеточного состава ткани в околопротезной капсуле подсчитывали следующие клетки: макрофагов, фибробластов, нейтрофилов и лимфоцитов. Изучение данных клеточных элементов и выражение их количества в относительных единицах давали возможность определить тип и фазу воспалительного процесса, его интенсивность, что позволяет судить о биосовместимости конкретного импланта, а также влиянии на этот процесс добавляемого лекарственного вещества. В качестве программной среды для обработки статистических данных использовали программы Statistica (версия 6.0) и Biostatistics (версия 4.03), с помощью которых производился подсчет среднего арифметического числа и среднеквадратичного отклонения.
Результаты исследования и их обсуждение. Характеристика клеточного состава в области расположения импланта из группы № 1 представлена в таблице 1.
Таблица 1
Клеточный состав области расположения герниоэндопротеза из группы № 1
|
Клетки (%) Сутки |
Фибробласты |
Макрофаги |
Лимфоциты |
Нейтрофилы |
|
10 |
63,1±1,15 |
6,0±0,59 |
18,0±1,08 |
20,4±0,61 |
|
30 |
66,2±1,08* |
6,1±0,75* |
16,3±0,65* |
15,2±0,74* |
|
60 |
70,2±1,34* |
5,8±0,44 |
16,0±0,73 |
8,0±0,42* |
|
90 |
71,8±1,53 |
5,5±0,57 |
16,6±0,52 |
6,1±0,59* |
Примечание: * – критерий достоверности р<0,05 при сравнении c предыдущим сроком эксперимента между одним и тем же типом клеток.
На 10-е сутки качественное соотношение клеточного состава отражает процесс перехода экссудативной стадии воспаления в пролиферативную. Фибробласты составляют основное вещество соединительной ткани, образуются тонкие соединительнотканные волокна в стенках пор и около них. Новые соединительнотканные структуры врастают в толщу протеза между его нитями, формируя ячейки.
На 30-е сутки происходит дальнейшее снижение количества лимфоцитов (16,3±0,65 против 18,0±1,08) и нейтрофилов (15,2±0,74 против 20,4±0,61). Такое отношение элементов морфологической картины свидетельствует о продолжающемся окончании экссудативной фазы воспаления в области расположения импланта. Отмечается возрастание количества фибробластов (66,2±1,08 против 63,1±1,15), что говорит о дальнейшем развитии пролиферации в месте имплантации герниоэндопротеза. При гистологическом исследовании определяются новообразовывающиеся соединительнотканные волокна и зрелые фибробласты в стенках пор, имеются единичные воспалительные клеточные инфильтраты, скопления гигантских многоядерных клеток инородных тел (рис. 1). Был отмечен значительный отек, имеющий тенденцию к уменьшению, а также рыхлое сращение молодой соединительной ткани с окружающими гистологическими структурами, ведущие к их разделению.
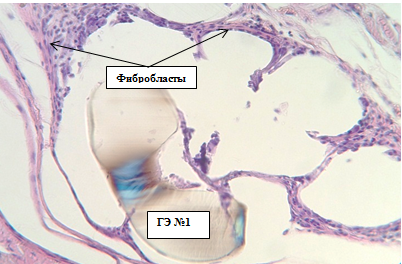
Рис. 1. Световая микроскопия места размещения герниоэндопротеза группы № 1 на 30-е сутки: соединительнотканные волокна и фибробласты в стенках ячеек, очаговые скопления воспалительных клеток. Окр. Г+Э. Световая микроскопия. Ув. х250
К 60-м суткам в морфологической картине тканей около герниоэндопротеза преобладают зрелые фибробласты (70,2±1,34), количество которых достоверно растет в сравнении с предыдущими сроками, достоверно уменьшается относительное количество нейтрофилов (8,0±0,42). Обнаруживаются гигантские клетки инородных тел.
Морфологическая картина капсул, состоящих из соединительной ткани, около нитей герниоэндопротеза представлена внутренним слоем немногочисленных фибробластов и различной толщины и зрелости изоморфными соединительнотканными тяжами, многослойно лежащими вокруг. Внешний слой капсул состоит из самых крупных и сформированных волокон. Межъячеечное пространство занято слабоструктурированной соединительной тканью с весомым количеством разной степени зрелости фибробластов, что может говорить о развитом процессе организации в месте имплантации протеза.
К 90-м суткам морфологическая картина продолжает меняться в сторону уменьшения количества экссудативно-воспалительных и увеличения количества соединительнотканных клеточных и межклеточных структур (рис. 2). «Клетки воспаления» представлены малочисленными нейтрофилами (6,1±0,59); тем не менее удельное количество лимфоцитов достоверно не уменьшается (16,6±0,52), что наряду с наличием гигантских клеток инородных тел свидетельствует о продолжающейся иммунной реакции на импланты группы № 1. Гистологическая картина свидетельствует о развитии соединительнотканной капсулы вокруг места имплантации – организации ткани внутреннего и внешнего слоев, наличии единичных зрелых фибробластов.
Таким образом, к 90-м суткам не достигнуты удовлетворительные показатели иммунного ответа организма подопытного животного на герниоэндопротез.
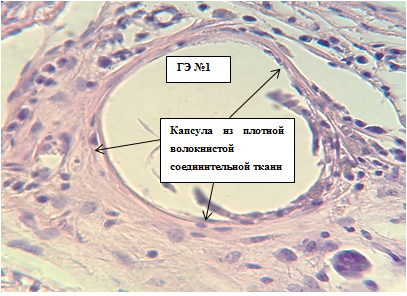
Рис. 2. Световая микроскопия места размещения герниоэндопротеза № 1 на 90-е сутки: плотная волокнистая соединительная ткань формирует капсулы вокруг нитей герниоэндопротеза, единичные гигантские клетки инородных тел. Окр. Г+Э.
Световая микроскопия. Ув. х400
Характеристика клеточного состава в области расположения импланта из группы № 2 представлена в таблице 2.
Таблица 2
Клеточный состав области расположения герниоэндопротеза из группы № 2
|
Клетки (%) Сутки |
Фибробласты |
Макрофаги |
Лимфоциты |
Нейтрофилы |
|
10 |
65,83±1,12* |
4,63±0,64* |
18,39±1,11* |
11,15±0,43* |
|
30 |
68,24±1,17* |
2,85±0,72* |
22,46±1,21* |
6,45±0,31* |
|
60 |
73,5±1,09* |
2,8±0,51 |
18,77±0,93* |
4,93±0,48* |
|
90 |
76,15±1,46* |
2,1±0,47 |
17,7±0,59 |
3,7±0,33* |
Примечание: * – критерий достоверности р<0,05 при сравнении c предыдущим сроком эксперимента между одним и тем же типом клеток.
К 10-м суткам ячейки имеют полностью оформленную, круглую форму. Контуры ячеек вокруг волокон импланта без интервалов (рис. 3), ячейки сформированы из тонких стенок, состоящих из внутреннего (фибробласты) и наружного (молодые волокна соединительной ткани) слоев.

Рис. 3. Световая микроскопия места размещения герниоэндопротеза № 2 при применении депротеинизированного гемодиализата на 10-е сутки: непрерывные контуры ячеек, фибробласты во внутреннем слое стенок ячейки, большое скопление фибробластов в окружающей ячейки ткани. Окр. Г+Э. Световая микроскопия. Ув. х250
Пространство между ячейками заполнено свежей грануляционной тканью, в морфологический состав которой входят лимфоциты, макрофаги и фибробласты (табл. 2). Имеются волокнистые соединительнотканные структуры в границах ячеек и тонкие волокна вокруг них, встречаются немногочисленные гигантские клетки инородных тел.
На 30-й день после имплантации наблюдается процесс стихания отечной фазы воспаления. Структурные волокна протеза располагаются в закругленных обособленных секциях.
Наблюдается процесс постепенного созревания соединительной ткани капсулы вокруг импланта, который можно описать как структурирование ранее разрозненных пучков. Увеличивается количество фибробластов в капсуле.
Зафиксировано уменьшение количества воспалительноклеточных элементов. Относительное количество нейтрофилов ниже примерно в два раза, нежели в группе № 1 (6,45% и 15,2% соответственно), что свидетельствует об эффективном подавлении воспалительной реакции с помощью депротеинизированного диализата. Преобладают зрелые фибробласты и фиброциты (68,24%), в меньшей степени представлены лимфоциты и макрофаги (табл. 1), имеются небольшие скопления гигантских клеток инородных тел.
К 60-м суткам основными морфологическими структурами являются фиброциты и фибробласты (73,5%).
В стенках ячеек по-прежнему встречаются отдельные гигантские клетки инородных тел. Соединительнотканные волокна соединены в плотные, толстые пучки.
Процентное соотношение лимфоцитов несколько больше, чем на аналогичных сроках в группе № 1, что, вместе с наличием гигантских клеток инородных тел, говорит о том, что в месте имплантации проходит пролиферативная фаза воспаления с выраженной гранулематозной реакцией на ксеноматериал.
В дальнейшем количество клеточных элементов, характерных для экссудативной фазы воспаления, продолжает неуклонно снижаться, и к 90-м суткам относительное количество нейтрофилов составляет 3,7%, что приблизительно в два раза меньше, чем при использовании герниоэндопротеза из группы № 1. Наблюдаются лишь единичные гигантские клетки инородных тел.
Капсулы ячеек вокруг нитей импланта объединены плотными толстыми изоморфными пучками соединительнотканных волокон в виде цепочек (рис. 4).
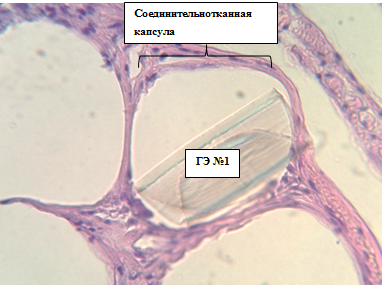
Рис. 4. Световая микроскопия места размещения герниоэндопротеза № 2 при применении депротеинизированного гемодиализата на 90-е сутки: прочная сетчатая соединительнотканная структура создает каркас для нитей эндопротеза. Окр. Г+Э. Световая микроскопия. Ув. х400
Относительное количество фибробластов и фиброцитов увеличивается (76,15%) в сравнении как с предыдущими сроками в пределах данной серии, так и с аналогичными сроками группы исследования при использовании герниоэндопротезов группы № 1 без применения депротеинизированного диализата. Данная морфологическая картина демонстрирует окончание процессов организации (заживления).
Выводы. На основании полученных данных можно с уверенностью сказать, что в группе животных № 2 (с применением депротеинизированного диализата из крови молочных телят) степень выраженности и продолжительность экссудативной фазы воспалительной реакции достоверно меньше, что выражается в количестве клеток на различных этапах процесса заживления (поэтапное уменьшение количества макрофагов и нейтрофилов более чем в 2 раза на каждом из исследуемых сроков). Одновременно с этим пролиферативная и синтетическая активность фибробластов значительно выше, что обусловливает более раннее формирование прочных соединительнотканных капсул вокруг волокон герниоэндопротеза. Такие результаты говорят нам о том, что использование препаратов, стимулирующих коллагеногенез, оправдывается лучшим результатом лечения и снижением вероятности развития постоперационных осложнений. Одновременно с этим необходим дальнейший поиск лекарственных средств, способных продемонстрировать еще лучший результат при их применении.



