Несмотря на существенный прогресс и значимые достижения в онкологии в целом, особенно в эпоху таргетной терапии, в нейроонкологии ситуация более сложная. Самой распространенной первичной злокачественной опухолью центральной нервной системы является глиобластома (ГБ) [1]. Все исследования по разработке и внедрению в клиническую практику препаратов таргетной терапии ранее не увенчались успехом [2]. Одной из возможных причин подобных трудностей в разработке лечебных подходов могут являться глиомные стволовые клетки (ГСК). ГСК, как и неопухолевые стволовые клетки, способны к самообновлению и могут давать начало различным клеткам-предшественникам, а также более дифференцированным клеточным линиям [3].
Генетические, эпигенетические и протеомические свойства ГСК схожи с молекулярными свойствами нейрональных стволовых клеток [4]. Многие авторы полагают, что именно ГСК являются главными виновниками нечувствительности опухоли к химиотерапии и лучевой терапии, а также служат одной из основных причин рецидивирования злокачественных глиом после хирургического лечения [5].
Полногеномное профилирование позволило выделить два различных подтипа ГСК: пронейральный и мезенхимальный [6]. Мезенхимальные ГСК в основном возникают в первичных ГБ, тогда как пронейральные ГСК могут обнаруживаться в некоторых глиомах Grade III по ВОЗ и ГБ, хотя в данном случае возможны выраженные фенотипические сдвиги между различными подтипами ГСК в ходе прогрессирования ГБ [6; 7]. Пронейрональные ГСК могут приобретать терапевтическую устойчивость и более агрессивные характеристики путем смещения их молекулярного и фенотипического подтипа в сторону мезенхимальных ГСК [7]. Данные недавних исследований свидетельствуют о том, что этот сдвиг вызывает увеличение инвазивности и ангиогенного потенциала опухоли по сравнению с пронейральными ГСК [6]. Мезенхимальные ГСК заметно более устойчивы к воздействию лучевой терапии по сравнению с их пронейральными аналогами, и воздействие лучевой терапии на пронейральные ГСК активирует экспрессию молекулярных маркеров, связанных с мезенхимальной дифференцировкой, в то же время подавляя маркеры, ассоциированные с пронейральными клетками [6; 7]. При этом маркером пронейрональных ГСК является CD133, в то время как важнейшим маркером мезенхимальных ГСК служит CD109 [8; 9].
Ранее в наших предыдущих исследованиях нам удалось с применением методик кластерного анализа и собственных алгоритмов обработки комплексных изображений выделить в ткани ГБ пять клеточных кластеров на основе оценки пролиферативной и антиапоптозной активности. В их число вошли перинекротический кластер (ПНК), расположенный вокруг зоны некрозов, транзиторный некротический кластер (ТНК), непосредственно окружающий ПНК, периваскулярный кластер (ПВК), расположенный вокруг сосудов, транзиторный васкулярный кластер (ТВК), находящийся вокруг ПВК, и промежуточный кластер (ПК), располагающийся в зоне между 4 другими кластерами [10].
Цель исследования: изучить пространственное распределение пронейрональных и мезенхимальных ГСК, используя их маркеры CD133 и CD109, в различных кластерах, описанных нами ранее в ГБ. Также мы решили оценить влияние иммунофлуоресцентной выраженности экспрессии CD133 и CD109 как в опухоли в целом, так и в каждом кластере в отдельности на общую выживаемость пациентов с ГБ.
Материал и методы исследования
Группа исследования
В рамках ретроспективного исследования были изучены 48 образцов опухолей от пациентов с установленным диагнозом ГБ без выявленных мутаций в генах IDH1 и IDH2 (WHO Grade IV). Все пациенты, включенные в исследование, проходили хирургическое лечение в ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» в 2012-2014 годах. Гены IDH1 и IDH2 на предмет наличия мутационных изменений исследовались с помощью методов прямого секвенирования и полимеразной цепной реакции с ДНК-зондами. Для подсчета показателей общей выживаемости все пациенты проходили динамическое наблюдение в течение 5 лет.
Иммуногистохимическое исследование
Парафиновые блоки с фиксированными в них образцами опухолей использовали для изготовления срезов 3 микрометра толщиной. Далее проводили депарафинирование с помощью ксилола и гидратирование с применением различных концентраций спиртов, срезы высушивали в термостате при 45 °C. После этого стекла со срезами последовательно инкубировали с кроличьими моноклональными антителами против антигена Ki-67 человека (CONFIRM anti-Ki67, «Roche-Ventana»), мышиными моноклональными антителами против антигена человека Bcl-2 (CONFIRM anti-bcl-2, «Roche-Ventana»), мышиными моноклональными антителами против антигена человека BCL6 (клон GI191E/A8, Cell Marque, «Sigma-Aldrich», США), и после этого конъюгировали с антикроличьими мышиными (в случае с Ki-67) и антимышиными кроличьими (в случае Bcl-2 и BCL6) IgG антителами против пероксидазы хрена. Сайты связывания антител визуализировали с использованием тетрагидрохлорида 3,3'-диаминобензидина (Ventana Medical Systems, США), ядра клеток окрашивали гематоксилином.
Первичный анализ изображений
Препараты тщательно отцифровывались с помощью сканера Aperio AT2 (Leica Biosystems, GmbH). Затем все изображения в формате SVS максимально точно сопоставлялись по координатным и топографическим данным с получением сложных комплексных файлов с использованием программного обеспечения Aperio ImageScope (Leica Biosystems, GmbH), ImageJ (Национальный институт здравоохранения, США) и QuPath (University of Edinburgh, Division of Pathology, Великобритания). Далее данные комплексные файлы, содержащие комплексные изображения, подвергались медианной фильтрации для модификации цветового диапазона с помощью программного обеспечения ImageJ, Adobe Photoshop (Adobe Systems, США) и QuPath. Также использовалось нерезкое маскирование всех изображений с применением программного обеспечения Aperio ImageScope, ImageJ и QuPath. С использованием программных алгоритмов и под контролем оператора выделялись границы сосудов и некрозов в опухолевых образцах. Далее производился кластерный анализ комплексных файлов и изображений по методу k-средних с применением программного обеспечения Matlab (The MathWorks, США) и SPSS Statistics 23 (IBM, США). В основе процесса кластеризации лежал ранее использованный алгоритм, основанный на определении для каждого пикселя в изображении показателей в семивекторной системе, учитывающей координатное положение пикселя, расстояние пикселя до края сосуда и некроза, значения показателей цветности по шкале RGB. Характеристики цветности рассчитывались и интерпретировались по разработанной и описанной нами ранее методике [11]. Применяя данный алгоритм, проводили определение пяти ранее описанных кластеров в каждом образце опухоли.
Иммунофлуоресцентное исследование
Также образцы были подвергнуты иммунофлуоресцентному исследованию. Из парафиновых блоков с фиксированными в них образцами опухоли изготавливали серийные срезы толщиной 3 микрометра с одинаковой ориентацией изучаемого фрагмента ткани. Сначала образцы депарафинировали и регидратировали, последовательно погружая предметные стекла в ксилол, 100, 95, 70, 50%-ный этанол, деионизированную воду. Срезы высушивали в термостате при 45 °C. Затем срезы инкубировали с первичными моноклональными антителами к CD133 (Sigma-Aldrich, США) и первичными моноклональными антителами к CD109 (Sigma-Aldrich, США), разведенными в 1%-ном растворе PBS при комнатной температуре, в течение 1–2 часов. Затем образцы в течение ночи инкубировали при 4 °С во влажной камере. После этого срезы дважды промывали с 1%-ным раствором PBS-T в течение 10 минут. Далее добавляли флуоресцентную метку конъюгированного вторичного антитела, разведенного в 1%-ном растворе PBS, и инкубировали при комнатной температуре в течение 1–2 часов. Далее срезы дважды промывали с 1% PBS-T в течение 10 минут. Затем наносили краситель DAPI. После инкубации с красителем слайды промывали один раз в течение 5 минут с PBS.
Вторичный анализ флуоресцентных изображений
Все флуоресцентные препараты отцифровывались с применением сканера стекол Aperio VERSA (Leica Biosystems, GmbH) в флуоресцентном режиме. Проводилось сопоставление данных изображений с комплексными изображениями, полученными на предыдущих этапах, с выделением кластеров в флуоресцентных изображениях с применением программного обеспечения Matlab и SPSS Statistics 23. Затем проводился автоматизированный подсчет процента клеток, экспрессирующих CD133 (ПКл CD133) и CD109 (ПКл CD109), в препарате в целом и в отдельных кластерах в ткани ГБ с вычислением средних значений для каждого кластера.
Статистика
Статистический анализ полученных данных проводился с помощью программного обеспечения SPSS Statistics 23 и STATISTICA 8 (StatSoft, США). Средние значения ПК CD133 и ПК CD109 подвергались сравнению между различными кластерами, и проводилась оценка значимости данных различий с использованием U-критерия Манна-Уитни. Также для выявления влияния АЭ CD133 в опухоли в целом и в различных кластерах на прогноз общей выживаемости пациентов применялся регрессионный анализ по методу Кокса с подсчетом отношения рисков (ОР). Различия считали значимыми при p<0.05%.
Результаты исследования и их обсуждение
Общая статистика исследованной группы
В группе исследования средний возраст пациентов на момент операции составлял 58.16±2.58 года. По гендерному составу преобладали мужчины в 58.33%, женщины составили 41.67% исследованных. Наиболее часто встречались опухоли височной доли, они выявлялись в 35.42% случаев, за ними следовали опухоли лобной доли, что составило 25% случаев, опухоли теменной доли обнаруживались в 22.92% случаев, опухоли затылочной доли встречались в 14.58%, и 2.08% опухолей выявлялись в стволе. Общая пятилетняя выживаемость составила 4.17% (рис. 1).
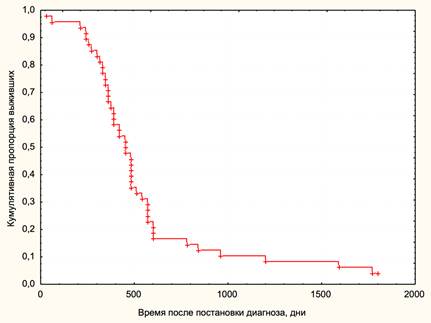
Рис. 1. Кривая Каплана-Майера общей выживаемости пациентов, включенных в исследование. По оси ординат обозначена кумулятивная пропорция выживших, по оси абсцисс – время от постановки диагноза в днях
Распределение пронейрональных ГСК в различных кластерах в ГБ
Сравнительный анализ средних значений ПКл CD133 показал, что самое высокое содержание данного типа клеток выявляется в ПВК и составляет 38.43±2.65%. Далее по значениям ПКл CD133 следует ТВК, в котором данный показатель составляет 28.11±1.96%. За ним расположился ПК с показателями ПКл CD133, составляющими 18.14±2.6%. Наиболее низкие значения ПКл CD133 наблюдались в ПНК и ТНК, в которых они составляли 2.87±1.16% и 4.14±1.23% соответственно (рис. 2).
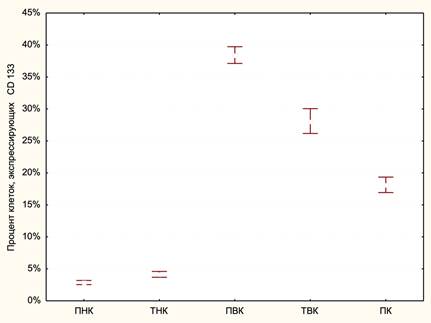
Рис. 2. Распределение нейрональных глиомных стволовых клеток в различных кластерах глиобластомы. По оси ординат приведено значение процента клеток, экпрессирующих маркер CD133, по оси абсцисс обозначены пять кластеров, в том числе перинекротический (ПНК), транзиторный некротический (ТНК), периваскулярный (ПВК), транзиторный васкулярный (ТВК) и периферический кластеры (ПК)
При этом необходимо отметить, что значения ПКл CD133 статистически значимо различались между всеми кластерами (табл. 1).
Таблица 1
Сравнение средних значений процента клеток, экспрессирующих маркер CD133, в различных кластерах в глиобластоме
|
Кластеры |
ПНК |
ТНК |
ПВК |
ТВК |
ПК |
|
ПНК |
- |
p=0.000023; Z=8.37 |
p=0.00007; Z=8.44 |
p=0.000012; Z=8.42 |
p=0.000081; Z=8.44 |
|
ТНК |
p=0.0056; Z=4.37 |
- |
p=0.000018; Z=8.41 |
p=0.000061; Z=8.43 |
p=0.000078; Z=8.43 |
|
ПВК |
p=0.000063; Z=8.44 |
p=0.000042; Z=8.41 |
- |
p=0.000578; Z=6.75 |
p=0.000034; Z=8.44 |
|
ТВК |
p=0.000021; Z=8.42 |
p=0.00001; Z=8.43 |
p=0.00042; Z=6.75 |
- |
p=0.00056; Z=6.72 |
|
ПК |
p=0.000048; Z=8.44 |
p=0.000068; Z=8.43 |
p=0.000084; Z=8.44 |
p=0.00048; Z=6.72 |
- |
Примечание. Различия между всеми кластерами были статистически значимыми.
Наличие мезенхимальных ГСК в различных кластерах в ГБ
При рассмотрении распределения клеток, экспрессирующих маркер CD109, было выявлено, что наиболее высокий ПКл CD109 наблюдается в ТНК, где он составил 44.22±2.54. Затем по уровню ПКл CD109 следуют ПВК и ТВК, в которых средние значения ПКл CD 109 являются близкими и составляют 18.15±1.54% и 16.59±1.75%. Несколько меньшие показатели ПКл CD109 наблюдаются в ПНК, в котором он составляет 12.62±2.61%. Самые низкие значения ПКл CD109 наблюдаются в ПК и составляют в среднем 10.41±2.64% (рис. 3).
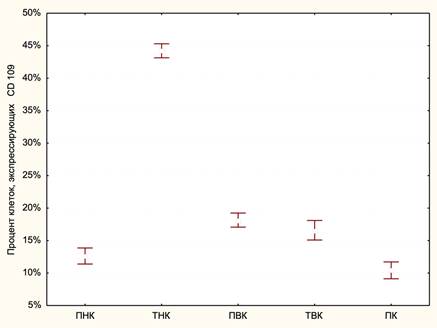
Рис. 3. Распределение мезенхимальных глиомных стволовых клеток в различных кластерах глиобластомы. По оси ординат приведено значение процента клеток, экпрессирующих маркер CD109, по оси абсцисс обозначены пять кластеров, в том числе перинекротический (ПНК), транзиторный некротический (ТНК), периваскулярный (ПВК), транзиторный васкулярный (ТВК) и периферический кластеры (ПК)
При проведении межкластерных сравнений средних значений ПК CD109 было выявлено, что показатели ПК CD109 статистически значимо различаются между большинством кластеров за исключением ПВК и ТВК (табл. 2).
Таблица 2
Сравнение средних значений процента клеток, экспрессирующих маркер CD109, в различных кластерах в глиобластоме
|
Кластеры |
ПНК |
ТНК |
ПВК |
ТВК |
ПК |
|
ПНК |
- |
p=0.00008; Z=8.44 |
p=0.00086; Z=5.72 |
p=0.0009; Z=3.53 |
p=0.01; Z=2.56 |
|
ТНК |
p=0.000043; Z=8.44 |
- |
p=0.000028; Z=8.44 |
p=0.000016; Z=8.44 |
p=0.000034; Z=8.44 |
|
ПВК |
p=0.00017; Z=5.72 |
p=0.000042; Z=8.44 |
- |
p=0.121; Z=6.75 |
p=0.00056; Z=6.69 |
|
ТВК |
p=0.0006; Z=3.53 |
p=0.000084; Z=8.44 |
p=0.121; Z=6.75 |
- |
p=0.00042; Z=5.23 |
|
ПК |
p=0.01; Z=2.56 |
p=0.000031; Z=8.44 |
p=0.00081; Z=6.69 |
p=0.00041; Z=5.23 |
- |
Примечание. Статистически значимые различия выделены красным цветом.
Преобладающие типы ГСК в различных кластерах
При проведении дополнительного анализа по преобладанию одного из типов ГСК в различных кластерах в ГБ, было выявлено, что пронейрональные ГСК статистически значимо чаще встречаются, нежели мезенхимальные ГСК в ПВК (p<0.001; Z=8.44), ТВК (p<0.001; Z=6.93) и ПК (p<0.001; Z=6.6). При этом мезенхимальные ГСК наблюдаются чаще пронейрональных ГСК в ПНК (p<0.001; Z=8.24) и ТНК (p<0.001; Z=8.44). Таким образом, ПВК, ТВК и ПК характеризуются преобладанием пронейрональных ГСК, в то время как ПНК и ТНК отличаются преобладанием мезенхимальных ГСК.
Влияние активности экспрессии CD133 и CD 109 на прогноз пациентов
В ходе проведения регрессионного анализа было выявлено, что ПК CD133 при подсчете его в опухоли в целом не влияет на общую выживаемость пациентов с ГБ. Дифференцированный подход к определению влияния ПК CD 133, подсчитанного отдельно в каждом кластере, на прогноз показал, что ПК CD 133 только в ПВК значимо влияет на общую выживаемость пациентов с ГБ (табл. 3).
Что касается мезенхимальных ГСК, то было выявлено, что ПК CD 109 в опухоли в целом не влияет значимо на общую выживаемость. При этом раздельная оценка влияния значений ПК CD 109 в каждом кластере на прогноз пациентов выявила, что ПК CD109 только в ТНК значимо влияет на общую выживаемость пациентов (табл. 3).
Таблица 3
Влияние значений процента клеток, экспрессирующих маркеры CD133 и CD109, на показатели общей выживаемости пациентов в опухоли в целом и в различных кластерах в глиобластоме
|
Кластеры |
ПНК |
ТНК |
ПВК |
ТВК |
ПК |
Опухоль в целом |
|
CD133 |
p=0.326; ОР=1.15 |
p=0.175; ОР=0.87 |
p=0.003; ОР=1.11 |
p=0.262; ОР=0.97 |
p=0.401; ОР=0.98 |
p=0.468; ОР=1.08 |
|
CD109 |
p=0.271; ОР=1.04 |
p=0.000016; ОР=1.24 |
p=0.274; ОР=0.96 |
p=0.25; ОР=1.04 |
p=0.611; ОР=1.02 |
p=0.061; ОР=1.19 |
Примечание. В соответствующих ячейках таблицы приведены значения p и отношения рисков (ОР). Влияние на общую выживаемость оценивалось с помощью регрессии Кокса, статистически значимые параметры выделены красным цветом.
Полученные нами результаты демонстрируют неоднородность распределения различных типов ГСК в разных клеточных кластерах в ГБ. Пронейрональные ГСК формируют стволовый пул опухолевых клеток-предшественников в области периваскулярной ниши. Это обуславливает самую высокую степень пролиферативной активности в данной области, входящей в состав ПВК, что нашло свое подтверждение в нашем первом исследовании по данной тематике [10]. Хорошо известно, что пронейрональные ГСК обладают повышенной подвижностью и инвазивностью, они могут распространяться в мозговой ткани на достаточно большие расстояния, мигрируя в ранее непораженные зоны мозговой ткани [12]. Далее они активно пролиферируют и увеличивают опухолевую массу на данном участке. Важнейшим фактором, обеспечивающим подобную экспансию опухоли, являются новообразованные опухолевые сосуды, появляющиеся в результате процессов неоангиогенеза, активное участие в реализации и инициации которых также принимают пронейрональные ГСК [13]. Это создает благоприятные условия для дальнейшей опухолевой прогрессии, однако с ростом числа опухолевых клеток в данной зоне и увеличением общей потребности ткани в кислороде и питательных веществах появляется и нарастает состояние гипоксии. Это ещё больше повышает нагрузку на неполноценные в структурном и функциональном плане опухолевые сосуды и приводит к повреждению их эндотелия, что влечет за собой развитие многочисленных тромбозов [14]. Это еще больше усиливает гипоксические условия и стимулирует опухолевые клетки в данной зоне, в том числе клетки со стволовыми свойствами, к выраженной фенотипической трансформации, способствующей выживанию опухолевых клеток и сохранению ими свойств злокачественности. В конечном счете дальнейшее прогрессирование прогипоксических изменений приводит к гибели части опухолевых клеток и возникновению некроза, при этом клетки в перинекротической зоне продолжают оставаться в условиях выраженной гипоксии.
Наши результаты показывают, что в ходе этого патогенетического процесса на уровне ГСК происходит фенотипический сдвиг в сторону мезенхимального типа. При этом мезенхимальные ГСК сохраняют высокую подвижность и инвазивность, присущую опухолевым клеткам со стволовыми свойствами, и перемещаются из зон вокруг некрозов, соответствующих ПНК, в соседние участки, менее подверженные гипоксическим изменениям и входящие в состав ТНК. Это позволяет не только эффективно бороться с нарастающими гипоксическими условиями, но и сохранить стволовые свойства и пролиферативный потенциал опухоли, что также было доказано нашим предшествующим исследованием. В нем мы показали, что ТНК обладает вторым по степени выраженности пролиферативным потенциалом в ткани ГБ после ПВК [10].
Мезенхимальные ГСК, подверженные действию гипоксии, активно экспрессируют прогипоксический транскрипционный фактор HIF1a, что в свою очередь индуцирует продукцию ими ангиогенных факторов [14]. Это запускает процессы неоангиогенеза в данной зоне и приводит к появлению новообразованных сосудов, что существенно улучшает условия снабжения кислородом и питательными веществами опухолевых клеток, в том числе мезенхимальных ГСК. Это, в свою очередь, приводит к очередному проявлению фенотипической пластичности ГСК – они вновь претерпевают трансформацию в пронейрональные ГСК. Тем не менее любопытен тот факт, что при значительном преобладании пронейрональных ГСК в ПВК, там же обнаруживаются и небольшие, но четко определяемые количества мезенхимальных ГСК. Это может быть связано с несколькими факторами. ПВК является самым пролиферативно активным клеточным кластером в ГБ, поэтому в нем при высокой потребности в кислороде и большом содержании ГСК часть клеток может находиться в выраженно гипоксических условиях вследствие того, что кислородных и питательных ресурсов всем клеткам не хватает. Это может приводить к тому, что часть клеток сохраняет мезенхимальный профиль или переключается на него повторно.
При этом клинические данные показывают, что процентное содержание различных типов ГСК в тех кластерах, в которых они преобладают, то есть ПВК для пронейрональных ГСК и ТНК для мезенхимальных ГСК, значимо взаимосвязано с прогнозом общей выживаемости пациентов. Причем наиболее выраженно на прогноз влияют не пронейрональные ГСК, а мезенхимальные ГСК. С чем же это может быть связано? Как уже указывалось выше, мезенхимальные ГСК имеют большую устойчивость не только к воздействию гипоксии, но и ряда других повреждающих факторов, причем не только эндогенного, но и экзогенного генеза, в том числе к лечебным воздействиям. Так, показано, что мезенхимальный фенотип в ГБ может существенно повышать устойчивость к применению химиотерапии и лучевой терапии.
Заключение
Таким образом, основываясь на наших результатах и литературных данных, мы формулируем новую патогенетическую концепцию. Она важна не только для улучшения понимания механизмов канцерогенеза ГБ, но и имеет непосредственное практическое применение, причем как в диагностической, так и в лечебной плоскости: прецизионная оценка молекулярных свойств отдельных клеточных кластеров и популяций, а также их терапевтическое таргетирование открывают широчайшие перспективы в разработке новых, более эффективных персонализированных подходов к диагностике и лечению ГБ.



