Туберкулез является одним из наиболее часто встречающихся инфекционных заболеваний в мире. Российская Федерация входит в 30 стран с наибольшим бременем туберкулеза. Включение России в данный список обусловлено существенным возросшим абсолютным числом новых зарегистрированных случаев и рецидивов туберкулеза в течение 2015 года – 115 тысяч [1, с. 7-16]. В настоящее время в Российской Федерации наблюдается улучшение эпидемической обстановки по туберкулезу, о чем свидетельствует положительная динамика основных показателей. Так, по данным Федеральной службы государственной статистики, с 2005 по 2017 год отмечается тенденция к снижению заболеваемости туберкулезом – с 84,7 до 48,3 человека на 100 тыс. населения (на 42,9%), к снижению показателя смертности от туберкулеза – с 22,5 до 12,1 человека на 100 тыс. населения (на 46,2%) [2, с. 22, 35]. Наряду с этим происходит увеличение доли пациентов с множественной (МЛУ) и широкой лекарственной устойчивостью (ШЛУ) возбудителя к противотуберкулезным препаратам (ПТП) с 23,4% в 2008 г. до 54,0% в 2017 г. [3, с. 15-24]. Следует отметить, что проблема устойчивости микобактерии туберкулёза (МБТ) к ПТП является глобальной проблемой, однако наибольшим бременем проблема МЛУ ложится на три страны: Индию, Китай и Российскую Федерацию, на долю которых в совокупности приходится почти половина всех случаев в мире [4].
Приобретение МБТ устойчивости к антибиотикам, как и других бактерий, может развиваться посредством случайных мутаций и/или благодаря воздействию антибактериальных препаратов. В связи с этим первоначально был рекомендован комбинированный прием препаратов для снижения риска развития лекарственной устойчивости сразу к нескольким из них. Однако лечение туберкулеза осуществлялось без предшествующего определения лекарственной чувствительности МБТ к ПТП. Незавершенное или неадекватное предыдущее лечение (например, лечение недостаточными дозами препаратов первого ряда), а также использование некачественных ПТП явилось одной из причин формирования лекарственной устойчивости возбудителя. Основой резистентности МБТ к ПТП являются спонтанные точечные мутации в специфических независимых генах. В свою очередь, неадекватное воздействие ПТП на популяцию МБТ обеспечивает селективный отбор резистентных штаммов [5, с. 7].
Помимо возникновения точечных мутаций в генах существуют и других механизмы формирования резистентности, такие как модификация молекул антибиотиков ферментными системами бактерий, гиперэкспрессия эффлюксных систем и белков, участвующих в нейтрализации действия препарата, изменения белков-поринов в клеточной стенке, изменение проницаемости клеточной стенки и другие [6, с. 1229-1238].
Исследователями были получены данные о гиперэкспрессии белков Rv0148 (редуктаза короткоцепочечного типа), Rv1876 (бактериоферритин) и Rv3841 (ферритин) у МБТ, устойчивых к аминогликозидам. В частности, белок Rv0148 имеет домен SDR, который способен связывать аминогликозиды, приводя к их нейтрализации. Амикацин и канамицин также способны связываться с бактериоферритиновым доменом Rv1876 и ферритиновым доменом Rv3841. Следовательно, избыточная экспрессия этих белков может нейтрализовать эффект аминогликозидов и играть роль в возникновении лекарственной устойчивости [7, с. 1-9].
Эффлюксные системы играют важную роль в устойчивости бактерий к лекарственным препаратам. Одним из видов эффлюксных насосов являются ABC-транспортеры, которые состоят из белков-экспортеров и белков-импортеров. Экспортеры ответственны за транспортировку различных субстратов, таких как антибиотики, белки и липиды, в то время как импортеры транспортируют широкий спектр субстратов, включая аминокислоты, пептиды, сахара, металлы и другие метаболиты. МБТ с МЛУ экспрессируют большое количество АBC-транспортеров, что приводит к снижению концентрации препарата внутри клетки и в совокупности с другими механизмами позволяет бактериям достигать значительной устойчивости к лекарственным средствам [8, с. 248-261].
Цель исследования: проанализировать динамику формирования лекарственной устойчивости (ЛУ) МБТ, выделенных из мокроты больных впервые выявленным туберкулезом легких в Республике Мордовия в период за 2014-2018 годы.
Материалы и методы исследования. Объектом исследования явились 534 штамма M. tuberculosis, выделенные от впервые выявленных, ранее не леченных больных туберкулезом (n=534). Все пациенты проходили обследование с января 2014 г. по декабрь 2018 г. в ГКУЗ Республики Мордовия «Республиканский противотуберкулезный диспансер» г. Саранска. Определение лекарственной устойчивости штаммов МБТ, выделенных из мокроты впервые выявленных больных туберкулезом, к ПТП проводилось методом пропорций на жидкой среде в автоматизированном анализаторе с флуоресцентной детекцией результата - Bactec MGIT 960 и методом абсолютных концентраций на среде Левенштейна-Йенсена. Показатели рассчитывались от количества культур, исследованных на лекарственную чувствительность. Обработку результатов проводили с помощью программы Microsoft Office Excel.
Результаты исследования и их обсуждение. Всего за 2014-2018 гг. в Республике Мордовия выявлено 1342 случая туберкулеза легких, при этом минимальное количество случаев зарегистрировано в 2018 г. (239 случаев), а максимальное - в 2017 г. (299 случаев). Выделение МБТ за весь период наблюдения составило 534 случая (39,8%). Было установлено, что более половины культур МБТ (53,6%) были чувствительны к ПТП.
ЛУ хотя бы к одному ПТП за пять лет составила 45,9%, имела тенденцию к снижению и колебалась по годам от 42,0% (2017 г.) до 48,2% (2016 г.). Аналогичные результаты по Республике Мордовия были получены и в предыдущие годы. Это позволяет выразить надежду по стабилизации ситуации с ЛУ МБТ. Такие же данные опубликованы и по другим субъектам РФ [9; 10].
Монорезистентность обнаружена у 7,7% культур МБТ, обследованных на лекарственную чувствительность, полирезистентность (ЛУ к 2 и более ПТП, но не к сочетанию изониазида и рифампицина) в 11,5% культур. При анализе динамики ЛУ за анализируемый период установлено, что монорезистентность изменялась от 4,5% (2016 г.) до 13,3% (2018 г.). По структуре ЛУ МБТ среди монорезистентных культур в 58,5% случаев определялась к изониазиду, в 34,2% - к стрептомицину, к этамбутолу – 7,3% (выделено три указанные культуры МБТ в 2014, 2017, 2018 гг.). Анализируя полирезистентность МБТ, была отмечена тенденция к снижению от 33,3% в 2015 г. до 4,8% в 2018 г.
ЛУ к двум ПТП, включая изониазид и другие (без рифампицина), за весь период составила 8,9%, имела тенденцию к снижению от 11,5% в 2014 г. до 2,2% в 2018 г. ЛУ к сочетанию изониазида и стрептомицина составила 8,3% и снижалась от 11,5% в 2014 г. до 0% в 2018 г. ЛУ к сочетанию изониазида и этамбутола составила за весь период 0,4% и регистрировалась только в 2016 и 2018 гг. ЛУ к трем ПТП, включая изониазид и другие (без рифампицина), установлена в 1,9% выделенных за пять лет культур, данный показатель был наибольшим в 2016 г. – 9,4%, в 2018 г. – не выявлялся. ЛУ к сочетанию изониазида, стрептомицина и этамбутола выявлена в 1,3% выделенных МБТ, изониазида, стрептомицина и пиразинамида - 0,6%, данные показатели регистрировались ежегодно и не превышали 2,7% выделенных МБТ. ЛУ к четырем ПТП, включая изониазид и другие (без рифампицина), выявлена в двух культурах МБТ (0,4%), выделенных в 2016 г. (изониазид, капреомицин, этамбутол, пиразинамид – 0,9%) и в 2017 г. (изониазид, капреомицин, этамбутол, пиразинамид - 1,0%). ЛУ к пяти ПТП, включая изониазид и другие (без рифампицина), зарегистрирована у 1 культуры МБТ (0,2%), выделенной в 2015 г., сочетание ПТП – изониазида, стрептомицина, этамбутола, циклосерина, аминосалициловой кислоты – 0,8%. ЛУ к шести ПТП, включая изониазид и другие (без рифампицина), установлена у 1 культуры МБТ (0,2%) при сочетании изониазида, стрептомицина, этамбутола, канамицина, этионамида, пиразинамида в 2014 г. – 0,9%. ЛУ к сочетанию рифампицина и других ПТП (без изониазида) составила за анализируемый период 0,2% и была выявлена в 1 случае в 2014 г. ЛУ к двум ПТП, включая рифампицин и другие ПТП (без изониазида), составила за анализируемый период 0,2% и была выявлена в 1 случае в 2014 г. при сочетании рифампицина и стрептомицина. Культуры МБТ, устойчивые к сочетаниям 3, 4, 5, 6 ПТП, включая рифампицин и другие ПТП (без изониазида), за анализируемый период не выделялись.
Согласно современным клиническим рекомендациям МЛУ МБТ определяется как устойчивость возбудителя как к изониазиду, так и рифампицину, вне зависимости от устойчивости к другим ПТП. Культуры МЛУ (устойчивые к изониазиду, рифампицину и другим ПТП) составили за 2014-2018 гг. 17,9% от выделенных МБТ по годам имели незначительную тенденцию к росту и изменялись от 16,7% в 2018 г. до 20% в 2017 г. (рисунок).
Так, МЛУ к трем ПТП (изониазид, рифампицин и другие ПТП) выявлена у 9,6% культур МБТ, данный показатель колебался от 6,4% в 2016 г. до 13,3% в 2018 г. Чаще всего МЛУ определяли как сочетание изониазида, рифампицина и стрептомицина у 7,3% культур МБТ, по годам изменялась от 3,3% в 2018 г. до 11,9% в 2015 г. МЛУ к сочетанию изониазида, рифампицина, этамбутола составила за пять лет 2,3% и регистрировалась в 2017 г. (3%) и в 2018 г. (10%).
МЛУ к четырем ПТП (изониазид, рифампицин и другие ПТП) регистрировалась в 4,3% культур МБТ, по годам увеличивалась от 0% в 2018 г. до 7,0% в 2017 г. МЛУ к изониазиду, рифампицину, стрептомицину, этамбутолу составила за пять лет 3,6%, по годам увеличивалась от 0% (2018 г.) до 5,9% (2015 г.). Наблюдалась МЛУ к сочетанию изониазида, рифампицина, стрептомицина, пиразинамида по 0,6% случаев (2014, 2016, 2017 гг.) и 0,2% культур в 2017 г.; сочетанию изониазида, рифампицина, стрептомицина, этамбутола - 0,4% в 2017 г.; сочетанию изониазида, рифампицина, стрептомицина, этамбутола, пиразидамида – 1,7% культур МБТ, выявленных в 2014, 2016 и 2017 гг.; сочетанию изониазида, рифампицина, стрептомицина, циклосерина, пиразинамида – 0,2% в 2017 г.
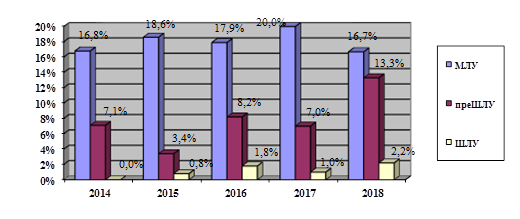
Динамика выявления МЛУ, преШЛУ, ШЛУ, за 2014-2018 гг.
Предширокая лекарственная устойчивость микобактерий туберкулеза (преШЛУ) представляет собой такой вид лекарственной устойчивости, при которой определяется устойчивость МБТ не только к изониазиду и рифампицину, но и к фторхинолону или аминогликозиду/полипептиду (канамицин и/или амикацин и/или капреомицин) вне зависимости от наличия устойчивости к другим ПТП [5; 11]. ПреШЛУ, устойчивые к изониазиду, рифампицину, офлоксацину, канамицину и/или амикацину и/или капреомицину, регистрировались за пять лет в 7,5% выделенных культур МБТ, при тенденции к увеличению доли этих штаммов, наибольший показатель был отмечен в 2018 г. – 13,3%, наименьший – 3,4% - в 2015 г. (рисунок). ПреШЛУ к трем ПТП выявлена в 0,4% выделенных культур и только в 2018 г., когда отмечена преШЛУ к сочетанию изониазида, рифампицина, канамицина (2,2% выделенных в этот год культур). ПреШЛУ к четырем ПТП выявлена в 1,5% выделенных культур, по годам этот показатель изменялся от 0% (2017 г.) до 3,3% (2018 г.). ПреШЛУ к сочетанию изониазида, рифампицина, стрептомицина, канамицина отмечена только в 2016 г. (0,9%), к сочетанию изониазида, рифампицина, этамбутола, канамицина отмечена в 2018 г. – 3,3%, к сочетанию изониазида, рифампицина, стрептомицина, этамбутола, канамицина отмечена в 2015 г. – 2,5%, к сочетанию изониазида, рифампицина, канамицина, пиразинамида выявлена в 2014 г. – 0,9% культур. ПреШЛУ к пяти ПТП выявлена за анализируемый период в 2,8% выделенных культур МБТ, изменения по годам от 0% (2015 г.) до 4,4% (2018 г.). ПреШЛУ к сочетанию изониазида, рифампицина, стрептомицина, этамбутола, офлоксацина зарегистрирована за пять лет в 0,2% случаев и отмечена только в 2016 г. (1,0%); к сочетанию изониазида, рифампицина, стрептомицина, этамбутола, канамицина - 1,7% (в 2014 г. - 2,7%, 2016 г. - 3,6%, 2017 и 2018 гг. - по 1,0%); к сочетанию изониазида, рифампицина, этамбутола, офлоксацина, канамицина – 0,4%, только в 2018 г. (2,2%); к сочетанию изониазида, рифампицина, стрептомицина, канамицина, пиразинамида – 0,4%, в 2016 г. – 09%, 2017 г. – 1,0%; к сочетанию изониазида, этамбутола, канамицина, капреомицина – 0,2%, только в 2018 г. (1,1%). ПреШЛУ к шести ПТП выявлена за анализируемый период в 2,6% выделенных культур МБТ, изменения по годам от 0,8% (2015 г.) до 5,7% (2016 г.). ПреШЛУ к сочетанию изониазида, рифампицина, стрептомицина, этамбутола, канамицина, капреомицина зарегистрирована за пять лет в 0,2%, отмечена только в 2017 г. (1,0%); к сочетанию изониазида, рифампицина, стрептомицина, этамбутола, канамицина, пиразинамида выявлена в 0,4%, в 2014 г. (1,8%); к сочетанию изониазида, рифампицина, стрептомицина, этамбутола, канамицина, амикацина выявлена в 0,2% в 2015 г. (0,8%); к сочетанию изониазида, рифампицина, стрептомицина, этамбутола, канамицина, этионамида зарегистрирована в 0,6% культур в 2014 г. (1,8%) и 2017 г. (1,0%).
В случае ШЛУ МБТ определяется устойчивость к изониазиду, рифампицину, фторхинолону и аминогликозиду/полипептиду (канамицину и/или амикацину и/или капреомицину) одновременно, независимо от наличия устойчивости к другим ПТП [7; 10]. ШЛУ, устойчивые к изониазиду, рифампицину, офлоксацину, канамицину и/или капреомицину, регистрировались за пять лет в 1,1% (6 культур), указанные МБТ выявлялись в 2015 г. (1 штамм, 0,8%), 2016 г. (2 штамма, 1,8%), 2017 г. (1 штамм – 1,0%), 2018 г. (2 штамм – 2,2%) (рисунок). ШЛУ к четырем ПТП выявлена в 1 случае (0,2%) к сочетанию изониазида, рифампицина, офлоксацина, канамицина в 2018 г. (1,1%). ШЛУ к пяти ПТП выявлена также в 1 случае (0,2%) к сочетанию изониазида, рифампицина, стрептомицина, канамицина в 2017 г. (1,0%). ШЛУ к шести и более ПТП выявлена в 4 случаях (0,8%): к сочетанию изониазида, рифампицина, стрептомицина, канамицина, офлоксацина, амикацина в 2015 г. (0,8%); к сочетанию изониазида, рифампицина, стрептомицина, этамбутола, канамицина, офлоксацина, пиразинамида в 2016 г. (0,9%), к сочетанию изониазида, рифампицина, стрептомицина, этамбутола, канамицина, офлоксацина, этионамида, циклосерина, пиразинамида в 2016 г. (0,9%); к сочетанию изониазида, рифампицина, офлоксацина, капреомицина, аминосалициловой кислоты, пиразинамида в 2018 г. (1,1%).
Другие варианты ЛУ за 2014-2018 годы наблюдались в 2 культурах (0,4%): в 2016 г. к стрептомицину, этамбутолу – в 0,9% культур и в 2017 г. к стрептомицину, пиразинамиду - в 1,1% случаев.
Выводы
1. В настоящее время в Республике Мордовия, как и в целом по Российской Федерации, продолжает оставаться актуальной проблема роста устойчивости МБТ к ПТП, в том числе формирование МЛУ и ШЛУ. Учитывая важность микробиологического мониторинга устойчивости МБТ к ПТП, в Республике Мордовия постоянно проводятся микробиологические исследования биологических субстратов от больных различными формами туберкулеза со статистическим анализом полученных данных.
2. Доля МЛУ МБТ за пятилетний период составила 17,9% без значительной динамики, но увеличивается доля преШЛУ с 7,1% до 13,3% и ШЛУ с 0% до 2,2%.
3. В случае МЛУ чаще всего встречается комбинация таких противотуберкулезных препаратов, как изониазид, рифампицин, стрептомицин, преШЛУ - изониазид, рифампицин, офлоксацин, канамицин и/или амикацин и/или капремицин, а при ШЛУ – сочетание лекарственной устойчивости к изониазиду, рифампицину, офлоксацину, канамицину и/или капремицину.
4. Спектр МЛУ расширяется к четырем препаратам.
5. Отмечено, что устойчивость к резервным ПТП с доминированием резистентности к инъекционным антибиотикам, протионамиду и к этамбутолу наблюдается практически у половины культур МЛУ МБТ.
6. В настоящее время ввиду распространения возбудителя туберкулеза с МЛУ является очевидным проведение дополнительных противоэпидемических мероприятий, а также подбор оптимальных схем химиопрофилактического лечения лиц из групп риска.
Авторы выражают благодарность сотрудникам централизованной бактериологической лаборатории ГКУЗ Республики Мордовия «РПТД» за предоставленную информацию.



