Проблема сохранения и обеспечения общего и репродуктивного здоровья девочек имеет в современных условиях первостепенную важность, так как данная возрастная категория рассматривается мировым сообществом истинным резервом воспроизводства.
На сегодняшний день весьма актуальным является вопрос формирования гиперандрогенных состояний, особенно ранних и начальных их форм, когда патологические процессы еще возможно обратимы, а патогенетически обоснованные лечебно-профилактические мероприятия могут сохранить человеку репродуктивную функцию, возможность снизить риск формирования тяжелых, порой необратимых форм поражений яичников, таких как синдром поликистозных яичников (СПКЯ). В результате клинико-эпидемиологических исследований установлено, что частота развития СПКЯ, а, значит, и связанных с ним репродуктивных и метаболических последствий составляет от 5–10% женщин репродуктивного возраста и достигает 80%, а по некоторым данным, даже 90% всех форм гиперандрогении [1; 2].
Избыточный синтез андрогенов может происходить в яичниках и надпочечниках - двух органах, имеющих общий онтогенез. Система, контролирующая активность продукции стероидов, глюко- и минералокортикоидов, универсальна, однако экспрессия различных подтипов ферментов цитохрома Р450С отличается в гонадах и надпочечниках [3]. Множество работ в области изучения патогенеза СГА было направлено на попытки выделения овариальной и надпочечниковой форм СГА, в том числе у девочек-подростков. Ранее нами была показана ведущая роль андрогенов адреналового происхождения в генезе гиперандрогенных состояний у девочек-подростков [4]. В то же время гипоталамо-гипофизарно-надпочечниковая система является основной структурой, обеспечивающей нейроэндокринную реакцию на стресс [5].
Общеизвестен также феномен тесного взаимодействия и взаимного влияния и гипоталамо-гипофизарно-гонадной системы при стрессе [6; 7]. При этом за пределами научного внимания оставалось комплексное изучение факторов, ведущих к поражению яичников при данном синдроме. К примеру, не определена роль факторов, модулирующих патогенное влияние СГА на яичники в подростковом и юношеском возрасте, в частности, не изучено влияние эмоционального и интеллектуального перенапряжения на клинико-гормональные проявления СГА.
Целью исследования явилось выявление особенностей гормональной реакции на психоэмоциональный стресс у девочек пубертатного возраста с синдромом гиперандрогении.
Для реализации поставленных задач нами было проведено комплексное обследование 125 девочек в возрасте от 14 до 17 лет 11 месяцев, которые были разделены на 2 клинические группы: в I группу вошли 61 девочка-подросток с андрогензависимой дермопатией (акне, гирсутизм) и нормальным менструальным циклом, II группу составили 64 девочки-подростка с андрогензависимой дермопатией (акне, гирсутизм) и нарушениями менструального цикла по типу первичной, вторичной олигоменореи или вторичной аменореи, находившихся на лечении в гинекологическом отделении ФГБОУ ВО «РостГМУ НИИАП» Минздрава России.
С целью оценки адаптационных возможностей организма применялся тест «счёт в уме», который известен как стандартизированный лабораторный стресс-тест, вызывающий измеряемые физиологические изменения. Длительность теста составляла 5 минут, в течение которых испытуемая вычитала из 1000 число 13. Обследование осуществлялось по единому протоколу, включавшему исследование содержания в сыворотке крови базальных и стимулированных в результате теста показателей тестостерона, 17-гидроксипрогестерона, дигидротестостерона, дегидроэпиандростерона, дегидроэпиандростерон-сульфата, андростендиона методом иммуноферментного анализа на 4-5-й день менструального цикла с 8 до 9 часов утра (при помощи заранее установленного кубитального катетера). Родители всех детей, принимавших участие в обследовании, дали письменное информированное согласие. Протокол исследования был одобрен местным локально-этическим комитетом.
Статистическая обработка полученных результатов проводилась с использованием пакета прикладных программ Statistica 6,0. Применяли многофакторный анализ главных компонент и корреляционный анализ по Спирмену. Достоверность показателей определена по коэффициенту Стьюдента (t). За критический уровень значимости принято значение p<0,05.
Результаты исследования и их обсуждение
При исследовании утренних показателей андрогенов и их предшественников (табл. 1) в крови установлено их повышение по сравнению с контрольной группой. При этом в группе с нарушениями менструального цикла было выявлено достоверное повышение уровня всех андрогенов по сравнению с группой контроля, а в I группе статистически значимым по сравнению с контрольной группой признано повышение уровня ДГТ и ДГЭА-С.
Таблица 1
Показатели базального уровня андрогенов у пациенток обследуемых групп
|
Показатели Группы |
17- ОП (нг/мл) |
ДГЭА (нг/мл) |
ДГЭА-С (мкг/мл) |
ДГТ (пг/мл) |
Т (нг/мл) |
|
I группа (n=61) |
1,1±0,23 |
9,8±2,51* |
3,6±0,73* |
410,0±38,6* |
1,25±0,22 |
|
II группа (n=64) |
1,6±0,27* |
13,6±3,42* |
4,9±0,84* |
570,0±75,0*/** |
2,10±0,53*/** |
|
Контрольная группа (n=30) |
0,9±0,12 |
5,70±1,21 |
2,10±0,43 |
240,0±15,5 |
1,10±0,21 |
*- достоверность различий по сравнению с контрольной группой;
** - достоверность различий между группами.
При анализе коэффициента постстрессового/базального уровня адреналовых андрогенов были отмечены статистически значимые различия между показателями 17-ОП во II клинической группе по сравнению с контрольной группой и показателями тестостерона, ДГЭА, ДГЭА-С, ДГТ в I и II группах по сравнению с группой контроля (табл. 2).
Таблица 2
Показатели уровня андрогенов после теста у пациенток обследуемых групп
|
Показатели Группы |
17- ОП (нг/мл) |
ДГЭА (нг/мл) |
ДГЭА-С (мкг/мл) |
ДГТ (пг/мл) |
Т (нг/мл) |
|
I группа (n=61) |
1,28±0,33 |
10,30±2,8* |
3,68±0,42* |
430,5±61,2* |
1,38±0,27 |
|
II группа (n=64) |
2,01±0,62* |
15,8±3,7* |
5,5±0,65* |
663,5±108,6* |
2,62±0,82*/** |
|
Контрольная группа (n=30) |
0,95±0,25 |
6,31±1,66 |
1,91±0,47 |
228,0± 21,5 |
1,10±0,18 |
*- достоверность различий по сравнению с контрольной группой;
** - достоверность различий между группами.
По сравнению с исходными значениями наиболее существенное возрастание показателей изучаемых андрогенов в ходе интеллектуальной нагрузки отмечено у пациентов II группы. Так, уровень у них 17-ОП повысился на 25,6% , ДГЭА – на 16,2%, ДГЭА-С – на 12,2%, ДГТ – на 16,3%, Т – на 23,8%, тогда как у подростков с СГА без нарушений менструального цикла данные показатели возросли соответственно на 16,3, 5,1, 2,2, 4,8, 10,4%. При этом показатели у здоровых девочек в ходе теста менялись незначительно (рис. 1-5).
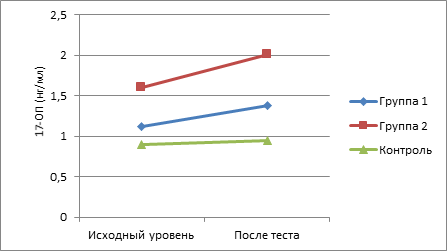
Рис. 1. Динамика показателей 17-ОП в ходе теста у пациенток обследуемых групп
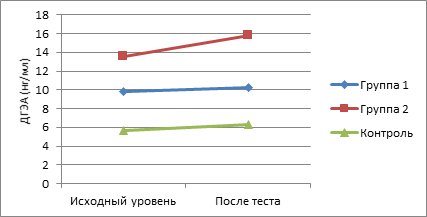
Рис. 2. Динамика показателей ДГЭА в ходе теста у пациенток обследуемых групп
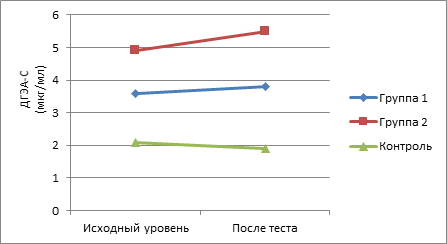
Рис. 3. Динамика показателей ДГЭА-С в ходе теста у пациенток обследуемых групп
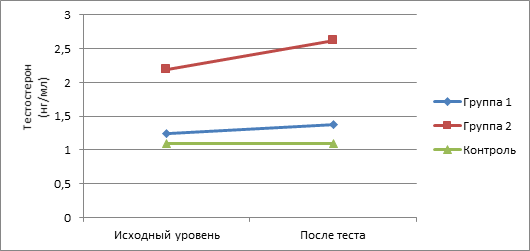
Рис. 4. Динамика показателей Т в ходе теста у пациенток обследуемых групп
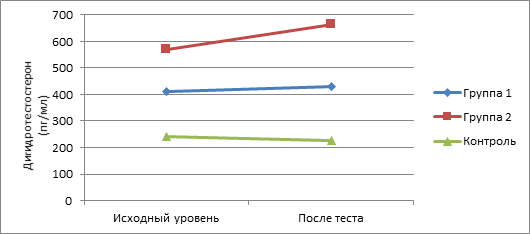
Рис. 5. Динамика показателей ДГТ в ходе теста у пациенток обследуемых групп
Связь между стрессом и усилением секреции адреналовых андрогенов была показана в целом ряде исследований, например, повышение секреции ДГЭА, ДГЭА-С и андростендиона отмечено у постменопаузальных женщин в течение нескольких дней после хирургической операции [8]. Получены данные о повышении уровня ДГЭА в ответ на стрессовую реакцию у женщин с высоким уровнем личностной тревоги, при этом имелись определенные расхождения между секрецией ДГЭА и кортизолом. Многие авторы предположили благотворное действие ДГЭА на чувство благополучия. Эта благотворная роль может быть связана с двойным действием ДГЭА: прямым эффектом, обеспечиваемым его превращением в половые гормоны, и косвенным, опосредованным его конкуренцией с кортизолом, из которых уменьшается его синтез и, следовательно, снижается соответствующая активность [9]. В монографии А. Леннартсон предложено использовать ДГЭА, ДГЭА-С как биологические маркеры стресса, помимо кортизола и других маркеров [10].
При наличии генетических предпосылок, способствующих снижению активности кортизолового звена и усилению активности секреции андрогенов, как у пациентов нашей выборки, можно предположить значимую роль стрессов в инициации и поддержании гиперпродукции андрогенов, в частности ДГЭА.
Согласно данным исследования, проведенного почти у половины пациенток с синдромом гиперандрогении, была выявлена высокая личностная тревожность, тогда как в группе контроля ее частота была незначительной. Является ли повышенная секреция андрогенов в организме фоном, способствующим изменению течения нервных процессов, или, напротив, конституционально обусловленное снижение стрессоустойчивости организма способствует повышению активности гипоталамо-гипофизарно-адреналовой системы и усиливает активность звена, продуцирующего андрогены под воздействием кортикотропин рилизинг гормона и АКТГ, - вопрос остается открытым. Выявленные ранее в нашем исследовании корреляции уровня тревожности с уровнем адренокортикотропного гормона, пролактином, а в группе с нарушениями цикла – также с антимюллеровым гормоном и увеличением объема яичников, доказывают наличие возможной взаимосвязи между эмоциональной нестабильностью и развитием овариальной дисфункции [11].
Согласно нашим данным, полученным в ходе теста, у пациенток с СГА отмечалось более значимое повышение уровня андрогенов по сравнению с контрольной группой, именно в позициях, касающихся адреналовых андрогенов – ДГЭА, ДГЭА-С, 17-ОП, причем у пациенток с нарушениями цикла это повышение было более выраженным, нежели у подростков с СГА без клинических признаков овариальной дисфункции. Следовательно, можно предполагать, что наличие психотравмирующей ситуации у подростков с гиперандрогенией может явиться фактором, усугубляющим повышенную секрецию адреналовых андрогенов и становиться пусковым и поддерживающим фактором формирования овариальной дисфункции. Действительно выраженные нарушения эмоционального фона сопровождают овариальную дисфункцию примерно у половины пациенток с СПКЯ [12]. Возможное снижение толерантности к стрессу может быть важным фактором, предрасполагающим к проявлению овариальной дисфункции у части пациенток с СГА.
Результаты данного фрагмента исследования поднимают некоторые философские вопросы о социальном звучании проблемы гиперандрогении. Возрастание количества пациенток с патологией, ассоциированной с гиперандрогенией, которое мы наблюдаем в наше время, с одной стороны, может быть обусловлено накоплением и распространением в популяции генетических мутаций, ведущих к проявлению СГА. Данный феномен может быть обусловлен определенными успехами как в консервативном лечении гиперандрогении, так и современными достижениями в области вспомогательных репродуктивных технологий, позволившими большему количеству женщин с СГА осуществлять репродуктивную задачу и, следовательно, приумножать количество людей с соответствующими генетическими особенностями. Но, с другой стороны, увеличение стрессовой нагрузки современной жизни ведет к повышению давления хронического психоэмоционального перенапряжения на биологические основы женского организма, что может, на наш взгляд, являться основным триггером, запускающим каскад гипоталамо-гипофизарно-надпочечниковых реакций, ведущих к гиперсекреции андрогенов.
Полученные данные свидетельствует, что особенности реагирования на стресс пациенток с СГА следует учитывать при диагностике и лечении данного состояния. Представляется целесообразным включение в схему лечения пациентов с СГА препаратов, улучшающих состояние психоэмоционального фона, а также психологической коррекции, повышающей стрессоустойчивость организма. Знание этих аспектов поможет улучшить результаты диагностики и лечения пациенток с СГА, профилактируя исходы данного состояния в тяжелые формы овариальной дисфункции.
Таким образом, у пациенток с СГА в результате проведения стандартизированного лабораторного стресс-теста «счет в уме» отмечалось достоверное возрастание уровня андрогенов в крови по сравнению с условно здоровыми подростками. У пациенток с СГА и нарушением менструального цикла как исходные показатели, так и степень их возрастания в ходе теста были существенно выше, чем в группе подростков без клинических признаков овариальной дисфункции. Полученные данные свидетельствуют об избыточной нейроэндокринной стрессовой активации у подростков с СГА, вероятно, как вследствие генетически запрограммированных особенностей реагирования гипоталамо-гипофизарно-адреналовой оси, так и вследствие сниженной толерантности к стрессу данного контингента пациентов.



