Колоректальный рак занимает лидирующие позиции по заболеваемости у мужчин и женщин во всём мире, ассоциирован с высоким риском отдалённого метастазирования, плохим прогнозом и является третьим по причине смерти от онкологических заболеваний [1]. Несмотря на увеличение числа пациентов с ранним выявлением опухоли и появление новых лекарственных препаратов – количество пациентов с распространёнными формами заболевания остаётся стабильно высоким [2]. В настоящее время отсутствует описанный механизм прогрессии, метастазирования и развития резистентности при колоректальном раке. Таким образом, поиск предиктивных маркеров прогрессии и рецидивирования колоректального рака является одной из приоритетных задач исследований в онкологии [2-4].
Семейство РНК-связывающих белков Musashi (MSI) выступает в роли посттрансляционных репрессоров таргетной мРНК и включает в себя два гомолога, MSI-1 и MSI-2 [4]. Ген MSI-2 у человека располагается в 17q22 и кодирует соответствующий РНК-связывающий белок, представленный в пуле стволовых клеток нервной, гемопоэтической и эпителиальной ткани [5]. В процессе эмбриогенеза MSI-2 участвует в регуляции пролиферации и дифференцировки нервной и гемопоэтической систем [6]. Впервые сверхэкспрессия MSI-2 в злокачественном процессе была показана на мышиной модели хронического миелоидного лейкоза в 2010 году [7]. Повышенная экспрессия MSI-2 вызывала резистентность к паклитакселу in vitro в клетках рака яичника [8]. Позже было показано влияние MSI-2 на агрессивное течение рака молочной железы [4], трансформацию интраэпителиальной панкреатической неоплазии (PanIN) в протоковую аденокарциному поджелудочной железы [9].
Цель исследования: изучение роли РНК–связывающего белка MSI-2 в развитии и метастазировании КРР.
Материалы и методы исследования
Пациенты и гистологический материал
Гистологический материал был получен от 25 пациентов с гистологически верифицированным КРР, имеющих синхронные резектабельные метастазы в печень и перенесших резекцию первичной опухоли и резекцию метастатического очага в клинике Ростовского научно-исследовательского онкологического института с 2013 по 2017 год. Средний возраст пациентов составил 52,2 года (33-71 год), в гендерном соотношении преобладали мужчины – 14 пациентов (56%), распространенность опухоли - Т чаще была представлена только IV и III, 13 (52%) и 12 (48%) пациентов соответственно, поражение лимфатических узлов представлено N1 у 10 (40%) и N2 у 15 (60%). Степень дифференцировки опухоли в 11 (44%) случаях была низкой и в 14 (56%) умеренной. Локализация первичной опухоли была преимущественно левосторонняя – 16 (64%) пациентов, против правосторонней - у 9 (36%) пациентов. Никто из данных пациентов не получал предоперационную лекарственную или лучевую терапию. Общая и безрецидивная выживаемость определялась у пациентов с момента выполнения оперативного вмешательства.
Тканевые матрицы и ИГХ-окрашивание
Ткани нормального эпителия толстой кишки, первичной опухоли и метастатического очага были зафиксированы формальдегидом и погружены в парафин, затем при помощи тканевого 3 мм интродьюсера (Тed Pella, США) в предварительно изготовленную 36-луночную «донорскую» парафиновую форму с лунками диаметром 3 мм были введены столбики ткани из парафиновых блоков - «реципиентов». Далее «донорский» блок с образцами тканей нарезали и фиксировали на предметном стекле. ИГХ–окрашивание выполняли с использованием антитела к MSI-2 (ab50829, Abcam, США), в соответствии с инструкцией производителя.
Оценка ИГХ-окрашивания
Окрашенные препараты сканировались на рабочей станции Leica Aperio. Оценку ИГХ-экспрессии MSI-2 проводили два патолога с использованием полуколичественного метода H-score, при котором уровень экспрессии определяется по формуле: [1× (% клеток 1+) + 2 × (% клеток 2+) + 3 × (% клеток 3+)] и варьируется от 0 до 300 баллов [10].
Статистический анализ
Полученные данные оценивали с использованием статистического программного обеспечения SPSS (Version 20, IBM Inc., США). Корреляция клинико-патологических факторов и экспрессии MSI-2 оценивали методом хи–квадрат или тестом Фишера. Кривые выживаемости были построены с использованием метода Каплана-Мейера для оценки БПВ и ОВ. Log-rank тест использовался для оценки различия выживаемости.
Результаты исследования и их обсуждение
Наиболее выраженная экспрессия MSI-2 была обнаружена в опухолевых клетках первичной опухоли и метастатических очагов, где была представлена как цитоплазматически, так и ядерно, и фактически отсутствовала в клетках микроокружения опухоли (рисунок 1).
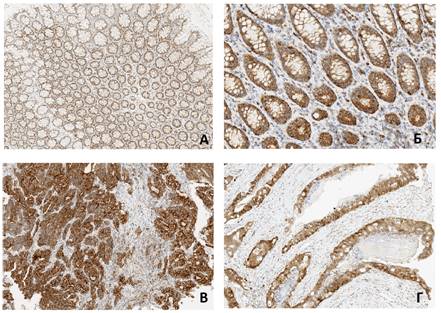
Рис. 1. ИГХ-окрашивание с антителом к MSI-2:
А. Слизистая оболочка толстой кишки. Ув. 200,
Б. Слизистая оболочка толстой кишки. Ув. 300,
В. Метастатический очаг в печени. Ув. 200,
Г. Аденокарцинома сигмовидной кишки. Ув. 300
После выполнения оценки экспрессии MSI-2 в ткани нормального кишечного эпителия, первичной опухоли и метастатического очага в печени у каждого из 25 пациентов полученные результаты позволили выявить статистически значимые различия (таблица 1). Статистика критерия Краскела-Уоллиса – 65,982. Набольшая разница экспрессии MSI-2 была выявлена в ткани нормальной кишки и метастатического очага и составила 65 и 280 баллов соответственно. Установлены нижние и верхние границы значений (квартили). Для дальнейшей статистической обработки количественные показатели экспрессии Musashi 2 в нормальной ткани, первичной опухоли и метастазе были аппроксимированы в качественные путем разделения уровня экспрессии на высокий (High) и низкий (Low) по медиане 65, 160 и 280 (p<0,00001) соответственно (рисунок 2).
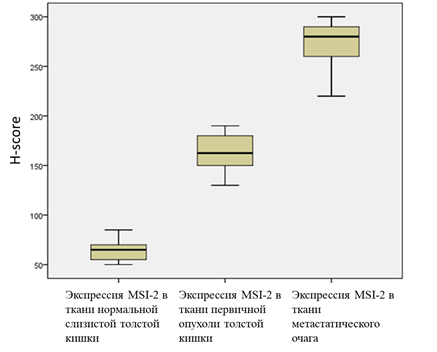
Рис. 2. Разделение уровня экспрессии MSI-2 в различных тканях пациентов с КРР
Сравнение показателей беспрогрессивной выживаемости (БПВ) и уровня экспрессии MSI-2 не показало статистически значимой разницы между низкой и высокой экспрессией в ткани нормальной кишки (p=0,910). В то же время высокий уровень экспрессии MSI-2 как в первичной опухоли (р=0,013), так и в метастатическом очаге достоверно снижал продолжительность БПВ (р=0,005) (таблица 1).
Таблица 1
Сравнение уровня экспрессии MSI-2 в тканях пациента с показателями выживаемости без прогрессии
|
Клинико-патологические параметры |
Среднее время выживания (БПВ) (месяцев, CI 95%) |
Медиана выживания (месяцев, CI 95%) |
Log-rank |
p-value |
|
MSI-2 в нормальной ткани кишечного эпителия |
||||
|
Низкий |
6.3 (4.2 - 8.4) |
6.0 (2.9 - 9.1) |
0,013 |
0,910 |
|
Высокий |
6.3 (4.5 - 8.1) |
7.0 (1.1 - 12.9) |
||
|
MSI-2 в первичной опухоли |
||||
|
Низкий |
8.3 (5.7 - 10.9) |
9.0 (3.5 - 14.5) |
6,201 |
0,013 |
|
Высокий |
5.3 (4.0 - 6.6) |
3.0 (1.3 - 4.7) |
||
|
MSI-2 в метастатическом очаге |
||||
|
Низкий |
8.6 (7.0 - 10.3) |
9.0 (8.0 - 10.0) |
7,939 |
0,005 |
|
Высокий |
4.6 (3.2 - 6.0) |
3.0 (2.5 - 3.5) |
||
Примечания: Log-rank – 0,013; 6,201; 7,939, р = 0,910; 0,013; 0,005.
При изучении связи экспрессии MSI-2 и продолжительности общей выживаемости (ОВ) достоверное снижение было показано только при высоком уровне MSI-2 в ткани метастатического очага (р<0.0001), но не первичной опухоли (р=0,204) и нормальной ткани кишки (р=0,899) (таблица 2).
Таблица 2
Сравнение уровня экспрессии MSI-2 в тканях пациента с показателями общей выживаемости
|
Клинико-патологические параметры |
Среднее время выживания (месяцев, CI 95%) |
Медиана выживания (месяцев, CI 95%) |
Log-rank |
p-value |
|
MSI-2 в нормальной ткани кишечного эпителия |
||||
|
Низкий |
13.6 (9.9 - 17.3) |
13.0 (10.5 - 15.5) |
0,016 |
0,899 |
|
Высокий |
14.5 (12.0 - 16.2) |
13.5 (10.6 - 16.4) |
||
|
MSI-2 в первичной опухоли |
||||
|
Низкий |
16.6 (13.6 - 19.6) |
17.0 (10.4 - 23.6) |
1,611 |
0,204 |
|
Высокий |
12.6 (9.9 - 15.3) |
12.0 (9.4 - 14.6) |
||
|
MSI-2 в метастатическом очаге |
||||
|
Низкий |
18.4 (15.9 - 20.9) |
19.0 (15.8 - 22.2) |
15,696 |
<0.0001 |
|
Высокий |
10.6 (8.7 - 12.6) |
11.0 (9.2 - 12.8) |
|
|
Примечания: Log-rank – 0,016; 1,611; 15,696, р = 0,899; 0,204; <0,0002.
Выводы
Совершенствование техники хирургического лечения и развитие лекарственной терапии не приводит к существенному снижению частоты локального рецидивирования и развития отдаленных метастазов. В данном положении поиск новых предиктивных биомаркеров прогрессии колоректального рака является чрезвычайно необходимым [4; 11]. Основываясь на полученных данных нашего исследования, мы можем заключить, что повышение интратуморальной экспрессии MSI2 является фактором негативного прогноза в отношении ВБП (p=0,013), а повышенная экспрессия MSI2 в метастатическом очаге – связана со значительным (P<0.0001) снижением ОВ.
Данные предшествующих исследований показали, что MSI-2, помимо физиологической роли в гемопоэтической и нервной ткани, играет значительную роль в канцерогенезе опухолей из данного типа тканей. MSI-2 в свою очередь демонстрирует важную роль в процессах трансформации кишечного эпителия [11]. Другие работы показывают значимое влияние MSI-2 на канцерогенез многих солидных опухолей, в частности гепатоцеллюлярной карциномы, где показано регулирование MSI-2 процессов эпителиально-мезенхимальной трансформации [12; 13].
Существенное различие экспрессии MSI-2 в ткани первичной опухоли и метастатического очага (р<0.0001) позволяет сделать предположение о значительной роли MSI-2 в процессах развития метастатического поражения, особенно ввиду отсутствия экспрессии MSI-2 в клетках микроокружения. Данные факты позволяют предположить возможность использования MSI-2 как предиктивного маркера негативного процесса при метастатическом КРР, и с другой стороны, как терапевтической цели либо компонента специфического сигнального пути в клетках КРР. Необходимо отметить, что проведение дальнейшего изучения роли MSI-2 в развитии, метастазировании и развитии резистентности КРР является следующим этапом исследования.



