В основе механизма развития многих патологических состояний имеет место гипоксия. В зависимости от нозологических форм заболеваний происхождение кислородного голодания имеет различные формы. Однако неизменным остается роль гипоксии в энергетическом обмене. Это дает основание для использования кислородного голодания в качестве модели, в частности в виде гипоксической гипоксии в условиях пребывания животных в гипобарической камере, что определяет практическую значимость данного исследования. Барокамерная гипоксия широко используется в практической медицине при патологии различных систем: сердечно-сосудистой [1; 2], дыхательной, выделительной [3; 4], а также системы крови [5]. Прерывистая гипобарическая гипоксия служит моделью и при исследовании механизмов адаптивных возможностей и резистентности организма [6]. В реализации общего адаптационного синдрома наряду с фактором гипоксии значительную роль играет и система гемостаза.
Целью исследования явилось дальнейшее изучение тромбоцитов, в частности взаимосвязи количества, размеров и характер формирования различных их видов в условиях действия на организм острого прерывистого пониженного барометрического давления.
Материал и методы исследования
В качестве материала исследования были использованы тромбоциты крови 50 взрослых кроликов породы шиншилла. Пребывание животных в камере продолжалось 24 часа при гипобарометрии, соответствующей 5-7 тыс. м высоты по показателю манометра-анероида. Прерывистая гиперкапническая гипоксия создавалась перерывами на 15 минут через каждый час пребывания в камере. Регистрация показателей тромбоцитов – количества, размера и уровня дифференциации, то есть уровня зрелости, проводилась в исходном состоянии, после 3, 7, 12, 24 часов пребывания в барокамере, а также через 1, 2, 3, 4, 5 суток после опыта. Общее состояние животных во время опытов было удовлетворительное. Случаев гибели кроликов не наблюдалось.
Кровь у кроликов взяли из краевой вены уха. Количество тромбоцитов определялось на сетке Гаряева счетной камеры. Цельную кровь в объёме 0,02 мл разводили в меланжере для эритроцитов 2% раствором NaCl, так как подсчет тромбоцитов проводился параллельно подсчету количества эритроцитов в содержимом одного же смесителя. Использование эритроцитарного меланжера, как мы полагаем, не противоречит пробирочному методу. Мазки крови были окрашены по методу Романовского-Гимза.
Процентное содержание разных форм тромбоцитов определялось на разных местах мазка крови по правилам Егорова с помощью светового микроскопа без сопоставления к числу эритроцитов, в отличие от метода Fonio. Размеры тромбоцитов вычисляли окуляр-микрометром. Для этого определяли два размера тромбоцита с выведением среднего значения.
Соответствие выборок нормальному распределению оценивалось по критерию Шапиро-Уилка. Показатели внутри выборок отличались от стандартного нормального распределения. Для установления достоверности различий был использован критерий Вилкоксона для сопряженных пар, когда одно и то же животное является контролем (исходное состояние) и экспериментальным (в процессе опыта) [7].
Результаты исследования и их обсуждение
Общее количество тромбоцитов у контрольных кроликов, то есть в исходном состоянии, в среднем составляло 365 х 109/л при стандартной ошибке m± 8,8. Референтные значения находились в пределах от 250 до 670 х 109/л. С первых часов действия гипоксии число кровяных пластинок увеличивалось. К концу опыта, т.е. через 24 часа, число их соответствовало в среднем 623 х 109/л (m±9,3; P<0,05 при сопоставлении с исходным уровнем). В постэкспериментальный период нормализация количественных сдвигов кровяных пластинок происходила в преобладающем большинстве опытов лишь на 4-5-е сутки послеопытного периода.
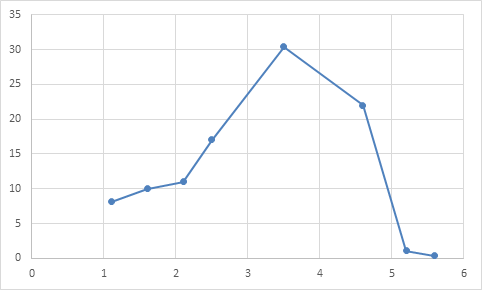
При морфометрии тромбоциты были разбиты на 3 группы. В первую группу были включены «крупные пластинки» размером более 5 мкм. Вторую группу составляли «средние кровяные пластинки» величиной 2-5 мкм. Третья группа состояла из «мелких пластинок» размером менее 2 мкм. В исходном состоянии животных средний размер кровяных пластинок равнялся 2,8 мкм (m ± 0,07). Диапазон вариации размеров кровяных пластинок находился в пределах 1,7-5,2 мкм. Первая группа кровяных пластинок была самая малочисленная. Среднее значение ее составляло всего 1,5% (m±0,04). Относительное содержание тромбоцитов 2-й и 3-й групп равнялось соответственно 29,1% (m ±0.8) и 69,4% (m ±1,5). Для графического выражения размеров кровяных пластинок были составлены тромбоцитометрические кривые по аналогии с эритроцитометрическими кривыми Прайс-Джонса (рисунок 1). Высота пика на оси ординат соответствовала 30% содержания тромбоцитов, диапазон вариации размера тромбоцитов на оси абсцисс находился от 1,1 до 5,6 мкм. Наибольший процент содержания принадлежал тромбоцитам с размером 3,5 мкм.
|
Проценты |
8,1 |
10 |
11 |
17 |
30,4 |
22 |
1,1 |
0,4 |
|
Средний размер (мкм) |
1,1 |
1,6 |
2,1 |
2,5 |
3,5 |
4,6 |
5,2 |
5,6 |
Рис. 1. Тромбоцитометрическая кривая в исходном состоянии. На оси абсцисс - величина среднего размера тромбоцитов, на оси ординат - процентное содержание тромбоцитов
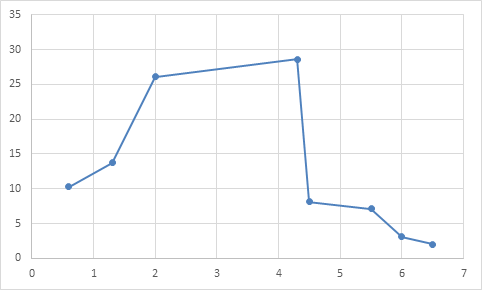
Наблюдаемые сдвиги количественных показателей во время опыта, а также в послеопытный период для оценки их значимости сопоставлялись с аналогичными данными в исходном уровне. В первые часы гипоксии отмечалось статистически значимое снижение средних размеров кровяных пластинок. Так, через 3 часа сводное значение среднего размера пластинок составляло 2,2 мкм (m ±0,03; P<0,05 при сопоставлении с исходным уровнем). Диапазон вариации в это время оставался без особых изменений (1,3-5,1 мкм). Происходило достоверное уменьшение количества кровяных пластинок 1-й и 2-й групп (0,4%, m±0,01, P<0,05 и 25,2%, m±0,8; P<0,05 по сравнению с исходным уровнем) и соответственное увеличение числа пластинок 3-й группы (74,4%, P<0,05 при сопоставлении с исходным уровнем). Исследование после 7-часового пребывания животных в барокамере не выявило статистически значимых изменений со стороны размеров тромбоцитов. В дальнейшем, по мере увеличения срока пребывания животных в условиях гипоксии, средние размеры кровяных пластинок достоверно повышались. Через 12 часов колебание их составило 1,1-5,3 мкм, а среднее значение равнялось 3,3 мкм (m±0,8; P<0,05 при сопоставлении с исходным уровнем). Одновременно происходило некоторое увеличение количества первой и второй групп пластинок (8,9%, m±0,26; P<0,05 и 48,8%, m ±1,2; P<0,05 при сопоставлении с исходным уровнем). Соответственно содержание пластинок 3-й группы понижалось (44,3%, m ±1,3; P<0,05 по сравнению с исходным уровнем). К концу пребывания животных в камере, т.е. через 24 часа при действии гипоксии, значение средних размеров статистически значимо достигло своего максимального уровня (3,7 мкм, m ±0,01; P<0,05 по сравнению с исходным уровнем). Колебания размеров пластинок составляли 0,6-5,5 мкм. Количество кровяных пластинок 1-й и 2-й групп достоверно все более увеличивалось и равнялось соответственно 12,2% (m ±0,32; P<0,05 при сопоставлении с исходным уровнем) и 50,1% (m ±1,6;P<0,05 при сопоставлении с исходным уровнем). Содержание 3-й группы кровяных пластинок уменьшилось до 37,7% (m±0,9; P<0,05 по сравнению с исходным уровнем). Для графического выражения размеров кровяных пластинок после 24 часов пребывания кроликов в барокамере также были составлены тромбоцитометрические кривые по аналогии с эритроцитометрическими кривыми Прайс-Джонса (рисунок 2). Высота пика на оси ординат соответствовала 28,6% содержания тромбоцитов, диапазон вариации размеров тромбоцитов на оси абсцисс находился от 0,6 до 6,5 мкм. Наибольший процент содержания принадлежал тромбоцитам с размером 4,3 мкм.
|
Проценты |
10,3 |
13,7 |
26,1 |
28,6 |
8,1 |
7,1 |
3,1 |
2 |
|
Средний размер (мкм) |
0,6 |
1,3 |
2 |
4,3 |
4,5 |
5,5 |
6 |
6,5 |
Рис. 2. Тромбоцитометрическая кривая после 24–часового пребывания кроликов в барокамере. На оси абсцисс - величина среднего размера тромбоцитов, на оси ординат - процентное содержание тромбоцитов
Если расширение основания гипоксической тромбоцитометрической кривой указывало на повышение диапазона вариации размеров кровяных пластинок, то некоторый сдвиг «пиков» ее «вправо» отражал определенное увеличение средних размеров кровяных пластинок. Увеличение же высоты вершин кривой было связано с повышением количества более крупных кровяных пластинок.
В постэкспериментальный период происходила постепенная нормализация описываемых показателей. Однако в преобладающем большинстве случаев в 1, 2 и 3-и сутки после опыта, наступившие в процессе эксперимента сдвиги в размерах кровяных пластинок оставались статистически значимыми. Так, средние размеры тромбоцитов через 1, 2, 3-и сутки после пребывания животных в барокамере соответственно составляли 3,2 мкм (P<0,05), 3,3 мкм (P<0,05), 3,1 мкм (P<0,05). Сопоставление производилось с исходным уровнем. Параллельно наблюдалось постепенное снижение процентного содержания 1-й и 2-й группы и относительное повышение 3-й группы тромбоцитов по сравнению с экспериментальным уровнем. Так, через 1, 2, 3-и сутки после опыта в среднем соответственно 1-я группа составляла 4,1% (m ±0,13; P<0,05), 3,2% (m ±0,11;P<0,05), 2,5% (m ±0,6; P<0,05; вторая группа - 36,7% (m ±1.1; P<0,05), 31,9% (m ±0,93;P<0,05), 30.1% (m ±0,82; P<0,05), третья группа - 59,2% (m ±1,3; P<0,05), 64,9% (m ±1,9; P<0,05), 67,4% (m ±1,3; P<0,05). При этом количественные показатели также сопоставлялись с исходным уровнем. Лишь на 4-5-е сутки после опытного периода средние размеры кровяных пластинок, а также процентное содержание выделяемых групп принимали близкое к исходному состояние.
Одновременно в процессе работы были рассмотрены изменения при действии острой гипоксии со стороны различных форм тромбоцитов: юных (1-я группа), зрелых (2-я группа), старых (3-я группа), формы раздражения (4-я группа) (таблица).
Сводная тромбоцитограмма
|
Сроки опытов |
Юные формы (%) M±m |
Зрелые формы (%) M±m |
Старые формы (%) M±m |
Формы раздражения (%) M±m |
|
Исходный уровень (норма) |
2,1±0,08; 0-3 |
87,3±1,9; 83-91 |
4,2±0,12; 2-7 |
7,4±0,16; 4-10 |
|
После 3 часов пребывания в камере |
1,4±0,06*; 0-3 |
86,90±2,2; 84-90 |
3,6±0,11; 2-6 |
8,1±0,14; 4-11 |
|
После 7 часов пребывания в камере |
5,5±0,14*; 3-7 |
78,5±2,3*; 65-88 |
4,2±0,12; 2-8 |
11,8±0,24*; 8-13 |
|
После 12 часов пребывания в камере |
11,8±0,26* 5-16 |
65,1±1,5* 63-69 |
4,1±0,13; 2-7 |
19,0±0,48* 15-21 |
|
После 24 часов пребывания в камере |
11,2±0,28*; 7-15 |
64,6±1,8*: 61-67 |
4,4±0,13; 2-8 |
19,8±0,46*; 16-23
|
|
На 1-е сутки после опыта |
10,4±0,23*; 6-12 |
70,1±1,9*; 69-76 |
3,7±0,11; 2-7 |
15,8±0,37*; 13-18 |
|
На 2-е сутки после опыта |
5,5±0,13*; 3-7 |
78,8±2,1*; 75-82 |
3,8±0,12*; 1-6 |
11,9±0,08*; 8-14 |
|
На 3-и сутки после опыта |
3,4±0,08* 1-6 |
81,8±2,2* 78-84 |
4,2±0,14; 1-8 |
10,6±0,07* 7-12 |
|
На 4-е сутки после опыта |
1,2±0,04; 0-4 |
87,4±2,4 84-91 |
3,8±0,13; 1-7 |
7,6±0,09; 4-9 |
|
На 5-е сутки после опыта |
1,1±0,04; 0-3 |
87,1±2,1; 84-91 |
4,1±0,14; 2-6 |
7,7±0,07; 5-10 |
Примечания: n = 50; M - средняя арифметическая величина; m – стандартная ошибка средней арифметической; *- P<0,05 при сопоставлении с исходным уровнем.
Немногочисленные юные формы кровяных пластинок при окраске по методу Романовского характеризовались нерезкими контурами, наличием нежного, необильного, с более или менее равномерным расположением грануломера и бледно-розового, реже голубого гиаломера. Зрелые формы, которые представляли основную массу кровяных пластинок, имели округлую или овальную форму, отличались резкими контурами. Гиаломер окрашивался в голубоватые или розоватые тона. Грануломер располагался главным образом в центре пластинки, содержал зернышки красновато-фиолетового цвета. У старых форм кровяных пластинок большую часть занимал грануломер. Зерна его были грубые, пикнотичные, темно-фиолетовой окраски. Гиаломер находился в виде узкого ободка. Пластинки в целом были сморщены, имели чаще неправильную форму. В некоторых кровяных пластинках старой формы встречались разной величины вакуоли. Формы раздражения кровяных пластинок характеризовались наличием незначительного, еле заметного ободка гиаломера розоватого оттенка и занимающего почти всю пластинку фиолетового цвета грануломера. Форма их была овальная или колбасовидная. По мере действия острой гипоксии в целом отмечалось постепенное увеличение количества юных форм кровяных пластинок и форм раздражения при относительном снижении содержания зрелых и старых форм. Возвращение к исходному уровню наблюдалось лишь на 4-5-е сутки после опыта (таблица).
Изучение влияния гиперкапнической гипоксической гипоксии на организм, в частности на состояние гемостаза, несмотря на длительную историю подобных исследований, не теряет своей актуальности. Диапазон исследований включает как интенсивность, так и длительность воздействия на свертывающую систему крови. Реакция со стороны факторов гемостаза в условиях пребывания в барокамерной гипоксической среде, естественно, проявляется в русле механизма общего адаптационного синдрома. В зависимости от характера гипобарии после срочной адаптации следует долговременная совершенная адаптация или дезадаптация. В исследованиях ряда авторов в ранние сроки, то есть в диапазоне срочной адаптации, прослеживается доминирование тромбогенных факторов, в том числе и тромбоцитарного звена, а в рамках долговременной адаптации наблюдается балансирование тромбогенных и антитромбогенных факторов. Например, в ряде работ отмечено активирующее влияние гипоксической гипоксии на гемостаз при пребывании крыс в гипобарической камере на «высоте 5,5 тыс. м». Вероятно, имеется в виду экспрессия тромбоцитов и плазменных факторов свертывания крови. При увеличении длительности однократного воздействия возрастала активация тромбогенных факторов системы гемостаза и снижались антикоагулянтные и фибринолитические свойства плазмы крови. По данным коагулограммы, на 7-й день гипоксии у крыс развивались претромботические изменения в виде усиления потребления тромбоцитов, активации свертывания крови, снижения уровня антитромбина III и фибринолитической активности. На 30-й день гипоксической гипоксии отмечено снижение активации гемостаза с ростом антикоагулянтного резерва плазмы крови и восстановления фибринолитической активности [8]. Следовательно, в приведенном исследовании прослеживаются все стадии общего адаптационного синдрома в системе гемостаза крови. Результаты наших исследований вполне согласуются с выше приведенной динамикой сдвигов в системе гемостаза и, безусловно, отражают активацию тромбогенных факторов. Схожие параметры изменений со стороны факторов гемостаза наблюдались и при подъёме в барокамере на «высоту» 7 тысяч метров [9]. Была зафиксирована гиперкоагуляция и активация тромбоцитарного звена в ранние сроки и удлинение срока свертывания крови после завершения 30-дневного цикла гипоксии.
Выводы
1. Исследование реакции гемостаза на острое прерывистое кислородное голодание в условиях пребывания кроликов в барокамере при разряжении воздуха, соответствующем 5-7 тыс. м высоты, в течение 24 часов выявило вполне определенные компенсаторные сдвиги со стороны тромбоцитов.
2. Повышение количества тромбоцитов сопровождалось увеличением их размеров. Однако через 3 часа пребывания животных в барокамере наблюдалось снижение сводного значения данного показателя. К 7 часам действия гипоксии средний размер тромбоцитов вернулся к исходному уровню, а затем стал повышаться с максимальным значением через 24 часа.
3. Следовательно, повышение количества средних размеров тромбоцитов, а также сдвиг «влево» тромбоцитограммы взаимно обусловлены и в целом отражают более совершенный уровень механизма фенотипической адаптации, инициированный гипоксией.



