Среди травматических повреждений, характеризующихся высокой летальностью и инвалидизацией, наибольший процент приходится на черепно-мозговую травму (ЧМТ). В последние годы установлено, что исход ЧМТ во многом определяется не только первичным повреждением головного мозга, но и развитием вторичных реакций, среди которых иммунной дисрегуляции отводится ключевая роль. Рядом авторов показано, что у большинства пациентов с ЧМТ происходит угнетение клеточного и гуморального звеньев иммунитета, наиболее выраженное в случае развития гнойных осложнений и неблагоприятных исходов [1; 2].
В последние годы особое внимание уделяется исследованию врожденного иммунитета в связи с его важной ролью в развитии воспаления. Одним из механизмов врожденного иммунитета является продукция противомикробных пептидов (ПМП), выполняющих роль медиаторов воспаления и обладающих, наряду с антимикробным действием, способностью участвовать во врожденных и адаптивных иммунных реакциях, свертываемости крови, тканевой репарации и других процессах в организме [3-5].
При этом особого внимания заслуживают α-дефенсины, основным источником которых являются нейтрофилы, осуществляющие первыми миграцию в ткани при воспалении. Показано, что уровень α-дефенсинов может быть надежным маркером активации нейтрофилов, а эти пептиды более длительно сохраняются в плазме крови и тканях за счет их способности сорбироваться на различных белках и клетках после гибели короткоживущих нейтрофилов. Наряду с этим α-дефенсины влияют на продукцию TNF-α, IL-1β, IL-6, IL-8 и IL-10, дисбаланс которых на системном и локальном уровнях также является одним из основных патогенетических механизмов ЧМТ [6]. Вместе с тем роль цитокинов в тяжести течения и исходов ЧМТ не определена, а немногочисленные сведения, приводимые в литературе, весьма противоречивы. Кроме этого, в литературе практически отсутствуют данные о взаимодействии противомикробных пептидов и цитокинов в развитии нейровоспалительного процесса при травматической болезни головного мозга.
Исходя из изложенного, целью работы являлась разработка информативных прогностических критериев течения и исходов тяжелой черепно-мозговой травмы на основании оценки состояния цитокинового профиля и факторов врожденного иммунитета.
Материалы и методы исследования. В исследование включено 105 пациентов с тяжелой черепно-мозговой травмой, находившихся на лечении в нейрохирургическом отделении Курской областной клинической больницы с 2015 по 2019 год. Протокол клинического обследования больных утвержден на заседании Этического комитета ФГБОУ ВО «КГМУ» Минздрава России (протокол № 9 от 09.11.15 г.).
Критериями включения пациентов в исследование являлись: тяжелая ЧМТ, средний уровень сознания по шкале комы Глазго – 6,8±1,2 балла.
Критериями исключения из исследования являлись пациенты с тяжелой ЧТМ в крайне тяжелом и агональном состоянии (шкала комы Глазго – 3 балла) и пациенты с уровнем сознания при поступлении >10 баллов по шкале комы Глазго.
Всем пациентам в клинической группе проводилось комплексное общесоматическое, неврологическое и рентгенологическое обследование. Локализация очагов поражения подтверждена данными КТ или МРТ головного мозга. Диагностика и лечение ЧМТ проводились в соответствии с требованиями Приказа Минздрава России от 07.11.2012 N 635н «Об утверждении стандарта специализированной медицинской помощи при внутричерепной травме» [7].
В первые 24 часа и через 7 суток после ЧМТ пациентам выполнялась люмбальная пункция с забором цереброспинальной жидкости и периферической крови из центральной вены.
Количественное содержание α-дефенсинов (HNP1-3) в плазме крови и цереброспинальной жидкости (ЦСЖ), цитокинов (IL-1β, TNF-α, IL-6, IL-8, IFN-γ, IL-10) в сыворотке крови и ЦСЖ определяли методом ИФА с набором для определения человеческих α-дефенсинов (ELISAkit, HyCultbiotechnology, Нидерланды) и цитокинов («Вектор-Бест», Россия). Для определения показателей, принимаемых за физиологическую норму, обследовано 20 здоровых лиц (средний возраст 38,3±11,5 года).
Статистическую обработку результатов исследования проводили с помощью программного комплекса Microsoft Office Excel 2007, используя среднее значение показателя, среднее стандартное отклонение показателя и процент случаев в анализируемой группе пациентов. Достоверность статистических различий средних арифметических величин сравниваемых параметров оценивали по расхождению границ доверительных интервалов. Статистически значимыми считали различия по критерию Стьюдента при значениях р <0,05. Для выявления корреляционной связи между показателями использовали коэффициент ранговой корреляции Спирмена (![]() ).
).
Результаты исследования и их обсуждение
Результаты исследования показали, что в первые сутки после ЧМТ уровни цитокинов с про- и противовоспалительной активностью в сыворотке крови и цереброспинальной жидкости в десятки раз превышали значения доноров (рисунок 1). При этом более высокие концентрации исследуемых медиаторов выявлены в ЦСЖ (рисунок 2). Полученные данные объясняются первоначальной реакцией иммунной системы на травму и логично согласуются с тем, что продукция цитокинов всегда выше в очаге воспаления на уровне органа-мишени [8; 9].
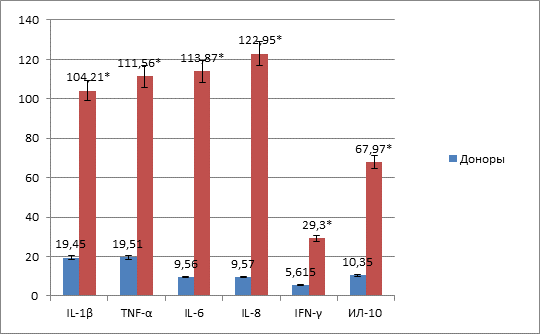
Рис. 1. Профиль сывороточных цитокинов у больных с ЧМТ в первые сутки после травмы
Примечание: * – р <0,05 в сравнении с донорами.
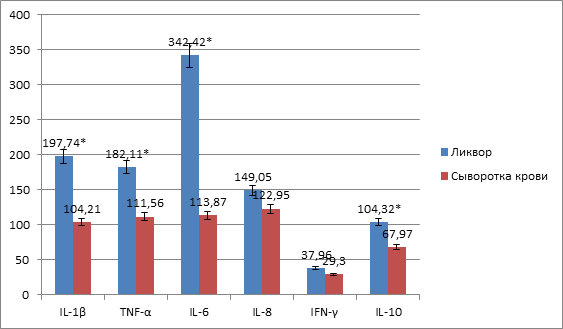
Рис. 2. Цитокиновый профиль сыворотки крови и ликвора пациентов с ЧМТ в первые сутки
Примечание: * – p <0,05.
На 7-е сутки по сравнению с первыми отмечалось статистически значимое снижение уровня IL-1β и TNF-α, IFN-γ и IL-10 в обеих биологических жидкостях (рисунок 3). При этом обращало внимание увеличение сывороточной и концентрации IL-6 и IL-8 в 1,3 и 1,6 раза соответственно, а ликворной по сравнению с сывороточной соответственно в 3,4 и в 1,9 раза (p<0,01).
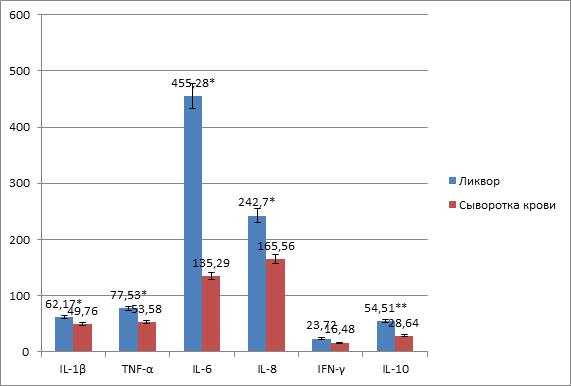
Рис. 3. Цитокиновый профиль ликвора и сыворотки крови на 7-е сутки после травмы
Примечание: * – p<0,05, ** – p<0,01.
Важно отметить, что повышенная продукция провоспалительных цитокинов, и в частности IL-8 и IL-6, имеет важное значение в патогенезе нейровоспалительного процесса, так как следствием этого является снижение функции ГЭБ, что способствует привлечению гематогенных нейтрофилов в мозг и развитию воспалительных осложнений. Установлено также, что IL-8 играет ключевую роль в механизмах повреждения тканей при гипоксии, в том числе головного мозга [10].
Следует также констатировать, что изменения исследуемых показателей были взаимосвязаны. При проведении корреляционного анализа установлена прямая корреляционная зависимость между уровнем цитокинов, цитозом и содержанием белка в ликворе (таблица 1). При этом наиболее сильная корреляционная связь выявлена между IL-6, ИЛ-8, уровнем цитоза и содержанием белка в ликворе (![]() >0,5).
>0,5).
Таблица 1
Корреляционная зависимость между показателями ликвора в 1-е и 7-е сутки после ЧМТ
|
Показатели |
IL-1β |
TNF-α |
IL-6 |
ИЛ-8 |
ИФН-γ |
ИЛ-10 |
Цитоз |
Белок |
|
IL-1β |
0,465 |
|
|
|
|
|
|
|
|
TNF-α |
|
0,645* |
|
|
|
|
|
|
|
IL-6 |
|
|
0,619* |
|
|
|
|
|
|
ИЛ-8 |
|
|
|
0,623* |
|
|
|
|
|
ИФН-γ |
|
|
|
|
-0,0456 |
|
|
|
|
ИЛ-10 |
|
|
|
|
|
0,71* |
|
|
|
Цитоз |
|
|
|
|
|
|
0,63* |
|
|
Белок |
|
|
|
|
|
|
|
0,507* |
Примечание: коэффициент ранговой корреляции Спирмена (* –![]() >0,5).
>0,5).
Учитывая отсутствие в литературе данных об участии α-дефенсинов в развитии иммунного ответа при травматической болезни головного мозга, был проведен сопоставительный анализ содержания α-дефенсинов (HNP1-3) в плазме крови и цереброспинальной жидкости. Результаты исследования показали, что в 1-е сутки после травмы наблюдается значительное повышение содержания α-дефенсинов (HNP 1-3) и в плазме крови, и в ЦСЖ, но уровень HNP 1-3 в ЦСЖ был в 9,7 раза ниже, чем в плазме крови. Аналогичная картина отмечалась и на 7-е сутки посттравматического периода, а именно, на фоне снижения к 7-м суткам содержания HNP 1-3 в плазме крови в 1,4 раза, более выраженное снижение наблюдалось в ЦСЖ – в 2,4 раза (рисунок 4). При этом уровень в ЦСЖ был в 15 раз меньше, чем в плазме крови (63282±621,77 пг/мл и 4126,9±129,36 пг/мл соответственно; p<0,05).
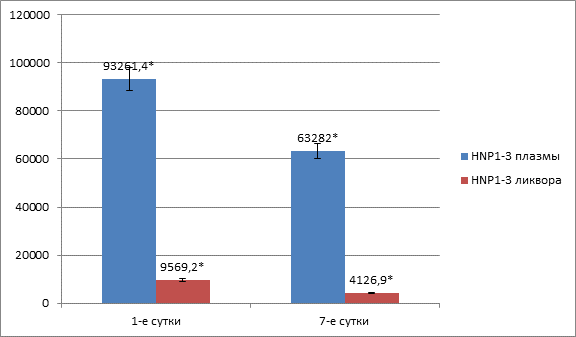
Рис. 4. Динамика содержания HNP 1-3 в плазме крови и ликворе
Примечание: * – p<0,05.
Принимая во внимание данные литературы о том, что α-дефенсины, наряду с антимикробной активностью, взаимодействуют с системой комплемента и коагуляционного гемостаза, индуцируют синтез цитокинов, представляло интерес сопоставить содержание α-дефенсинов и цитокинов в исследуемых биологических жидкостях в разные сроки после ЧМТ [11; 12].
С учетом этого был проведен корреляционный анализ между показателями HNP 1-3 в плазме крови и ликворе в 1-е и 7-е сутки после травмы, по результатам которого была выявлена сильная прямая корреляционная связь изменения концентрации HNP 1-3 в плазме крови и ликворе (таблица 2).
Таблица 2
Корреляционный анализ содержания HNP 1-3 в плазме крови и ликворе в 1-е и 7-е сутки
|
Коэффициент корреляции Спирмена |
Содержание HNP 1-3 плазмы и ликвора, пг/мл |
|
|
HNP 1-3 плазмы |
|
0,82 0,5* |
|
HNP 1-3 ликвора |
|
0,736 0,55* |
Примечание: ![]() <0,5 – связь сильная прямая;
<0,5 – связь сильная прямая;![]() – оценка коэффициента корреляции; * – связь статистически значимая.
– оценка коэффициента корреляции; * – связь статистически значимая.
Кроме этого, была проанализирована корреляционная зависимость между показателями HNP 1-3, цитокинами и общим анализом ликвора, выявившая статистически значимую сильную прямую корреляционную связь между HNP 1-3 и концентрацией IL-1β в плазме крови, содержанием белка и цитозом в ликворе в 1-е сутки после травмы (таблица 3). При этом особого внимания заслуживала выявленная на 7-е сутки после травмы статистически значимая прямая корреляционная зависимость между уровнем HNP 1-3 и противовоспалительным цитокином IL-10 как в плазме, так и в ликворе, что имеет важное значение в динамике течения и исходов воспалительного процесса в головном мозге.
Как известно, IL-10 – противовоспалительный цитокин, является мощным регулятором иммунного ответа, ингибирующим продукцию провоспалительных цитокинов. Значительное снижение IL-10 в плазме и ликворе отражает тяжесть воспалительного процесса в головном мозге, повышенную проницаемость гематоэнцефалического барьера, что характерно для тяжелых форм ЧМТ и может служить достоверным прогностическим критерием их исходов [13].
Таблица 3
Корреляционный анализ с расчетом коэффициента ранговой корреляции Спирмена (![]() ) между показателями HNP 1-3, цитокинов и общего анализа ликвора
) между показателями HNP 1-3, цитокинов и общего анализа ликвора
|
Цитокины, пг/мл |
HNP 1-3, пг/мл |
||
|
1-е сутки |
7-е сутки |
||
|
IL-1β |
Плазма Ликвор |
0,67* -0,325 |
0,22 -0,343 |
|
TNF-α |
Плазма Ликвор |
-0,155 -0,373 |
-0,3 -0,44 |
|
IL-6 |
Плазма Ликвор |
-0,501** 0,118 |
0,1 -0,38 |
|
IL-8 |
Плазма Ликвор |
-0,26 0,275 |
-0,13 -0,31 |
|
INF-γ |
Плазма Ликвор |
-0,682** -0,0136 |
0,14 -0,435 |
|
IL-10 |
Плазма Ликвор |
-0,33 0,457 |
0,5* 0,83* |
|
Белок г/мл |
Ликвор |
0,526* |
0,036 |
|
Цитоз |
Ликвор |
0,513* |
0,16 |
Примечание: * – ![]() <0,5 – связь сильная прямая; ** –
<0,5 – связь сильная прямая; ** – ![]() <-0,5 – связь сильная обратная.
<-0,5 – связь сильная обратная.
Согласно результатам проведенного исследования спектра провоспалительных и ингибирующих цитокинов, а также одного из важнейших факторов врожденного иммунитета – противомикробных пептидов на системном и локальном уровнях, представляло интерес сопоставить информативность их определения с клиническим течением и исходами ЧМТ. Поэтому следующим этапом исследования был анализ корреляционной связи между тяжестью ЧМТ по шкале ком Глазго (ШКГ), включающей оценку уровня сознания, и шкале исходов ком Глазго (ШИКГ) с исследуемыми показателями (таблица 4).
Таблица 4
Корреляционная зависимость уровня HNP 1-3 и цитокинов крови и ликвора с исходами ЧМТ
|
Цитокины |
ШИКГ |
||
|
1-е сутки |
7-е сутки |
||
|
IL-10 |
Кровь |
-0,0538 |
0,0169 |
|
Ликвор |
0,227 |
0,7** |
|
|
IFN-γ |
Кровь |
0,0388 |
0,17 |
|
Ликвор |
0,54* |
-0,192 |
|
|
IL-8 |
Кровь |
0,0492 |
0,282 |
|
Ликвор |
-0,665* |
-0,661* |
|
|
IL-6 |
Кровь |
0,0123 |
0,238 |
|
Ликвор |
-0,421 |
-0,568* |
|
|
HNP 1-3 |
Кровь |
0,542* |
0,409 |
|
Ликвор |
0,687* |
0,862** |
|
Примечание: ![]() <0,5 – связь сильная прямая;
<0,5 – связь сильная прямая; ![]() – оценка коэффициента корреляции; * – связь статистически значимая.
– оценка коэффициента корреляции; * – связь статистически значимая.
Результаты исследования выявили статистически значимую сильную прямую корреляционную связь между концентрацией HNP 1-3, IL-10 и IL-8 в ликворе на 7-е сутки и тяжестью исходов тяжелой ЧМТ по ШИКГ, что позволило выделить 3 группы пациентов по тяжести течения и исходам ЧМТ (таблица 5).
Таблица 5
Корреляционная зависимость ликворной концентрации на 7-е сутки HNP 1-3 и цитокинов с тяжестью состояния пациентов по ШИКГ
|
Иммунологические показатели |
Исходы ТЧМТ по ШИКГ |
||
|
1-2 балла |
3 балла |
4-5 баллов |
|
|
IL-10 |
<40 |
40-80 |
>80 |
|
HNP 1-3 |
<2000 |
2000-4000 |
>4000 |
|
IL-8 |
>300 |
200-300 |
<200 |
Первая группа – пациенты с уровнем HNP 1-3 в ликворе на 7-е сутки после травмы менее 2000 пг/мл, IL-8 более 300 пг/мл и IL-10 менее 40 пг/мл - прогнозируется возможность неблагоприятного исхода ЧМТ (по ШИКГ 1-2 балла). Вторая группа – пациенты с уровнем HNP 1-3 в ликворе на 7-е сутки после травмы 2000-4000 пг/мл, IL-8 в пределах 200-300 пг/мл и IL-10 в пределах 40-80 пг/мл – прогнозируется возможность условно неблагоприятного исхода (грубая инвалидизация) - по ШИКГ 3 балла. Третья группа – пациенты с уровнем HNP 1-3 в ликворе более 4000 пг/мл, IL-8 менее 300 пг/мл и IL-10 более 80 пг/мл – прогнозируется возможность благоприятного исхода (частичное или полное восстановление после травмы) - по ШИКГ 4-5 баллов.
Заключение
Таким образом, проведенный корреляционный анализ выявил наибольшую диагностическую информативность прогнозирования исходов ЧМТ для ликворной концентрации на 7-е сутки после травмы HNP 1-3, IL-8 и ИЛ-10.



