Как любой витамин, ретинол проявляет себя в организме человека как многофункциональное соединение. Он участвует в ряде важных физиологических процессов с эмбрионального периода до зрелого возраста. Ретинол является активным структурным компонентом клеточных мембран. Ретиноевая кислота регулирует рост, деление и дифференцировку клеток эмбриона, молодого организма и быстро делящихся тканей (хрящевой, костной и эпителиальной). Важность витамина А в регуляции роста посредством пролиферации и дифференцировки клеток была признана в начале XX в. Ретиноевая кислота образует в ядре комплекс с рецепторами, который, связываясь с участками ДНК, стимулирует процесс транскрипции генов, обеспечивает кодирование белков цитоскелета и реакции синтеза и распада гликопротеидов. В последнее десятилетие были описаны новые биологические функции, связанные с инсулинорезистентностью, липидным обменом, энергетическим балансом и окислительно-восстановительной передачей.
Цель исследования – проанализировать современные литературные данные, касающиеся метаболизма жирорастворимого витамина А.
Ретиноиды (соединения группы витамина А) относятся к циклическим непредельным одноатомным спиртам и состоят из β-иононового кольца и боковой цепи из двух остатков изопрена с первичной спиртовой группой. Гидроксидная группа может окисляться в альдегидную (ретиналь) или карбоксильную группу (ретиноевая кислота). Семейство из трех основных соединений одинаковой дитерпеновой структуры обладает ярко выраженной липофильностью. Структурные формулы молекул производных β-каротина представлены на рисунке 1.
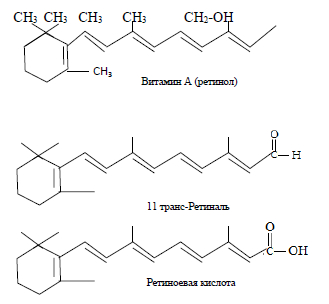
Рис. 1. Структурные формулы молекул производных β-каротина
Ретиноиды поглощают свет видимой области и имеют окраску от желтой до оранжевой. У всех соединений, кроме 11-цис-ретиналя, присутствующего в сетчатке глаз, все двойные связи имеют транс-конфигурацию. В своем основном состоянии молекулы ретиноидов имеют транс-конфигурацию всех двойных связей. Но эта ситуация может легко меняться при поглощении молекулой кванта световой энергии: в таком случае одна из транс-связей приобретает цис-конфигурацию — обычно это связь Сn-С12. Этому процессу подвержены ретиноиды, которые поглощают «наиболее видимый свет», т.е. ретиноиды с наиболее длинноволновым переходом [1–3]. Таковыми являются ретинали – альдегидные формы витамина А. Реакция соединений витамина А в альдегидной форме с аминогруппой некоторых белков приводит к образованию достаточно стабильных азометиновых производных. Такая реакция осуществляется в сетчатке человеческого глаза между ретиналем А и аминогруппой аминокислотного остатка лизина белка опсина с образованием родопсина, который выполняет функцию светочувствительного элемента нашей зрительной системы.
Витамины группы А содержатся только в продуктах животного происхождения: в наибольшем количестве – в печени трески и акул, где ретинол-А1 находится в этерифицированной форме; ретинол-А2 найден в печени пресноводных рыб. Провитаминами соединений группы А являются каротиноиды (α, β, γ), которые содержатся исключительно в растениях и, попадая в организм животных и человека, претерпевают ряд изменений. Из симметричного β-каротина образуются 2 молекулы ретинола, а из α- и γ- – только одна. И при поступлении с пищей эти формы менее эффективны, чем β-каротин. Витамин А не может быть синтезирован позвоночными представителями животного мира, включая людей, получающих его с пищей. В печени создается адекватный запас витамина А (>20 мкг/г печени), который выражается в эквивалентах активности ретинола (РАЭ). 1 мкг РАЭ определяется как биологическая активность, связанная с 1 мкг транс-ретинола, и исходя из эффективности абсорбции и превращения в витамин А он эквивалентен 12 мкг β-каротина и 24 мкг α-каротина (или β-криптоксантин). Другие каротиноиды, содержащиеся в пище, такие как ликопен, лютеин и зеаксантин, не являются метаболическими предшественниками витамина А.
Уровни витамина А могут быть указаны в международных единицах (МЕ). 1 МЕ эквивалентна 0,3 мкг транс-ретинола или 0,3 мкг РАЭ. Рекомендуемое содержание в пищевом рационе витамина А для детей, мужчин и женщин составляет 300–600, 900 и 700 мкг РАЭ/день соответственно. Во время беременности суточная норма составляет 750 мг в день и увеличивается до 1300 мг в день во время лактации. Не существует рекомендуемой суточной нормы для β-каротина или других каротиноидов провитамина А. Превращение каротиноидов в активную форму витамина А происходит под действием ферментов каротиндиоксигеназы и ретинальредуктазы в клетках слизистой оболочки тонкого кишечника и в гепатоцитах. Схема преобразования β-каротина в ретиналь, витамин А и ретиноевую кислоту представлена на рисунке 2.
Абсорбция ретинола, каротиноидов зависит как от общего поглощения липидов, так и от специфических ферментов, связывающих белки, а также транспортеров. Ретинол непосредственно поглощается энтероцитами, тогда как ретиниловые эфиры не могут быть абсорбированы интактной слизистой оболочкой кишечника и гидролизуются до ретинола внеклеточными гидролазами ретиниловых эфиров. После абсорбции энтероцитами они реэтерифицируются в кишечнике с помощью лецитина: ретинолацилтрансферазы в ретинол и доставляются через циркулирующие хиломикроны главным образом в печень. Неэтерифицированный ретинол также поступает в портальную циркуляцию, и его отток из базолатеральной клеточной мембраны облегчается переносчиком липидов член 1 АТФ-связывающая кассета подсемейства А (ABCA1). Однако β-каротин абсорбируется хуже, чем предварительно образованный ретинол. β-каротин поглощается в энтероцитах мембраносвязанными рецепторами, а затем его необходимо расщепить и превратить в ретинол, который этерифицируется и включается в хиломикроны. Установлено, что хиломикрон с ретинолом поглощается главным образом печенью, где остатки хиломикрона выводятся из кровообращения [4].
У здоровых людей примерно 90% витамина А в организме хранится в ретикулярных клетках печени в виде ретиниловых эфиров. При необходимости запасы витамина А мобилизуются, гидролизуются обратно в ретинол и транспортируются в крови с помощью ретинолсвязывающего белка для удовлетворения потребностей тканей. Так как ретинол очень легко окисляется, то как лекарственное средство используют уксуснокислый эфир (ретинолацетат), который к окислению значительно устойчивее. В живом организме из него под действием гидролизирующих ферментов высвобождается свободный ретинол. Ретиноевая кислота связывается и активирует два класса ядерных лиганд-зависимых регуляторов транскрипции, которые принадлежат к суперсемейству ядерных специфических рецепторов и включают два подсемейства: рецепторы ретиноевой кислоты и рецепторы ретиноида X. Оба класса рецепторов имеют три подтипа (α, β и γ), и каждый из них имеет разные изоформы. Рецепторы ретиноевой кислоты требуют гетеродимеры с рецепторами ретиноида X для связывания ДНК и последующей функции, активируются полностью транс-ретиноевой кислотой, преобладающим изомером ретиноевой кислоты in vivo и 9-цис-ретиноевой кислотой, тогда как рецепторы ретиноида X активируются только 9-цис-ретиноевой кислотой.
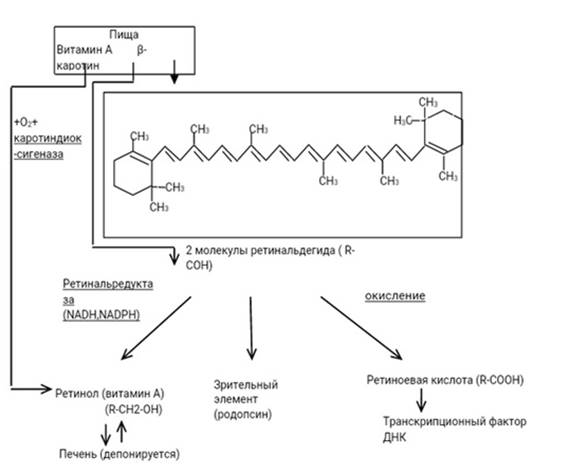
Рис. 2. Преобразование β-каротина в ретиналь, витамин А и ретиноевую кислоту
Гетеродимеры рецепторов ретиноевой кислоты – рецепторы ретиноида X – связываются со специфическими областями ДНК (элементами ответа ретиноевой кислоты в промоторной области генов-мишеней), что приводит к контролю транскрипции [5]. Ретиноевая кислота также может связывать другие ядерные рецепторы, такие как рецептор, активируемый пролиферацией пероксисом β / δ (PPAR (рецепторы, активируемые пероксисомными пролифераторами) β / δ), которые участвуют в регуляции энергетического гомеостаза и реакции инсулина. Известно, что более 500 генов реагируют на ретиноевую кислоту (когда она имеет транс-конфигурацию всех двойных связей или конфигурацию 9-цис-ретиноевой кислоты). Кроме того, ретиноевая кислота также обладает внеконуклеарными, нетранскрипционными прямыми эффектами, которые влияют на экспрессию генов-мишеней ретиноевой кислоты посредством процессов фосфорилирования. Также были описаны различные транскрипционные эффекты для ретинола и ретиналя [6].
Хотя в последние годы были предприняты значительные усилия по борьбе с дефицитом витамина А, гиповитаминоз А по-прежнему является серьезной мировой проблемой здравоохранения. Физиологическая концентрация витамина А в плазме составляет 1–2 мкмоль/л. По данным Всемирной организации здравоохранения, 250 млн детей дошкольного возраста в развивающихся странах имеют дефицит витамина А (содержание витамина в сыворотке крови ниже 0,70 мкмоль/л), и у 5 млн детей содержание витамина А в сыворотке крови ниже 0,35 мкмоль/л (тяжелый дефицит). Причиной дефицита витамина А является недостаточность содержания липидов в пищевом рационе, что часто встречается у жителей южных стран. В развивающихся странах широко распространен субклинический дефицит. Гиповитаминоз А редко встречается в развитых странах, где его поступление с пищей выше. Тем не менее важно отметить, что потребление витамина А у 20% населения в развитых странах не достигает 2/3 рекомендуемых доз.
Низкие концентрации ретинола в крови человека свидетельствуют о тяжелом дефиците, проявляющемся клинически ксерофтальмией (сопровождающейся никталопией), гиперкератозом, повышенной восприимчивостью к инфекциям и нарушениями дифференцировки клеток, развития органов, роста и размножения [6]. Витамин А контролирует синтез белков цитоскелета, синтез и распад гликопротеинов. Нарушение синтеза гликопротеинов связано с недостаточностью их гликозилирования и ведет к потере защитных свойств слизистых оболочек и к нарушению нормальной физиологии легких. Эти изменения связаны с изменениями содержания и распределения белка внеклеточного матрикса и базальной мембраны (БM) [7]. Белки внеклеточного матрикса и БМ обеспечивают механические контакты между клетками, образуют механически прочные структуры. Кроме того, эти белки формируют пути миграции клеток, вдоль которых они могут перемещаться (например, при эмбриональном развитии).
К белкам БМ относят:
1) коллаген IV типа – обеспечивает механическую прочность мембраны;
2) гепарансульфат-протеогликан – участвует в клеточной адгезии, обладает ангигенными свойствами;
3) ламинин и фибронектин – выполняют функцию адгезивного субстрата, с помощью которого к мембране прикрепляются эпителиоциты;
4) энтактин – связывает между собой ламинины и коллаген IV типа в базальной мембране.
Даже бессимптомная субклиническая форма гиповитаминоза А увеличивает частоту заболеваемости болезнями дыхательных путей. Ранняя ретиноидная депривация у беременных животных приводит к аномалиям, таким как агенез легкого, а более поздняя депривация вызывает дефектный альвеологенез.
Развитие легких у человека начинается на пятой неделе гестации, продолжается в течение первых нескольких лет жизни и включает несколько фаз: железистую, канальцевую и альвеолярную. Легкое плода развивается постнатально и становится одним из самых сложных органов, имеющим примерно 40 различных типов клеток. Основная функция легких заключается в удовлетворении потребности организма в кислороде и адекватном удалении СО2. Это происходит в альвеолах легких, которые образуются частично путем деления (разделения) газообменных мешочков незрелого легкого. Стадия развития, во время которой происходит разделение, значительно варьирует среди различных видов. У людей своевременный процесс дифференцировки легких с образованием альвеолярных структур происходит в основном в третьем триместре беременности и продолжается в послеродовом периоде, в течение первых лет жизни. Во время перинатального периода созревание легких протекает в рамках строго контролируемого процесса, в котором ключевую роль играют альвеолярные эпителиальные / мезенхимные взаимодействия. Легочные альвеолы являются функциональными единицами легких в процессе дыхания [8].
Альвеолярные пневмоциты типа II находятся в прямом контакте с альвеолярными пневмоцитами типа I выше уровня базальной мембраны, а также с фибробластами и другими интерстициальными клетками под базальной мембраной. Перед родами фибробласты секретируют полипептид, который стимулирует фермент, ограничивающий скорость синтеза поверхностно-активного вещества альвеолярными пневмоцитами типа II. Сурфактант – липопротеин, который уменьшает поверхностное натяжение, предотвращая легочный коллапс во время дыхания, также участвует в защите хозяина и ответной реакции воспаления в легких. Ретиноевая кислота способна контролировать экспрессию белка сурфактанта в эксплантах легких плода человека.
Как отмечалось выше, витамин А хранится в печеночных звездчатых клетках печени, а также в других органах. Эти клетки были обнаружены в легких, включая легкие плода, они могут поглощать ретинол из хиломикронов, что позволяет предположить, что этот орган приобретает его по аналогичному механизму, как печень, хотя его концентрация значительно ниже, чем в печени. Общая концентрация витамина А (свободный + этерифицированный) в тканях человека в возрасте от 4 месяцев до 86 лет варьирует от 8,7–1102,2 нмоль /г в ткани печени до 0,7–404,6 нмоль/г в ткани легких [9]. Основная роль запасов ретиниловых эфиров в легких заключается в обеспечении прямой доставки ретинола, когда возникает повышенная потребность тканей легких в ретиноле (например, в развивающемся легком). Таким образом, материнское снабжение витамином А имеет существенное значение для адекватного питания плода, его роста и развития. Кроме того, внутриутробный / неонатальный синтез ретинолсвязывающих белков недостаточен для обеспечения непрерывного снабжения из запасов печени. Недостаток в пищевом рационе матери витамина А играет важную роль в регуляции раннего развития легких и в формировании альвеол. Во время эмбрионального развития ретиноевая кислота регулирует пролиферацию и дифференцировку клеток и правильный органогенез. Низкий уровень витамина А у новорожденного, по-видимому, способствует риску бронхолегочной дисплазии (БЛД), хронического заболевания легких с очаговой потерей клеток реснитчатого эпителия, кератинизирующей метаплазией и некрозом слизистой бронхов, а также увеличением количества клеток, секретирующих слизь. У недоношенных детей, у которых уровни ретинола и ретинолсвязывающих белков в сыворотке значительно ниже, чем у доношенных новорожденных, существенно увеличивается риск развития БЛД. Низкие запасы витамина в печени у новорожденных вызывают нарушения функции легких, сокращение числа альвеол, снижение защиты от инфекций и увеличивают вероятность развития острых заболеваний в детском возрасте и хронических заболеваний у взрослых [10–12].
Еще в 1913 г., когда МакКоллум (McCollum), описавший «жирорастворимый А», который позже был идентифицирован как ретинол, заметил, что животные, лишенные этого фактора, «часто страдали от распространенного бронхита». Во многих работах упоминается, что при гиповитаминозе А происходит кератинизация трахеи и бронхов прежде, чем разовьются изменения в органах зрения [13–15]. С тех пор многочисленные сообщения показали, что дефицит витамина А связан с многочисленными заболеваниями легких. В этом обзоре мы рассмотрим те из них, при которых влияние витамина более изучено.
Острые респираторные инфекции приводят каждый год к более чем 4 млн случаев смерти во всем мире. Около 1,3 млн детей умирают от острых респираторных инфекций по всему миру, что составляет треть смертей среди детей в возрасте до 5 лет в странах с низким уровнем дохода [16–18].
В 1928 г. Грин и Мелланби установили, что витамин А является антиинфекционным фактором [19]. Современные исследования подтверждают, что витамин А играет важную роль в иммунологическом ответе на инфекции [20, 21]. Эпителиальные ткани являются первым барьером защиты от патогенов у животных. Дефицит витамина А вызывает плоскоклеточную метаплазию респираторного эпителия, реснитчатые эпителиальные клетки заменяются сквамозным эпителием, при этом происходит снижение выработки слизи. Эти изменения увеличивают риск инвазии патогенов. При дефиците ретинола нарушаются функции резидентных макрофагов, нейтрофилов, естественных киллеров, снижается антителопродукции, что приводит к снижению мукозального иммунного ответа. Появляются данные о влиянии витамина А на эпигенетическую регуляцию иммунной функции [22, 23].
Бронхиальная астма – это хроническое воспалительное заболевание, для которого характерны неспецифическая повышенная реактивность трахеобронхиального дерева с транзиторным воспалением дыхательных путей, обратимая обструкция дыхательных путей. Этиология гиперчувствительности дыхательных путей при астме неизвестна. В настоящее время начитывается приблизительно 235–300 млн человек в мире, больных бронхиальной астмой. По прогнозам, заболеваемость вырастет к 2025 г. до 100 млн человек. Ежегодно заболевание приводит приблизительно к 200 000 смертям во всем мире, в основном в странах с низким и средним уровнем дохода [24, 25]. Заболевание часто встречается среди детей. Систематические обзоры свидетельствуют о положительном влиянии свежих фруктов и антиоксидантных витаминов на профилактику и лечение астмы [26–28].
Дефицит витамина А провоцирует метаплазию реснитчатых цилиндрических эпителиальных клеток в клетки плоского эпителия. Окислительный стресс, связанный с увеличением количества активных форм кислорода (АФК) и/или активных форм азота, может выступать в качестве патогенетического фактора бронхиальной астмы за счет стимуляции выделения провоспалительных цитокинов [29–31]. Другие исследования показали, что гиперреактивность дыхательных путей может быть результатом существенных изменений в фенотипе гладких мышц бронхов, и представили доказательства того, что эндогенная ретиноевая кислота играет ключевую роль в контроле программы дифференцировки бронхов в гладких мышцах дыхательных путей во время развития дыхательных путей [32–34]. Повышенный уровень сывороточного витамина А улучшал функцию легких и качество жизни у детей с бронхиальной астмой [35–37].
Заключение
По данным Всемирной организации здравоохранения, дефицит витамина А представляет собой серьезную проблему общественного здравоохранения. Витамин А является важным фактором, играющим непосредственную роль в сложном процессе дифференцировки и созревания легочной ткани. Дефицит витамина А связан с гистопатологическими изменениями, предрасполагающими к тяжелой дисфункции легких и респираторным заболеваниям, которые представляют собой серьезную проблему для здоровья во всем мире. При этом показано, что некоторые патологические признаки хронического заболевания легких можно предотвратить или уменьшить с помощью добавок витамина А и/или ретиноевой кислоты. Необходимо разрабатывать программы обеспечения витамином А групп населения повышенного риска с целью профилактики и лечения ряда заболеваний легких. Различные исследования показали защитное действие ретиноевой кислоты при ряде респираторных заболеваний. Будущие исследования, вероятно, откроют перспективы для разработки стратегий использования ретиноидов в качестве терапевтических средств.



