Основные симптомы ревматоидного артрита (РА), поражающего около 1% населения мира, связаны, в первую очередь, с воспалением и деструктивными процессами в суставах, но часто приходится наблюдать и внесуставные проявления данного заболевания: миокардит, васкулит, фиброз легких, амилоидоз и другие, в том числе и поражение слюнных желез.
Поражение слюнных желез при РА встречается с частотой 15-30% и характеризуется развитием вторичного синдрома Шегрена (СШ) – хронического аутоиммунного заболевания, включающего лимфоцитарную инфильтрацию и резкое снижение секреторной функции в слезных и слюнных железах (не стимулированная секреция ≤0,1 мл / мин). Потеря секреции слюны ведет к развитию ксеростомии и другим осложнениям, которые в совокупности способны серьезно влиять на качество жизни пациентов.
Согласно Классификационным критериям первичного СШ (ACR/EULAR, 2016) для подтверждения диагноза наибольшее количество баллов (по 3) присвоено двум критериям: наличие в сыворотке крови аутоантител к компонентам SS-A(Ro) и SS-B(La) (группа антител к экстрагируемым ядерным антигенам, ENA) и наличие характерного очагового воспалительного инфильтрата в самой слюнной железе. Ультразвуковое исследование слюнных желез не представлено среди диагностических критериев, хотя многочисленные исследования показали, что данный метод может заменить сцинтиграфию, сиалографию и другие методы визуализации в диагностике СШ.
В большинстве случаев при СШ изначально поражаются подчелюстные и околоушные слюнные железы. Иногда наблюдается секреторный дефект, при котором на фоне низкого уровня воспалительных проявлений в слюнных железах наблюдается значительная потеря функции [1]. Наличие антител против Ro/SS-A является наиболее важным иммунологическим маркером сиалоаденитов [2], однако в ряде случаев клинически значимые проявления поражений слюнных желез сочетаются с отрицательными лабораторными признаками синдрома Шегрена [3]. Усилия по определению ранних проявлений синдрома Шегрена при РА осложнены тем фактом, что СШ является медленно прогрессирующим заболеванием, начальные стадии которого оказалось трудно идентифицировать как клиническими, так и лабораторными методами исследования.
Среди различных инструментальных методов, использующихся для диагностики заболеваний слюнных желез (рентгенография, сиалография, компьютерная томография и др.), самым доступным, безопасным и наиболее информативным в плане дифференциальной диагностики патологического состояния слюнных желез является ультразвуковой метод. Его использование позволяет классифицировать эхогенность, однородность, дегенерацию, фиброз и кальцификацию железистой паренхимы.
Цель исследования: определить частоту и выраженность структурного повреждения слюнных желез по данным ультразвукового исследования у больных РА с различным уровнем антител к SS-А и SS-B антигенам в сыворотке крови.
Материал и методы исследования
Под нашим наблюдением находилось 68 человек (11,8% мужчин, 88,2% женщин) с достоверным диагнозом РА (серопозитивны по РФ – 36,8%, по антителам к циклическому цитруллинированному пептиду – 54,4%, с умеренной активностью заболевания – у 67,6%, без выраженных симптомов ксеростомии и ксерофтальмии). Средний возраст пациентов составил 47,9±22,5 года, длительность заболевания – 84,7±62,8 месяца.
В качестве скринингового метода использовали определение антинуклеарного фактора на клеточной линии HEp-2 (ANA-Hep2) в сыворотке крови больных РА (тест непрямой иммунофлуоресценции, «Anti-nuclear antibodies HEp-2», BioSystems, Испания) (нормальные показатели титра < 1:80). При положительном результате первоначального скрининга антинуклеарных антител (ANA) проводили более специфичные исследования методом иммуноблоттинга («ANA-9 иммуноблот» с детекцией антигенов: SS-A 52, SS-A 60, SS-B, RNP, Sm, центромера B, Jo-1, Scl-70, рибосомальный белок; ORGenTec Diagnostika, Германия) и иммуноферментным методом («Anti-SS-A (Ro52 and Ro60)», ORG 508, ORGenTec Diagnostika, Германия).
Всем пациентам было выполнено ультразвуковое исследование (УЗИ) слюнных желез на аппарате Accuvix V10 (Samsung Medison, Южная Корея) с использованием датчика линейного сканирования с рабочей частотой 5–10 МГц. Исследования, согласно рекомендациям, проводили с использованием В-режима, а также цветового доплеровского и энергетического картирования [4].
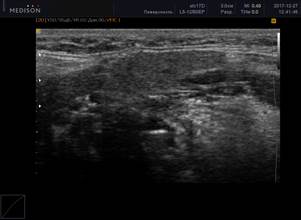
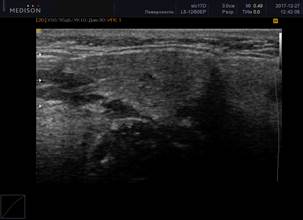
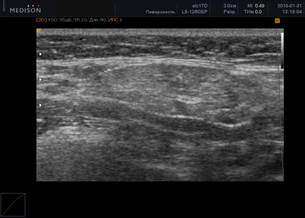
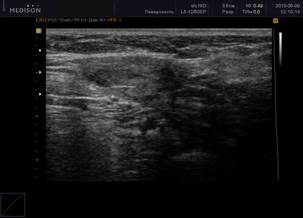
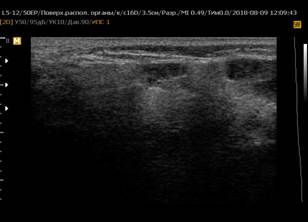
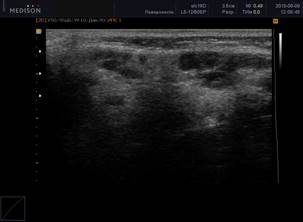
При обнаружении ЭХО-признаков паренхиматозной неоднородности в околоушных и подчелюстных слюнных железах была использована балльная оценка [5]: от 0 (однородность) до 4 (грубая неоднородность) баллов (рисунок 1).
|
1 |
2 |
|
3 |
4 |
|
5 |
6 |
Рис. 1. Сонограммы околоушных слюнных желез, В-режим
Примечание: 1 – околоушная слюнная железа в норме; 2 – 0 баллов (однородность); 3 – 1 балл (околоушная слюнная железа с измененной структурой, с появлением единичных очагов инфильтрации); 4 – 2 балла (околоушная слюнная железа с измененной структурой, с сливными очагами инфильтрации, неоднородная); 5 – 3 балла (околоушная слюнная железа с измененной структурой, неоднородная с 2 очагами инфильтрации); 6 – 4 балла (грубая неоднородность; околоушная слюнная железа с измененной структурой, практически с полным отсутствием нормальной ткани околоушной железы, неоднородная, с множественными очагами инфильтрации).
Статистический анализ был проведен с использованием программы Statistica 10.0 для Windows и рекомендаций руководств по биостатистике [6]. При анализе количественных признаков проводилась проверка на нормальность распределения с помощью критерия Колмогорова-Смирнова. Выборочные характеристики для нормально распределённых величин отображались как среднее (M) и стандартное отклонение (SD); для величин, закон распределения которых был отличен от нормального, – как медиана и интерквантильный интервал (Ме [Р25:Р75]).
Результаты исследования и их обсуждение
Частота выявления анти-SS-A и анти-SS-B у пациентов с РА составила 10,3% (изолированное определение анти-SS-A наблюдалось у 1 человека; изолированное определение анти-SS-В – у 1 человека; сочетанное определение анти-SS-A и анти-SS-В – у 5 человек) (таблица).
Серопозитивность больных РА по наличию антител к SS-А и SS-B антигенам
|
Лабораторные методы диагностики |
|||||
|
Тест непрямой иммунофлуоресценции на HEp-2 клетках, титр |
Иммуноферментный метод «Anti-SS-A (Ro52 and Ro60)» |
Метод иммуноблоттинга с детекцией антигенов |
|||
|
SS-A 52 |
SS-A 60 |
SS-B |
|||
|
Пациент 1 |
1:160 |
+ |
+ + |
− |
− |
|
Пациент 2 |
1:160 |
+ |
+ |
+ + |
+ + |
|
Пациент 3 |
1:320 |
+ |
+ + + |
+ + |
+ |
|
Пациент 4 |
1:80 |
+ |
+ + |
+ |
+ |
|
Пациент 5 |
1:160 |
− |
− |
− |
+ + |
|
Пациент 6 |
1:80 |
+ |
+ |
+ + |
+ |
|
Пациент 7 |
1:320 |
+ |
+ + |
+ + + |
+ + |
У 11 (16,2%) больных РА по данным УЗИ был выявлен сиалоаденит, причем 3 человека были серопозитивны по наличию анти-SS-А, 4 человека – по анти-SS-B, а у 4 человек данные антитела в сыворотке крови не определялись ни в одном из используемых методов (серонегативные по анти-SS-А и анти-SS-В).
Ранее в литературе было отмечено, что двойная серопозитивность по анти-SS-А(Ro) и анти-SS-B(La), наряду с ультразвуковыми изменениями при обследовании слюнных желез, являются независимыми прогностическими факторами структурного повреждения слюнных желез [7].
Ультразвуковое исследование является высокоинформативным методом оценки состояния и выявления патологических процессов больших слюнных желез [4]. Разработка балльной оценки ультразвуковых признаков в диагностике СШ прошла долгий путь от работ De Vita S. et al., 1992 г. (баллы 0–3; чувствительность 88,8% и специфичность 84,6%) и Hocevar А. et al., 2005 г. (баллы 0–48; чувствительность 58,8% и специфичность 98,7%) до Cornec et al., 2013 г. (баллы 0–4; 62,8% чувствительности и 95,0% специфичности). Нами были исследованы подчелюстные и околоушные железы (с двух сторон) с оценкой результатов согласно рекомендациям [5] по четырехбалльной шкале: оценка 0 – норма; оценка 1 – небольшие гипоэхогенные области без эхогенных полос; оценка 2 – множественные гипоэхогенные области размером < 2 мм с эхогенными полосами; оценка 3 – множественные гипоэхогенные зоны размером от 2 до 6 мм с гиперэхогенными полосами; оценка 4 – множественные гипоэхогенные зоны размером > 6 мм или множественные кальцификаты с эхогенными полосами.
В нашем исследовании у больных РА с наличием в сыворотке крови антител к SS-А(Ro) и SS-B(La) антигенам по данным УЗИ определялись более выраженные проявления сиалоаденита (рисунок 2): в группе позитивных по анти-SS-A(Ro) и анти-SS-B(La) пациентов с сиалоаденитом средний балл (по УЗИ) составил 3,5±0,5; по сравнению с группой серонегативных по анти-SS-A(Ro) и анти-SS-B(La) пациентов с сиалоаденитом – 2,0±0,5 (различия достоверны, р=0,042).
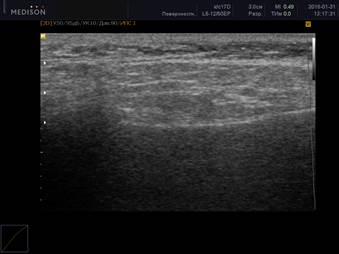
Рис. 2. Ультразвуковая картина хронического сиалоаденита: околоушная слюнная железа с измененной структурой, с появлением тяжистости и элементов фиброза
Примечание: ультразвуковая картина паренхимы слюной железы при хроническом сиалоадените характеризуется гипоэхогенностью, неоднородностью (за счет точечных и линейных гиперэхогенных включений), неровностью контура. В период обострения слюнная железа увеличивается в размерах, но её эхогенность значительно снижается, что обусловлено отеком паренхимы и гиперплазией внутрижелезистой лимфоидной ткани. Гиперэхогенные включения появляются при замещении паренхимы фиброзной тканью. Вследствие выраженного фиброза на поздних стадиях железа уменьшается в размерах.
Полученные результаты согласуются с данными Niemelä R.K. и соавт. (2004) о сильной положительной корреляции между значениями ANA и анти-Ro/SSA и/или анти-La/SSB антител с ЭХО-признаками паренхимной гетерогенности слюнных желез при проведении УЗИ. Theander E. и Mandl T. (2014) также показали, что пациенты с более высоким баллом по шкале Cornec et al. (2013) имели более высокую частоту выявления аутоантител анти-Ro/SSA, анти-La/SSB и ANA, чем у пациентов с нормальными сонографическими показателями при обследовании слюнных желез.
Выявление данных антител в сыворотке крови больных РА может иметь прогностическое значение как маркера тяжелого варианта сиалоаденита и как маркера других возможных клинических проявлений (кератоконъюнктивит, оптическая невропатия, острый неврит зрительного нерва, прогрессирование хронической атрофии зрительного нерва, нейромиелит) [8]. В то же время УЗИ критерии поражения слюнных желез являются ранним инструментом диагностики сиалоаденита, обладая доказанной положительной прогностической ценностью в 85% и общей сопоставимостью между данными УЗИ и гистологией слюнных желез в 91% [9].
Таким образом, УЗИ слюнных желез может служить полезным инструментом при выборе подгрупп пациентов с РА, которым требуется более детальное обследование и тщательное наблюдение. Пациенты с ультразвуковыми признаками структурного повреждения слюнных желез должны подвергаться детальному иммунологическому обследованию (скрининг АNA и антител к SS-А и SS-B антигенам), поскольку они подвержены повышенному риску неблагоприятного прогноза [10]. Необходимы дальнейшие исследования, чтобы выяснить потенциальную роль ультразвуковой визуализации крупных слюнных желез как диагностического и прогностического инструмента внесуставных проявлений РА.
Заключение
Наличие антител к SS-А(Ro) и SS-B(La) антигенам в сыворотке крови больных РА сочетается с поражением слюнных желез и может быть значимо в плане диагностики более серьезных клинических поражений при развитии синдрома Шегрена. Проведение ультразвукового исследования слюнных желез, как быстрого неинвазивного метода диагностики, показано не только серопозитивным по анти-SS-А(Ro) и анти-SS-B(La) пациентам, но и больным РА без данных антител при постановке диагноза синдрома Шегрена, что позволит снизить потребность в проведении биопсии слюнных желез.