Одним из важнейших патофизиологических проявлений ургентных заболеваний органов брюшной полости и забрюшинного пространства является эндогенная интоксикация. Насыщение организма различными токсическими субстанциями приводит к различным сбоям функционирования различных органов и систем, вплоть до развития их недостаточности, которая может носить фатальный характер для больного [1; 2]. В последние десятилетия в решении вопроса купирования синдрома эндогенной интоксикации проводятся многочисленные исследования по различным направлениям. Безусловный положительный результат в решении этого вопроса отводится разработкам по элиминации токсических веществ. Однако проблема далека от окончательного снятия с повестки для [3; 4]. Одним из направлений в решении проблемы остается углубленное изучение патогенеза эндотоксикоза, что позволит влиять на триггерные механизмы эндотоксиногенеза [5].
Цель исследования: у больных острым перитонитом и острым панкреатитом на основе изучения в динамике уровня продуктов эндотоксикоза в ассоциации с некоторыми агентами катаболических процессов – окислительным стрессом и фосфолипазной активностью – установить значимость последних в патогенезе развития и прогрессирования синдрома эндогенной интоксикации.
Материал и методы исследования. В основу работы положены клинико-лабораторные исследования. Для решения поставленных задач пациенты разделены на 2 группы. Первая группа (n=23) – больные острым гнойным перитонитом, развившимся вследствие острого аппендицита (n=14), прободной язвы (n=5), деструктивного холецистита (n=3). Возраст больных этой группы составил 41,1±2,3 года. Вторая группа (n=17) – пациенты с острым тяжелым панкреатитом. Возраст больных был 45,6±3,5 года.
Обследованы здоровые индивидуумы (n=17) обоих полов, в возрасте от 30 до 55 лет.
Больные первой группы оперированы, а в раннем послеоперационном периоде им проводилась стандартная терапия, второй – проводили комплексную стандартную терапию.
Больным при поступлении и в процессе терапии в течение 7 суток устанавливали выраженность синдрома эндогенной интоксикации по содержанию токсических продуктов гидрофильной и гидрофобной природы, в плазме крови оценивали активность перекисного окисления мембранных липидов, фосфолипазы А2 и супероксиддисмутазы.
Уровень среднемолекулярных олигопептидов (МСМ) в сыворотке крови определяли спектрофотометрическим способом (аппарат СФ-46) при длине волны 254 и 280 нм. Оценивали эффективную (ЭКА) и общую (ОКА) концентрацию альбумина в сыворотке крови флуоресцентным методом на специализированном анализаторе АКЛ-01 «Зонд». Затем рассчитывали резерв связывания альбумина (РСА) по формуле РСА=ЭКА/ОКА; индекс токсичности (ИТ) плазмы – по формуле ИТ=ОКА/ЭКА – 1 (Грызунов Ю.А., Добрецов Г.Е., 1994).
Уровень диеновых (ДК) и триеновых (ТК) конъюгатов в липидах устанавливали спектрофотометрическим методом при длине волны 232 и 275 нм. Концентрацию малонового диальдегида (МДА, ТБА-активные продукты) оценивали в реакции с 2-тиобарбитуровой кислотой. Активность супероксиддисмутазы (СОД) изучали в реакции с нитросиним тетразолием. Активность фосфолипазы А2 (АФА2) устанавливали по каталитической деятельности потенциометрическим методом.
Принятые за норму лабораторные данные, определены у 18 здоровых лиц обоего пола в возрасте от 22 до 63 лет.
Цифровые данные оценены с применением вариационной статистики с использованием критерия t Стьюдента, U-критерия Манна – Уитни, корреляционная зависимость – с помощью критерия r.
Результаты исследования и их обсуждение
Оценку тяжести перитонита производили с использованием Мангеймского перитонеального индекса (Mannheim Peritonitis Index, MPI). При его расчете учитываются многие показатели, в частности источник перитонита, его длительность до операции, распространенность, характер перитонеального экссудата, а также возраст пациента, его пол, наличие органной недостаточности и злокачественного образования. Оказалось, что сумма баллов составила 23,2±0,3, что соответствует средней степени тяжести.
Оценка тяжести острого панкреатита произведена по шкале APACHE II. При рассмотрении признаков заболевания, предусмотренных этой шкалой, установлено, что сумма баллов составила 11,12±0,22. Отметим, что при сумме баллов, превышающих 9, панкреатит относится к тяжелой форме, а его развитие носит преимущественно деструктивный характер [6].
Как указано выше, нами проведено исследование у больных с различной острой хирургической патологией. Отметим, что оба заболевания, хотя и относятся к ургентным болезням брюшной полости, имеют существенные отличия. В частности, у пациентов первой группы в патогенезе превалируют воспалительно-некротические явления гнойного характера, второй группы – асептического. Такой выбор болезней сделан неслучайно. Согласно цели работы, которая предусматривает определение значимости оксидативного стресса и активизации фосфолипаз в развитии и прогрессировании эндогенной интоксикации, нами произведена оценка интоксикационного синдрома в процессе болезни и ее лечения с использованием стандартных методов при гнойном (гнойном перитоните) и асептическом процессе. Указанный методический подход позволяет наиболее адекватно оценить роль деструктивных процессов, развившихся из-за мембранодестабилизирующих явлений вследствие избыточной активности перекисного окисления липидов и фосфолипаз, что в последующем и явится основой для осмысления их значимости в общем патогенезе заболевания и эндотоксинпродукции.
У пациентов первой группы в раннем послеоперационном периоде при определении выраженности синдрома эндогенной интоксикации установлен существенный рост токсических продуктов. Причем это относилось как к веществам гидрофильной, так и гидрофобной природы. Так, у пациентов с острым перитонитом уровень растворимых в воде токсических продуктов в течение 7 суток после операции повышался на 57,7–136,5% (p<0,05). Причем в первые сутки после вмешательства их содержание было выше, чем до операции, на 16,3% (p<0,05). Отмечено значительное повышение в плазме крови и уровня гидрофобных продуктов, переносчиком которых в основном является молекула альбумина. При их регистрации выявлено уменьшение эффективной концентрации альбумина на 24,1–46,2% (p<0,05). При этом резерв связывающей способности альбумина снижался на 27,5–53,3% (p<0,05), а индекс токсичности плазмы по альбумину возрастал в 1,9–4,7 раза (p<0,05) (рисунок 1).
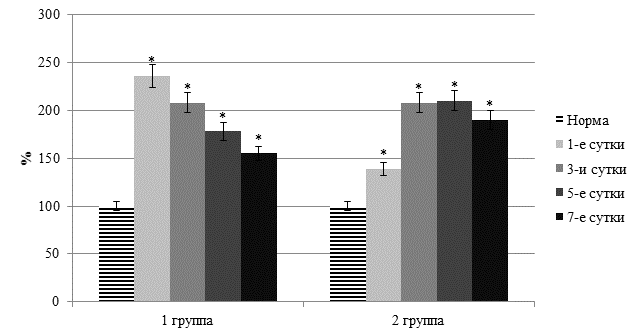
Рис. 1. Динамика содержания среднемолекулярных олигопептидов в плазме крови
(* - достоверность изменения показателя относительно нормы)
Отметим, что после операции содержание водонерастворимых токсических продуктов становилось достоверно выше, чем до операции на 22,3 3% (p<0,05).
У больных второй группы при определении выраженности синдрома эндогенной интоксикации также установлен существенный рост токсических продуктов. Подчеркнем, что и при отсутствии гнойного воспаления, который сопутствует острому панкреатиту в ранние сроки, отмечен значительный рост токсических продуктов как гидрофильной, так и гидрофобной природы.
У пациентов этой группы лабораторными исследованиями установлен рост гидрофильных токсических продуктов на 39,2–108,8% (p<0,05). Зарегистрирован рост в плазме крови и уровня токсических продуктов, нерастворимых в воде. Эффективная концентрация альбумина в процессе наблюдения за больными падала на 16,8–61,3% (p<0,05), резерв связывающей способности альбумина на 21,3–47,9% (p<0,05), индекс токсичности плазмы по альбумину повышался в 1,4–3,8 раза (p<0,05).
В целом динамика концентрации токсических продуктов в обеих группах была во многом аналогичной и определялась ростом токсических продуктов как гидрофобных, так и гидрофильных. При этом отметим, что при остром перитоните отмечено прогрессирующее их снижение, за исключением первых суток раннего послеоперационного периода, когда их количество возрастало, тогда как при остром панкреатите тяжелой степени выявлено их увеличение с последующим сохранением высокого уровня.
В работе в плазме крови нами произведена оценка интенсивности перекисного окисления мембранных липидов, что позволило в последующие этапы установить их связь с синдромом эндогенной интоксикации.
Оказалось, что у пациентов с ургентными заболеваниями живота обеих групп зарегистрировано выраженное достоверное повышение уровня молекулярных продуктов липопероксидации. Отметим, что в первой группе, на фоне гнойного воспаления, уровень первичных продуктов оксидативного стресса (диеновых конъюгатов) повышался на 32,7–126,8% (p<0,05), вторичных (триеновых конъюгатов и ТБК-реагирующих продуктов) – на 29,4–139,2% (p<0,05). Установлено, что максимальная степень оксидативного стресса в этой группе была в первые сутки после хирургического вмешательства (рисунок 2).
Повышение активности перекисного окисления мембранных липидов возникало на фоне существенного снижения энзимного антиоксидантного потенциала, что нами установлено по уменьшения активности супероксиддисмутазы, которая была меньше нормы на 17,9–41,2% (p<0,05).
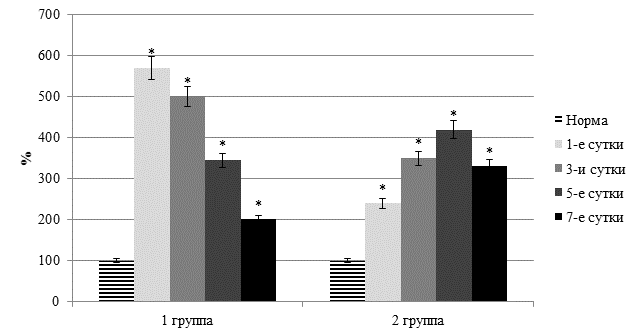
Рис. 2. Динамика индекса токсичности по альбумину плазмы крови
(* - достоверность изменения показателя относительно нормы)
Во второй группе пациентов на фоне острого тяжелого панкреатита также лабораторно установлено существенное повышение оксидативного стресса. Отметим, что при этой патологии в плазме крови отмечено еще большее увеличение содержания как первичных (на 49,1–133,2% (p<0,05)), так и вторичных (на 28,8–117,2% (p<0,05)). В целом до 5 суток отмечен постепенный рост активности перекисного окисления мембранных липидов. В этой группе больных также отмечено снижение активности супероксиддисмутазы – на 16,3–51,1% (p<0,05) (рисунок 3).
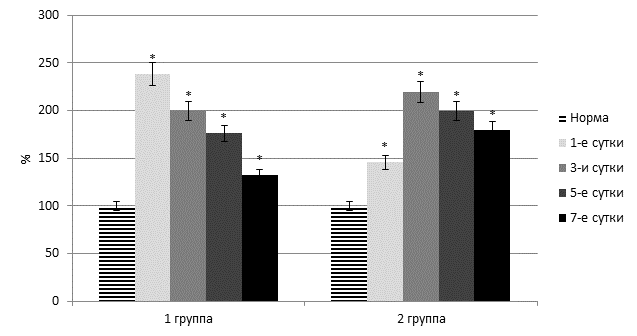
Рис. 3. Динамика содержания диеновых конъюгатов в плазме крови
(* - достоверность изменения показателя относительно нормы)
Нами установлено, что как при остром перитоните, так и при остром панкреатите в плазме крови отмечалось значительное повышение фосфолипазной активности. Так, активность фосфолипазы А2 у пациентов первой группы при остром перитоните возрастала в 1,9–3,2 раза (p<0,05), во второй при остром тяжелом панкреатите еще больше – в 3,6–10,3 раза (p<0,05) (рисунок 4).
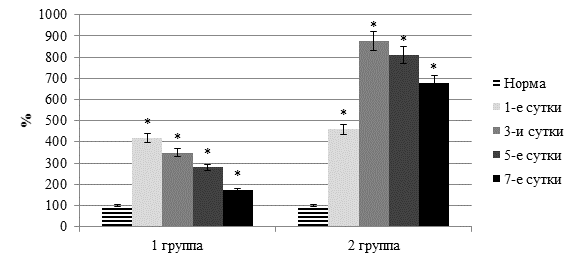
Рис. 4. Динамика активности фосфолипазы А2 в плазме крови
(* - достоверность изменения показателя относительно нормы)
Обратим внимание и на установленный факт, что у больных острым перитонитом в течение первых двух суток после хирургической терапии отмечено заметное возрастание активности липопероксидации (в среднем на 22,6%) и фосфолипазы А2 (на 36,4%).
При проведении корреляционного анализа установлено следующее. Оказалось, что при остром перитоните динамика содержания в плазме крови токсических продуктов различной природы и уровень содержания продуктов липопероксидации находятся в достоверной корреляционной зависимости – r=0,767–0,932 (p<0,05).
Установлена корреляционная связь выраженности синдрома эндогенной интоксикации и при остром тяжелом панкреатите - r=0,812–0,974 (p<0,05).
Анализируя клинико-лабораторные результаты, отметим, что при исследованных патологиях, которые в своем патогенезе существенно отличаются (при остром перитоните изначально гнойное воспаление, а при остром панкреатите – асептическое), возникает синдром эндогенной интоксикации. При остром перитоните за исследованный период (7 суток) в начале (первые двое суток после операции) он достигает апогея, а затем постепенно снижается. При остром же панкреатите он нарастает в течение 5 суток, а в последующем стабилизируется. Во многом аналогичная динамика при исследованных заболеваниях отмечена и по отношению оксидативного стресса и активности фосфолипаз. Таким образом, установлена взаимосвязь и сопряженность указанных процессов.
В силу того что оба заболевания с патофизиологической и патанатомической точек зрения существенно отличаются, но при этом имеется четкая взаимосвязь гомеостатических нарушений, то становится очевидным факт значимости мембранодеструктивных процессов в развитии эндогенной интоксикации. Подтверждением указанного явились и результаты анализа данных в раннем послеоперационном периоде у больных перитонитом: диагностирован заметный рост уровня токсических продуктов на фоне значительного возрастания активности липопероксидации и фосфолипаз.
Выводы. При острых хирургических болезнях живота развитие синдрома эндогенной интоксикации сопряжено с активизацией оксидативного стресса и фосфолипаз.
Указанная закономерность проявляется вне зависимости от характера воспалительного процесса: асептического – при остром панкреатите или гнойного – при остром перитоните.
Степень выраженности синдрома эндогенной интоксикации на ранних стадиях (до 7 суток) исследованных заболеваний во многом определяется активностью оксидативного стресса и фосфолипаз – одних из факторов катаболических процессов.



