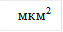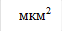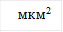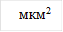Тромбоциты являются уникальными высокодифференцированными клетками, участвующими во многих физиологических процессах: регенерации, иммунном ответе, регуляции сосудистого тонуса, ангиогенезе и ремоделировании сосудов, реализации транспортных механизмов [1]. Особую роль они играют в развитии реакций свертывания крови, являясь центральным компонентом клеточного звена гемостаза, обеспечивающим остановку кровотечения за счет образования тромбоцитарного тромба и участвующим в обеспечении эффективности образования фибрина. Активность тромбоцитов во многом обусловлена особенностями структурного состояния мембранно-цитоскелетной системы и наличием в них большого количества биологически активных веществ, которые содержатся в секреторных везикулах (гранулах) и высвобождаются в процессе активации.
Оценка изменения функциональных свойств тромбоцитов имеет большое значение не только для диагностики многих патологических состояний (атеросклероза, ишемической болезни сердца и других), но и для их профилактики. В связи с этим изучение регуляторных механизмов, обеспечивающих активацию тромбоцитов, является весьма актуальным как для теории тромбообразования, так и для практической медицины. С целью определения морфологической и физиологической полноценности кровяных пластинок чаще всего исследуют адгезионную и агрегационную способность тромбоцитов. Эти показатели считаются информативными и адекватными критериями, косвенно характеризующими сохранность гемостатической функции тромбоцитов и их способность циркулировать в крови [2]. Одним из нетрадиционных методов исследования структурно-функционального состояния тромбоцитов, не получившим до настоящего времени широкого распространения, является оценка резистентности их мембраны в гипотоническом растворе [3].
Активность тромбоцитов может изменяться под действием многих факторов физической и химической природы [4]. Одним из гуморальных модуляторов морфофункциональных свойств этих клеток является оксид азота (NO), влияние которого на стадии сосудисто-тромбоцитарного гемостаза in vitro определяется количеством вещества в культуральной среде [5]. Нами показано, что инкубация с экзогенным донатором NO – нитропруссидом натрия – в конечной концентрации 100 мкмоль/л сопровождается снижением агрегационной способности тромбоцитов, свидетельствуя об угнетении их активности [6]. Тем не менее данные о влиянии оксида азота на тромбоциты не только противоречивы, но и во многом носят описательный характер, что делает актуальным выявление структурно-функциональных изменений клеток, обусловливающих модификацию их активности.
Цель исследования – выявить особенности осмотической стойкости тромбоцитов, подвергнутых преинкубации с нитропруссидом натрия.
Материал и методы исследования
В экспериментах in vitro использовано 16 беспородных крыс-самцов весом 200–220 г в соответствии с этическими правилами работы с животными («Правила лабораторной практики в Российской Федерации» приказ МЗ и СР РФ № 708н от 23.08.2010 г. и «European Convention for the Protection of Vertebral Animals Used for Experimental and Other Scientific Purposes. CETS No. 123). Забор крови осуществлялся из левого желудочка сердца после вскрытия грудной клетки. Для получения плазмы, обогащенной тромбоцитами, цитратную кровь (соотношение по объему 9:1) центрифугировали 10 минут при 460 g. Плазму разделяли на 2 аликвоты (по 0,5 мл), в одну в качестве донатора NO добавляли 0,1 мл раствора нитропруссида натрия (НПН) в конечной концентрации в инкубационной среде 100 мкмоль/л, в другую – физиологический раствор в таком же количестве. В течение 15 минут пробирки инкубировали при температуре 37 ºC.
«Гипотонический шок» моделировали разведением суспензии тромбоцитов дистиллированной водой в соотношении 1:1 при конечной концентрации раствора, эквивалентной по осмотическому давлению 0,45%-ному раствору хлорида натрия. Определяли исходную осмотическую резистентность тромбоцитов, а также через 5, 10 и 20 минут от начала воздействия. Фотографии препаратов «раздавленная капля», полученных с помощью оптической микроскопии, исследовали с использованием ImageJ – программы для анализа и обработки изображений. Осмотическую стойкость оценивали по изменению количества свободных клеток и агрегатов, их размеров и формы. Измеряли большой и малый диаметр клеток, площадь, индекс удлинения тромбоцита (ИУТ). ИУТ = (L-W) / (L+W), где L – длина, W – ширина тромбоцита. Для более детальной характеристики изменения морфометрических параметров клеток использовали гистограммы распределения их по площади.
Для статистической обработки использовались электронные таблицы Excel и программа Statistica. Оценка достоверности различий производилась по t-критерию Стьюдента, непараметрическим критериям Колмогорова–Смирнова и Манна–Уитни. Нормальность распределения определялась с помощью критерия Шапиро–Уилка.
Результаты исследования и их обсуждение
При проведении исследования выявлено, что под влиянием гипотонического раствора уже через 5 минут количество свободных тромбоцитов уменьшается как в опытных (в 6,5 раз), так и в контрольных (в 9,8 раза) препаратах (p≤0,005) (табл.). При этом число агрегатов в динамике воздействия значительно возрастает в обеих пробах, но в опыте это происходит быстрее, и к 5-й минуте показатель более чем в 3 раза превышает контрольное значение (p≤0,05).
Динамика изменения результатов морфометрического анализа препаратов
суспензии тромбоцитов под влиянием гипотонического раствора (M±м)
|
Параметры |
Исходные значения |
5 минут |
10 минут |
20 минут |
|
|
Количество свободных клеток в препарате |
Контроль |
305,6±78,1 |
60,67±21,75 * |
21,60±2,80 * |
25,75±2,95 * |
|
НПН |
285,4±25,6 |
75,25±21,28 * |
33,40±8,35 * |
27,40±9,71 * |
|
|
Количество агрегатов в препарате |
Контроль |
0 |
8,50±1,54 * |
21,00±6,11 * |
26,67±2,33 * |
|
НПН |
0 |
27,40±8,03 * # |
27,00±4,14 * |
28,25±4,49 * |
|
|
Индекс удлинения тромбоцитов, отн. ед. |
Контроль |
0,204±0,051 |
0,179±0,033 |
0,170±0,023 |
0,151±0,017 |
|
НПН |
0,382±0,020 # |
0,133±0,008 * |
0,159±0,013 * |
0,140±0,015 * |
|
Примечание: * – достоверные отличия по сравнению с исходными значениями (p≤0,05),
# – достоверные различия между опытной и контрольной группами (p≤0,05).
В гипотонической среде изменяется осмотический баланс клеток, что может быть причиной гибели их как in vitro, так и in vivo. В ответ на уменьшение осмотического давления активируются аквапорины, осуществляющие трансмембранный перенос молекул Н2О. В результате структурной перестройки увеличивается проницаемость мембраны тромбоцитов для ионов К+, Cl- и Са2+. Вход кальция в клетку активирует кальцийзависимые процессы, изменяется структура сократительных белков цитоплазматического матрикса, происходят набухание тромбоцитов с последующим разрушением, образование псевдоподий и агрегация клеток [7]. Формируются многочисленные мелкие агрегаты, которые не разрушаются при восстановлении осмотического равновесия. В составе агрегатов диаметром до 100 мкм выявляется 90–95% клеток с гранулами [8].
Анализируя динамику ИУТ, следует отметить, что исходные значения его у тромбоцитов, предварительно инкубированных с донатором NO, на 87,5% выше, чем в контроле (p≤0,05). Однако уже через 5 минут воздействия гипотонической среды он снижается на 65% и остается на протяжении всего периода наблюдения существенно меньше исходных значений (p≤0,001). Это может быть обусловлено структурными преобразованиями и снижением стабильности мембраны тромбоцитов под влиянием метаболитов NO. В контрольных пробах аналогичных изменений не происходит. В норме в гипотоническом растворе NaCl большинство тромбоцитов имеют саблевидную форму. Секреторные гранулы цитоплазмы набухают, увеличиваются в размерах, сливаясь с мембраной [9]. Увеличение диаметра везикул является сигналом к началу выброса их содержимого в окружающую среду, инициируя активацию тромбоцитов. В последующем тромбоциты истончаются и несколько удлиняются. Причем при тромбоцитопатии количество удлиненных клеток в условиях пониженного осмотического давления среды значительно меньше.
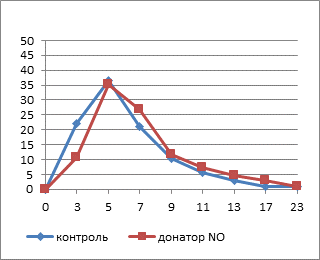
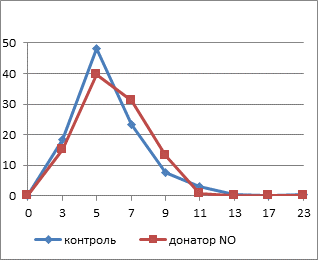
Площадь тромбоцитов, подвергнутых инкубации с НПН, в гипотоническом растворе существенно снижается уже к 5-й минуте (рис. 1), вероятно, за счет элиминации кровяных пластинок, в большей степени подвергнутых действию повреждающих факторов, которые образуются в результате индукции NO-опосредованного свободнорадикального окисления, сопровождающегося структурно-функциональными изменениями и преждевременным старением клеток. Это подтверждается результатами наших предыдущих исследований, позволивших выявить снижение индекса омоложения тромбоцитов в результате инкубации с раствором НПН в концентрации 100 мкмоль/л.

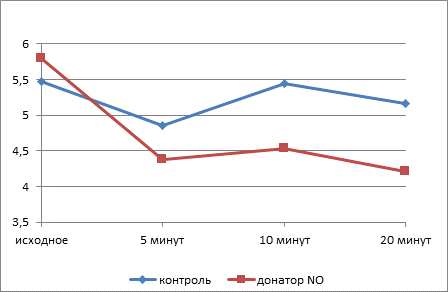
Рис. 1. Изменение площади свободных тромбоцитов в динамике действия гипотонического раствора
Примечание: * – достоверные различия между опытной и контрольной группами (p≤0,05).
Через 10 минут воздействия площадь тромбоцитов в экспериментальных препаратах была достоверно меньше контрольного значения (p≤0,005), которое практически не изменяется на протяжении всего исследуемого периода. В присутствии оксида азота наблюдается торможение эффекта накопления внутриклеточного кальция вследствие изменения конформации белков плазматической мембраны и, следовательно, ее кальциевой проницаемости [10]. Снижение активности фосфолипазы C приводит к нарушению мобилизации внутриклеточного кальция из депо. Уменьшение концентрации ионов Са2+ в клетках является основной причиной подавления их активности и сопровождается угнетением транспорта воды через мембрану.
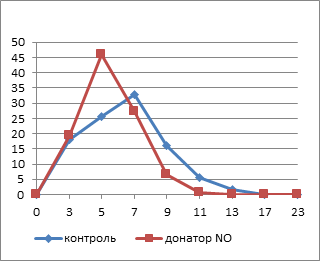
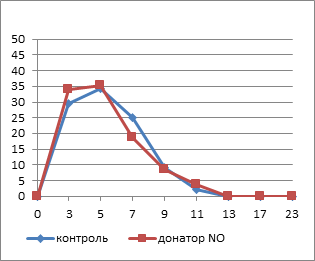
Сравнительная оценка гистограмм распределения тромбоцитов по площади свидетельствует об изменении количества тромбоцитов различного размера под действием гипотонического раствора (рис. 2). Исходные кривые характеризуются широким распределением тромбоцитов по площади с максимумом 5 мкм2 и смещением гистограммы вправо в опытных образцах в результате небольшого увеличения доли более крупных клеток после инкубации с НПН.
|
|
|
|
а |
б |
|
|
|
|
в |
г |
Рис. 2. Гистограммы распределения тромбоцитов по площади в динамике действия гипотонического раствора: а – исходные значения, б – 5 минут экспозиции, в – 10 минут экспозиции, г – 20 минут экспозиции
Через 5 минут нахождения тромбоцитов в гипотонической среде существенно повышается амплитуда модального класса в контроле до 50%, ширина распределения уменьшается в обеих группах, что говорит о снижении гетерогенности фракции тромбоцитов за счет исчезновения крупных клеток. Спустя 10 минут после начала инкубации в 0,45%-ном растворе хлорида натрия в опытных препаратах возрастает амплитуда максимума за счет уменьшения численности большеразмерных тромбоцитов. В контроле максимум смещается на 7 мкм2, снижается амплитуда модального класса, а правая ветвь гистограммы растягивается, свидетельствуя об увеличении гетерогенности тромбоцитов за счет увеличения количества клеток большого размера. К 20-й минуте воздействия гипотонической среды в обоих образцах кривые смещаются влево с появлением двух пиков 3 и 5 мкм2, что связано с увеличением фракции мелких клеток.
В норме тромбоциты циркулирующей крови имеют форму диска или пластины, состоящей из мембраны, цитоскелета, гранул и тубул [11]. В основном кровяные пластинки представлены клетками диаметром 2,8–3,4 мкм, толщиной 0,8–1,2 мкм и объемом 5,7–8,9 мкм3, с преобладанием зрелых форм, имеющих диаметр 2–3 мкм. Определяется небольшое количество молодых клеток (более 3 мкм в диаметре) и старых (менее 2 мкм). Уменьшение морфометрических свойств тромбоцитов, их площади, среднего диаметра, фактора формы является признаком угнетения функциональной активности, снижения доли «молодых» клеток. Как правило, это сопровождается отсутствием или уменьшением количества тромбоцитов с гранулами, что указывает на завершение процесса активации, а также на утрату или снижение функционального потенциала клеток [12].
Таким образом, гипотонический раствор, эквивалентный по осмотическому давлению 0,45%-ному раствору хлорида натрия, как в контрольных, так и в опытных препаратах вызывает уменьшение количества одиночных тромбоцитов и появление тромбоцитарных агрегатов. В присутствии экзогенного донатора NO, нитропруссида натрия, происходят структурно-функциональные изменения тромбоцитов и, как следствие, снижение их осмотической стойкости, проявляющееся ускоренной элиминацией в гипотонической среде поврежденных метаболитами NO клеток и подавлением трансмембранного переноса воды в динамике гипотонического воздействия. Это сопровождается уменьшением индекса элонгации и площади кровяных пластинок, что может свидетельствовать о снижении их активности.
Работа выполнена в рамках государственного задания ФГБОУ ВО «ИвГМА» Минздрава России на 2019 год «Исследование функционального резерва тромбоцитарного и гуморального компонентов гемостаза при гипоксии тканей, органов и систем».