Количество лиц, страдающих алкогольной зависимостью в России, увеличивается с каждым годом [1]. Тем не менее существует нехватка качественных исследований употребления алкоголя, и особенно необходимы те, которые касаются нейрофизиологических изменений. Одним из механизмов развития зависимого поведения является формирование генератора патологически усиленного возбуждения, который гиперактивирует центральную нервную систему (ЦНС) [2]. Повышенная активность ЦНС приводит к изменению восприятия сенсорных раздражителей [3]. Тем не менее многочисленные исследования почти все основаны на визуальной или слуховой стимуляции. В качестве сенсорных стимулов могут выступать и различные одоранты. Отсутствие данных об обонятельных способностях является серьезным недостатком для понимания алкогольной зависимости, поскольку запахи могут играть решающую роль в развитии и сохранении этого состояния.
Ольфакторные стимулы оказывают определенное влияние на физиологические и психические процессы человека, являясь компонентами системы невербальной коммуникации [4]. Первые исследования в области обоняния были сосредоточены на физиологических оценках с помощью стандартных тестов, таких как UPSIT [5]. Эти тесты являются быстрыми, надежными и могут разделить людей, различающихся хемосенсорными способностями, на группы [5]. Кроме того, временная информация о тех же процессах может быть исследована неинвазивно с помощью электроэнцефалографии (ЭЭГ). Метод ЭЭГ имеет высокое временное разрешение, и его ответ напрямую связан с функциональной активностью нейронов, которая привязана ко времени начала стимула [6]. Смена паттерна электрической активности мозга сопровождается реакциями активации или синхронизации, которые можно вызвать сенсорными раздражителями [7]. Реакция активации проявляется на ЭЭГ блокадой (десинхронизацией) альфа-ритма и/или увеличением бета- и гамма-ритма [7]. Процесс синхронизации сопровождается ростом низкочастотных ритмов (альфа-ритма и/или тета- и дельта-ритмов).
В немногочисленных исследованиях использовалась ЭЭГ, чтобы оценить изменения биопотенциалов мозга на некоторые одоранты и различия в обонятельной функциональности [8-10]. Например, обнаружено, что в ответ на запах тимола у лиц с аддиктивными расстройствами наблюдается снижение спектральной мощности альфа-ритма [11; 12]. На предъявление андростенона лица с опиоидной зависимостью реагировали повышением спектральной мощности альфа- и бета-ритма, тогда как у здоровых участников исследования наблюдалось снижение этих показателей [11]. Однако в настоящее время исследований, посвященных изучению изменений ЭЭГ в ответ на спиртовой одорант у лиц с алкогольной зависимостью, недостаточно, и они носят противоречивый характер.
В связи с этим целью настоящей работы явилось изучение динамики биоэлектрической активности мозга в ответ на предъявление ольфакторного стимула (спиртовая салфетка) у лиц с алкогольной зависимостью.
Материал и методы исследования
Исследование проводилось на базе отделения клиники НИИ психического здоровья (отделение аддиктивных состояний) г. Томска. У всех обследуемых лиц получено информированное согласие на проведение исследования. Было обследовано 40 пациентов (28 мужчин и 12 женщин) с диагнозом F10.2 по МКБ-10 (алкогольная зависимость) после детоксикации. Средний возраст пациентов составил 38,4±10,7 года. Давность заболевания составила 10,1±2,2 года. Критериями включения пациентов в исследуемую группу являлись: верифицированный диагноз расстройства по МКБ-10 (F10.2 алкогольная зависимость), добровольное согласие на участие в исследовании, возраст старше 18 лет. Критериями исключения являлись: наличие хронических соматических заболеваний в стадии обострения, аллергических реакций, ЛОР-заболеваний, эпилепсии, выраженных органических поражений головного мозга, умственная отсталость, прием лекарственных средств, оказывающих влияние на биоэлектрическую активность головного мозга, отказ от участия в исследовании. В качестве группы контроля было обследовано 40 психически и соматически здоровых лиц (25 мужчин и 15 женщин), сопоставимых по возрасту (средний возраст 33,8±8,1 года).
ЭЭГ регистрировали с 16 стандартных отведений левого и правого полушария: симметричных префронтальных – Fp1 и Fp2; лобных – F3 и F4; центральных – C3 и C4; теменных – P3 и P4; затылочных – O1 и O2; височных – F7, F8, T3, T4, T5, T6, по международной системе Г. Джаспера «10–20» при помощи 16-канального энцефалографа «Неврополиграф» (ООО «Неврокор»). Заземляющий электрод накладывается в область Fz, а референтные (А1 и А2) ипсилатерально – на мочки ушей. Частоты среза фильтров верхних и нижних частот составляли 30 и 1,5 Гц.
Схема ЭЭГ-исследования включала в себя два этапа. Сначала регистрировался фон в условиях покоя с закрытыми глазами (1 мин.). Далее предъявлялся ольфакторный стимул (одноразовая спиртовая салфетка 70%) в течение 30 с на расстоянии 4-6 см от носа, при этом глаза участника исследования оставались закрыты. После ЭЭГ-исследования все участники проходили ольфактометрическое тестирование (AST - Alcohol Sniff Test) для подтверждения обонятельной чувствительности.
На полученных ЭЭГ-записях удалялись артефактные фрагменты. Сигналы обрабатывались с помощью быстрого преобразования Фурье, анализировались значения абсолютной спектральной мощности (мкВ²) для θ– (4–7 Гц), α– (8–13 Гц) и β– (14–30 Гц) ритмов и рассчитывались средние соотношения мощности ритмов по всем отведениям по формуле: 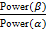 .
.
Статистическая обработка данных выполнялась с помощью пакета программ SPSS Statistics 17.0. Данные представлены в виде Median (Q1; Q3). Проверка согласия с нормальным законом распределения проводилась с помощью критерия Шапиро–Уилка. Полученные данные не подчинялись нормальному закону распределения. Использовался непараметрический критерий Вилкоксона для оценки различий в ответ на ольфакторный стимул в каждой группе (фон vs. стимул). Различия считались статистически значимыми при уровне значимости р<0,05 [13].
Результаты исследования и их обсуждение
Сравнение спектральной мощности на фоновой записи (фон) и в ответ на ольфакторный стимул (стимул) в группе пациентов выявило статистически значимое снижение θ–ритма в левом затылочном отведении (О1), α–ритма во фронтальных отделах слева (F3) и справа (F4), а также β–ритма (F3 и F4) (таблицы 1-3). При этом в группе контроля изменения в ответ на одорант представлены более широко (по количеству отведений и уровню значимости). В частности, при предъявлении ольфакторного раздражителя у лиц из группы контроля наблюдается статистически значимое снижение тета-ритма во фронтальных (Fp1; Fp2; F4; F7; F8), теменных отведениях (P3; P4) и части височных (T3; T6), альфа-ритма в теменных (P3; P4), задне-височных (T5; T6) и затылочных отведениях (О1; О2), а также бета-ритма во фронтальных (F3; F4), центральных (С3), теменных (Р3; Р4), височных (Т5) и затылочных отведениях (О1; О2). Данный факт указывает на сниженную функциональную лабильность головного мозга у пациентов с алкогольной зависимостью, т.е. скорость протекания элементарных реакций нейронов.
Для более детальной оценки изменений биопотенциалов головного мозга в ответ на запах спирта нами были рассчитаны и проанализированы соотношения  ритмов. Как показали наши предыдущие исследования, данное соотношение является более объективным параметром оценки ЭЭГ, которое позволяет выявить не только направленность изменений (активация или синхронизация), но и их степень [12].
ритмов. Как показали наши предыдущие исследования, данное соотношение является более объективным параметром оценки ЭЭГ, которое позволяет выявить не только направленность изменений (активация или синхронизация), но и их степень [12].
Таблица 1
Изменение спектральной мощности тета–ритма в ответ на предъявление ольфакторного стимула в группах пациентов с алкогольной зависимостью и контроля
|
Контроль |
Пациенты |
|||||
|
тета-ритм |
фон |
стимул |
р |
фон |
стимул |
р |
|
Fp1 |
8,4 (5,2; 12,8) |
8,0 (5,3; 10,2) |
0,002 |
7,2 (5,6; 11,2) |
6,1 (4,9; 11,4) |
0,577 |
|
Fp2 |
8,9 (4,9; 13) |
7,1 (4,9; 10,5) |
0,008 |
6,8 (5; 10,9) |
6,9 (4,5; 9,4) |
0,983 |
|
F3 |
9,1 (6,6; 12,9) |
8,9 (6,9; 13,5) |
0,232 |
7,2 (4,9; 11,5) |
6,8 (4,5; 9,3) |
0,132 |
|
F4 |
7,4 (5,5; 14,3) |
7,2 (5,6; 10,9) |
0,006 |
6,8 (4,9; 11) |
6,5 (5; 9,7) |
0,973 |
|
F7 |
3,75 (3,1; 7,4) |
3,25 (3; 5,8) |
0,028 |
5,9 (3,7; 8,6) |
4,9 (3,9; 8,3) |
0,594 |
|
F8 |
3,35 (2,8; 7,2) |
3,05 (2,5; 6,8) |
0,013 |
5,1 (3; 8,9) |
7 (4,5; 9,5) |
0,208 |
|
C3 |
8,45 (5,4; 11,3) |
8,45 (6,3; 11,8) |
0,177 |
5,3 (3,7; 8,5) |
4,9 (3,8; 8,1) |
0,819 |
|
C4 |
6,75 (5,0; 10,9) |
6,9 (5,4; 10,1) |
0,225 |
6,8 (4; 12,7) |
6,5 (3,9; 10) |
0,223 |
|
T3 |
3,05 (1,9; 5,3) |
2,9 (1,6; 4,9) |
0,001 |
2 (1,5; 3,9) |
2 (1,4; 3,8) |
0,127 |
|
T4 |
2,25 (1,7; 3,5) |
2,35 (1,7; 2,9) |
0,344 |
2,5 (1,5; 4,9) |
2,6 (1,7; 4,6) |
0,374 |
|
P3 |
9,2 (6,2; 15,2) |
8,8 (4,9; 14,3) |
0,007 |
6,4 (4,5; 10,9) |
5,4 (4,2; 10,9) |
0,058 |
|
P4 |
9,2 (5,3; 16,6) |
8,5 (4,8; 13,5) |
0,001 |
6,6 (4,8; 10,3) |
6,6 (4,9; 10,3) |
0,933 |
|
T5 |
4,6 (2,6; 12,2) |
5,85 (2,2; 11) |
0,929 |
5,3 (2,9; 13) |
5,7 (2,1; 12,5) |
0,602 |
|
T6 |
4,65 (3,1; 12,2) |
4,35 (2,7; 11,7) |
0,016 |
5,15 (3,9; 10,9) |
5,3 (3,8; 9,1) |
0,808 |
|
O1 |
7,1 (5,6; 9,1) |
6,95 (5,4; 10,1) |
0,173 |
8,4 (5,1; 16,4) |
6,4 (3,2; 12,7) |
0,007 |
|
O2 |
6,25 (4,7; 12,6) |
6,35 (4; 12,3) |
0,153 |
8,5 (4,5; 13) |
7,7 (4,8; 12,6) |
0,290 |
Примечание. Median (Q1; Q3); р - уровень статистической значимости при сравнении групп с использованием критерия Вилкоксона.
Таблица 2
Изменение спектральной мощности альфа–ритма в ответ на предъявление ольфакторного стимула в группах пациентов с алкогольной зависимостью и контроля
|
Контроль |
Пациенты |
|||||
|
альфа-ритм |
фон |
стимул |
р |
фон |
стимул |
р |
|
Fp1 |
12,1 (7,1; 17,5) |
10,5 (6,4; 17,9) |
0,075 |
11,1 (7,6; 16,4) |
9,9 (7,1; 13,7) |
0,139 |
|
Fp2 |
13,6 (7,1; 19) |
12,6 (6,1; 19,9) |
0,346 |
11,5 (7,6; 15,2) |
9,9 (7; 15) |
0,056 |
|
F3 |
14,9 (8,9; 26) |
14,8 (8; 24,4) |
0,731 |
13,2 (8,4; 19,7) |
11,7 (8,3; 16,9) |
0,036 |
|
F4 |
16,6 (8,7; 25) |
16,8 (7,7; 24,7) |
0,887 |
12,8 (8,8; 18,4) |
11,1 (7,5; 16) |
0,049 |
|
F7 |
6,2 (3,7; 7,6) |
6,05 (3,3; 9,9) |
0,314 |
9,2 (4,6; 11) |
8,5 (4,5; 10,2) |
0,484 |
|
F8 |
6,85 (3,4; 10,9) |
6,75 (3,1; 12) |
0,308 |
7,7 (4,8; 12,7) |
7,5 (5,8; 14,4) |
0,343 |
|
C3 |
18,2 (13,3; 27,4) |
17,7 (11,6; 26) |
0,089 |
13,4 (9,3; 23,5) |
11,8 (9,2; 19,5) |
0,349 |
|
C4 |
15,8 (10,8; 27) |
16,3 (8,5; 23,6) |
0,062 |
17 (10,2; 31,2) |
14,1 (8,4; 28,7) |
0,121 |
|
T3 |
5 (4; 6,7) |
4,8 (3,5; 6,4) |
0,117 |
4,4 (2,7; 8,8) |
4,3 (2,4; 8,8) |
0,080 |
|
T4 |
4,7 (3; 5,8) |
4,4 (2,7; 5,8) |
0,376 |
4,9 (3,7; 7,1) |
4,9 (3,3; 7,2) |
0,069 |
|
P3 |
36,4 (16; 82,4) |
27 (12,2; 55,2) |
0,002 |
18,7 (12,3; 37) |
19,3 (12,9; 29) |
0,183 |
|
P4 |
38 (17,9; 80,8) |
29 (12,8; 60,1) |
0,009 |
23,8 (15,4; 33) |
22,9 (16,7; 35) |
0,500 |
|
T5 |
21 (11,5; 38,4) |
17,95 (9; 32,3) |
0,004 |
11,1 (8,1; 18,8) |
12,95 (9,5; 18) |
0,783 |
|
T6 |
25,05 (11,4; 37) |
20,9 (8,2; 29,4) |
0,009 |
14,9 (8,9; 20,2) |
14,5 (9,3; 17,6) |
0,592 |
|
O1 |
38,15 (18,9; 76,7) |
32,2 (14; 70,4) |
0,006 |
27,1 (14,3; 61) |
28,6 (13,7; 69) |
0,597 |
|
O2 |
38,85 (17,7; 99) |
36,3 (12,4; 90) |
0,006 |
31 (16,6; 83,6) |
25,5 (18,4; 79) |
0,302 |
Примечание. Median (Q1; Q3); р - уровень статистической значимости при сравнении групп с использованием критерия Вилкоксона.
Таблица 3
Изменение спектральной мощности бета–ритма в ответ на предъявление ольфакторного стимула в группах пациентов с алкогольной зависимостью и контроля
|
Контроль |
Пациенты |
|||||
|
бета-ритм |
фон |
стимул |
р |
фон |
стимул |
р |
|
Fp1 |
6,2 (4,6; 9,5) |
6,1 (4,6; 9,6) |
0,129 |
12,4 (8,6; 19) |
11,5 (8,6; 14,5) |
0,082 |
|
Fp2 |
6,2 (4; 8,5) |
6,1 (3,8; 8,5) |
0,587 |
12,6 (6,8; 17,4) |
11,4 (6,9; 15,3) |
0,072 |
|
F3 |
7,6 (4,4; 11,1) |
6,8 (4,3; 10,1) |
0,003 |
16,9 (9,4; 24,5) |
15 (8,4; 20) |
0,001 |
|
F4 |
7,3 (4,2; 8,6) |
6,6 (4; 8,6) |
0,009 |
15,5 (7,9; 22,1) |
14,8 (8,4; 17,8) |
0,044 |
|
F7 |
4 (3; 5,9) |
3,55 (3,2; 4,2) |
0,086 |
9,3 (5,9; 13,2) |
7,4 (6,2; 12,3) |
0,953 |
|
F8 |
4,15 (2,9; 5,1) |
3,7 (2,9; 4,7) |
0,953 |
8 (6,8; 9,1) |
7,6 (6,7; 8,7) |
0,374 |
|
C3 |
7,25 (4,8; 9,4) |
6,4 (4,2; 8,1) |
0,041 |
15,6 (9,4; 23,9) |
12,5 (8,9; 19,5) |
0,089 |
|
C4 |
6,8 (3,9; 9) |
6,05 (3,8; 8,5) |
0,191 |
15,5 (8,5; 23,9) |
13,9 (9; 22,8) |
0,331 |
|
T3 |
4,4 (2,9; 9,2) |
4,25 (2,9; 10,1) |
0,627 |
10,6 (4,3; 18) |
8,6 (4,2; 14,5) |
0,316 |
|
T4 |
3,55 (2,7; 7,2) |
3,8 (1,9; 7) |
0,968 |
12,5 (4,2; 20,4) |
10,3 (5; 20,3) |
0,461 |
|
P3 |
9,5 (5,4; 13,4) |
7,6 (4,8; 12,4) |
0,001 |
14,9 (9,6; 21,9) |
15,1 (9,3; 19,2) |
0,074 |
|
P4 |
9,8 (5,3; 14,5) |
9,1 (5,2; 13,1) |
0,006 |
14 (9,3; 23,8) |
14,6 (9,3; 21,9) |
0,182 |
|
T5 |
8,45 (5,5; 11,4) |
8,15 (5; 12,3) |
0,030 |
8,95 (5,4; 14,4) |
8,65 (5,8; 12,4) |
0,673 |
|
T6 |
9,6 (5,3; 14,3) |
8,3 (5; 14,4) |
0,112 |
9,45 (5,4; 14,4) |
10,2 (6,7; 13,6) |
0,322 |
|
O1 |
9,75 (5,9; 11,2) |
9,1 (4,9; 11,4) |
0,008 |
16,1 (10,8; 36) |
18,5 (10,9; 38) |
0,435 |
|
O2 |
10,65 (6,1; 14,7) |
10,2 (5,3; 13,9) |
0,012 |
19,7 (11,3; 31) |
20,6 (13; 33,4) |
0,981 |
Примечание. Median (Q1; Q3); р - уровень статистической значимости при сравнении групп с использованием критерия Вилкоксона.
При сравнении соотношений  в покое (фон) и в условиях ольфакторной нагрузки (стимул) в группе пациентов обнаружено статистически значимое снижение
в покое (фон) и в условиях ольфакторной нагрузки (стимул) в группе пациентов обнаружено статистически значимое снижение  (р=0,015). В группе контроля предъявление одоранта приводило к статистически значимому увеличению исследуемого параметра (р=0,0043) (рисунок).
(р=0,015). В группе контроля предъявление одоранта приводило к статистически значимому увеличению исследуемого параметра (р=0,0043) (рисунок).
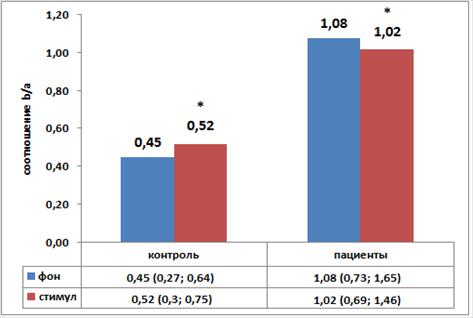
Графики значений коэффициента активации коры
Примечание. Median (Q1; Q3); * - уровень статистической значимости при сравнении групп с использованием критерия Вилкоксона.
Таким образом, мы показали, что степень снижения β–ритма в группе пациентов значительно превосходит снижение α–ритма при восприятии алкогольного раздражителя. Полученные нами данные говорят о снижении общей активности ЭЭГ (синхронизации) в группе пациентов с алкогольной зависимостью в ответ на ольфакторный стимул. При этом фоновая ЭЭГ у пациентов с алкогольной зависимостью характеризовалась существенным снижением альфа-мощности, редукцией амплитуды и ритмичности альфа-ритма и преобладанием высокочастотной активности (бета-ритма) (таблица 1). В контрольной группе запах спирта приводил к противоположным изменениям - реакции активации (резкое снижение альфа-ритма).
Согласно исследованиям, ЭЭГ-реакция активации представлена ориентировочным рефлексом (ОР) [7; 14; 15]. Первоначально новый стимул приводит к генерализованному ОР, который связан с возбуждением ретикулярной формации (РФ). Генерализованный ОР быстро снижается или вообще не возникает после многократного повторения стимула [7; 14; 16]. Данный факт может объяснять причину синхронизации на ЭЭГ при восприятии спиртового запаха у аддиктов. Т.е. при злоупотреблении алкоголем происходит реакция угасания, ведущая к потере способности данного стимула вызывать ОР. Тогда как для лиц, не страдающих алкогольной зависимостью, вышеуказанный одорант имеет относительную новизну и вызывает безусловный ОР.
Заключение
Таким образом, были продемонстрированы особенности восприятия запаха спирта у пациентов с алкогольной зависимостью, заключающиеся в реакции синхронизации на ЭЭГ. Также было показано, что у пациентов наблюдается снижение функциональной лабильности коры больших полушарий мозга. Полученные данные могут лечь в основу создания нейрофизиологических критериев диагностики алкогольной зависимости, оценки степени тяжести заболевания (оценка хемосенсорной чувствительности), а также прогностических моделей в будущем.



