Болезнь Паркинсона (БП) – вторая в мире по распространенности нейродегенеративная патология. Это хроническое прогрессирующее заболевание, преимущественно связанное с гибелью нейронов черной субстанции и приводящее к нарушению функции базальных ганглиев в условиях дофаминергического дефицита [1]. БП проявляется сочетанием гипокинезии и ригидности, тремора покоя, постуральной неустойчивостью, психическими и вегетативными расстройствами. В основе БП лежит расстройство двигательной активности. В качестве возможных факторов, способствующих развитию БП, рассматривали: возраст, генетическую предрасположенность, воздействие окружающей среды, оксидативный стресс. Предполагают, что на молекулярном уровне развитие БП происходит вследствие нарушения метаболизма α-синуклеина (образование телец Леви) в головном мозге. Считается, что окислительный стресс, митохондриальная дисфункция и генетическая предрасположенность приводят к гиперагрегации α-синуклеина, а накопление агрегированной формы α-синуклеина является причиной повреждения синапсов и дегенерации дофаминергических и других типов нейронов [2].
Помимо теории развития БП, связанной с формированием телец Леви из агрегированной формы α-синуклеина, существуют также свободнорадикальная и митохондриальная теории развития заболевания. Среди новых гипотез развития БП – immune-aging (умеренная воспалительная реакция, связанная с возрастным снижением функции иммунной системы), окислительный и нитрозативный стресс, возникающие при депрессии и периферическом воспалении [3]. Известно, что в физиологических условиях в центральной нервной системе (ЦНС) млекопитающих количество иммунных клеток остается сравнительно небольшим, однако при возникновении патологии (инфекция, травма мозга и т.д.) их количество резко возрастает. Нейровоспаление со временем приводит к нейродегенерации, свойственной таким заболеваниям, как болезни Альцгеймера, Паркинсона и др. [4]. Имеются данные, согласно которым Т-хелперы 17-го типа вовлекаются в патогенез БП [5]. Однако исследования, посвященные изучению роли Т-клеток в патогенезе БП, достаточно противоречивы.
Как известно, τ-протеин является маркером, специфическим для болезни Альцгеймера, однако в последнее время появляются данные о его вовлеченности в патогенез БП [6]. TGFα – член семейства эпидермальных факторов роста (EGF), митогенный полипептид [7], который обладает ангиогенным эффектом и способствует развитию опухолей [8]. NF-kB – транскрипционный фактор с широким спектром функций, включающих контроль экспрессии генов иммунного ответа, апоптоза и клеточного цикла. Нарушение регуляции NF-kB приводит к развитию воспаления, аутоиммунных заболеваний, вирусных инфекций и различных опухолей [9]. Сравнительное изучение экспрессии перечисленных молекул в черной субстанции головного мозга и периферической крови пациентов с БП и без нейропатологии позволит оценить роль иммунной системы в развитии этого заболевания. В связи с вышеизложенным была поставлена цель исследования: сравнить экспрессию τ-протеина, цитокина TGFα и транскрипционного фактора NF-kB в черной субстанции и лимфоцитах периферической крови пациентов пожилого и старческого возраста с БП и лиц без нейродегенеративных заболеваний.
Материалы и методы исследования. Аутопсийный материал черной субстанции головного мозга был получен от 60 пациентов с БП и 60 лиц без патологии центральной нервной системы, умерших от сердечно-сосудистых заболеваний (группа «норма»). Каждая группа состояла из двух равных по численности пациентов подгрупп – лиц пожилого и старческого возраста. Аналогичное разделение на группы было проведено для 126 образцов периферической крови индивидов с БП и без нейродегенеративных заболеваний. Из образцов периферической крови готовили мазки на предметных стеклах, покрытых полилизином. Клетки фиксировали спиртом для дальнейшего изучения. Иммуногисто- и иммуноцитохимическими методами оценивали экспрессию τ-протеина, TGFα, NF-kB в аутопсийном материале черной субстанции и образцах периферической крови пациентов без нейропатологии и с БП. Препараты обрабатывали первичными антителами к τ-протеину (1:75, Dako), α-синуклеину (1:100, Abcam), TGFα (1:100, Abcam) и NF-kB (1:150, Dako). Анализ полученных образцов проводили на инвертированном конфокальном микроскопе «Olympus» Fluoview CM FV300-IX70.
Результаты окрашивания оценивали морфометрическим методом с использованием системы компьютерного анализа микроскопических изображений, состоящей из микроскопа «Olympus» Fluoview CM FV300-IX70, цифровой камеры Olympus, персонального компьютера и программы «VidеotestMorphology 5.2». Площадь экспрессии рассчитывали как отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения и выражали в процентах. Статистическая обработка экспериментальных данных включала в себя подсчет среднего арифметического, стандартного отклонения и доверительного интервала для каждой выборки и проводилась в программе «Statistica 6.0». Для анализа вида распределения использовали критерий Шапиро–Уилка. Для проверки статистической однородности нескольких выборок были использованы непараметрические процедуры однофакторного дисперсионного анализа (критерий Крускала–Уоллиса). В случаях, когда дисперсионный анализ выявлял статистически значимую неоднородность нескольких выборок, для последующего выявления неоднородных групп (путем их попарных сравнений) применяли процедуры множественных сравнений с помощью U-критерия Манна–Уитни. Критический уровень достоверности нулевой гипотезы (об отсутствии различий) принимали равным 0,05.
Результаты исследования и их обсуждение
Результаты
Площадь экспрессии τ-протеина в черной субстанции головного мозга возрастала на два порядка у пациентов с БП по сравнению с нормой, как в пожилом, так и в старческом возрасте (рис. 1). У пациентов с БП площадь экспрессии α-синуклеина в черной субстанции значительно возрастала по сравнению с нормой: у пожилых людей – в 23 раза и у лиц старческого возраста – в 25 раз. Площадь экспрессии TGFα также значительно возрастала при БП по сравнению с нормой: в 19 раз у пациентов пожилого возраста с БП и в 18 раз у пациентов старческого возраста с БП. Площадь экспрессии NF-kB при БП повышалась в 3,7 раза в группе лиц пожилого возраста и в 3,5 раза – у людей старческого возраста (табл. 1). Аналогичную тенденцию наблюдали при изучении площади экспрессии τ-протеина, TGFα и NF-kB в лимфоцитах крови пациентов пожилого и старческого возраста в норме и при БП (табл. 2). Площадь экспрессии τ-протеина в лимфоцитах крови пациентов пожилого и старческого возраста с БП повышалась более чем на два порядка по сравнению с индивидами тех же возрастных групп без нейропатологии. Площадь экспрессии α-синуклеина в лимфоцитах крови людей пожилого и старческого возраста с БП была соответственно в 4,3 и 8 раз больше по сравнению с этим показателем у обследованных без патологии ЦНС. Площадь экспрессии цитокина TGFα в лимфоцитах крови пациентов пожилого и старческого возраста с БП возрастала соответственно в 19 и 18 раз по сравнению с нормой. Площадь экспрессии транскрипционного фактора NF-kB в лимфоцитах крови пациентов пожилого и старческого возраста с БП возрастала соответственно в 3,7 и 3,5 раза по сравнению с лицами без нейропатологии (рис. 2).
Таблица 1
Площадь экспрессии сигнальных молекул в черной субстанции головного мозга в норме и при болезни Паркинсона
|
Маркер |
Площадь экспрессии (N±n), % |
|||
|
Пожилой возраст |
Старческий возраст |
|||
|
Норма |
БП |
Норма |
БП |
|
|
τ-протеин |
0,10±0,02 |
13,05±0,22* |
0,19±0,03* |
19,97±0,26**# |
|
α-синуклеин |
0,07±0,02 |
0,30±0,04* |
0,08±0,02 |
0,54±0,09**# |
|
TGFα |
0,04±0,01 |
0,76±0,15* |
0,04±0,01 |
0,72±0,12** |
|
NF-kB |
0,07±0,015 |
0,26±0,05* |
0,10±0,03 |
0,35±0,06**# |
* – р<0,05 – по сравнению с нормой у пожилых людей
** – р<0,05 – по сравнению с нормой у людей старческого возраста
# – р<0,05 по сравнению с людьми пожилого возраста с БП
N – среднее значение, n – доверительный интервал.
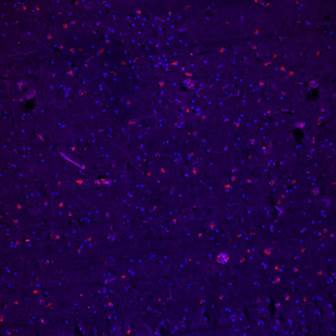
Рис. 1. Иммунофлуоресцентное окрашивание черной субстанции головного мозга антителами к τ-протеину, пациент 85 лет, БП. Конфокальная микроскопия, х100.
τ-протеин – Alexa 567 – красная флуоресценция. Ядра докрашены Hoest 33258 – голубая флуоресценция. Ярко выражена экспрессия τ-протеина (красная флуоресценция) в черной субстанции головного мозга, тогда как у пациентов старческого возраста такой иммунопозитивной реакции не наблюдалось
Таблица 2
Площадь экспрессии сигнальных молекул в лимфоцитах крови в норме и при болезни Паркинсона
|
Маркер |
Площадь экспрессии (N±n),% |
|||
|
Пожилой возраст |
Старческий возраст |
|||
|
Норма |
БП |
Норма |
БП |
|
|
τ-протеин |
0,02±0,005 |
0,87±0,09* |
0,02±0,005 |
1,03±0,12** |
|
α-синуклеин |
0,02±0,005 |
0,15±0,03* |
0,025±0,005 |
0,20±0,05** |
|
TGFα |
0,34±0,11 |
0,76±0,15* |
0,46±0,10* |
0,79±0,13** |
|
NF-kB |
0,21±0,08 |
1,19±0,14* |
0,30±0,08 |
1,67±0,12**# |
* – р<0,05 – по сравнению с нормой у пожилых людей
** – р<0,05 – по сравнению с нормой у людей старческого возраста
# – р<0,05 по сравнению с людьми пожилого возраста с БП
N – среднее значение, n – доверительный интервал.
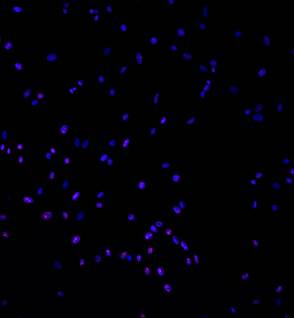 А
А 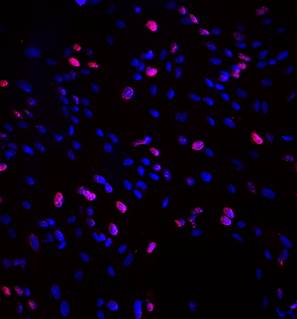 Б
Б
Рис. 2. Иммунофлуоресцентное окрашивание лимфоцитов крови с антителами к NF-kB, конфокальная микроскопия, х100. NF-kB – Alexa 567 – розовая флуоресценция, ядра докрашены Hoest 33258 – голубая флуоресценция. А – пациент 67 лет без патологии центральной нервной системы, Б – пациент 69 лет с БП. У пациента с БП в лимфоцитах крови ярко выраженная экспрессия NF-kB, тогда как у обследуемого без нейропатологии этого не наблюдалось
Обсуждение. Предполагается, что активация иммунного ответа, оцениваемая по экспрессии TGFα, NF-kB и наблюдаемая у пациентов с БП, может быть причиной, а не следствием гибели нейронов. F. Garretti и соавт. (2019) выдвигают гипотезу о том, что длительное хроническое системное воспаление может приводить к повышению проницаемости гематоэнцефалического барьера, в результате чего происходит проникновение Т-клеток в ЦНС. Накопление α-синуклеина, основного молекулярного маркера БП, может способствовать миграции Т-клеток, специфичных к α-синуклеину, развитию аутоиммунной реакции и последующего воспаления (рис. 3). При этом CD4+ и CD8+ Т-лимфоциты распознают пептидные участки главного комплекса гистосовместимости (ГКГС) 2-го типа на микроглии и ГКГС 1-го типа на дофаминергических нейронах, что приводит к их гибели и усугублению симптомов БП. Гипотеза требует подтверждения, однако если Т-клетки, специфичные к α-синуклеину, действительно вызывают нейродегенерацию при БП, то методы диагностики и лечения БП могут быть адаптированы с целью выявления аутоиммунных клеток у пациентов и воздействия на них [10]. Установленное в нашем исследовании многократное повышение экспрессии α-синуклеина в лимфоцитах крови пациентов с БП разного возраста, коррелирующее с этим показателем в черной субстанции, подтверждает эту гипотезу.
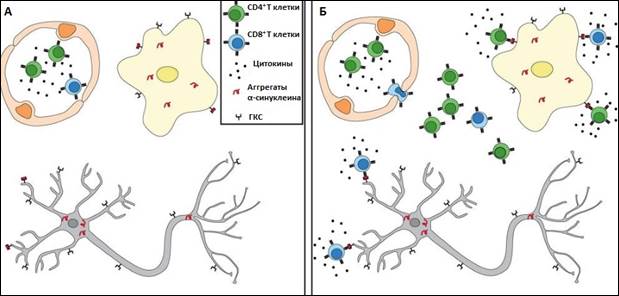
Рис. 3. Гипотеза аутореактивных Т-клеток при БП. Т-клетки, специфичные к α-синуклеину, проникают в ЦНС и распознают антиген, представленный микроглией и дофаминергическими нейронами. (A) До повреждения ГЭБ периферические Т-клетки, специфичные к α-синуклеину, циркулируют по крови в присутствии провоспалительных цитокинов. Агрегаты α-синуклеина формируются в дофаминергических нейронах и микроглии. (Б) Повышенная проницаемость ГЭБ позволяет Т-клеткам, специфичным к α-синуклеину, проникать через ГЭБ. На ГКГС-1 дофаминергических нейронов и ГКГС-2 микроглии представлены фрагменты α-синуклеина, распознаваемые Т-клетками. Активация T-клеток ведет к высвобождению гранзимов и провоспалительных цитокинов. Дофаминергические нейроны в конечном итоге умирают в присутствии устойчивого воспаления и цитотоксической среды [10]
Заключение. Повышенная экспрессия τ-протеина в черной субстанции головного мозга и аналогичное повышение концентрации этого белка в образцах периферической крови у пациентов при БП по сравнению с возрастной нормой позволяют предположить возможность прижизненной оценки уровня τ-протеина. Возможно использование периферической крови рекомендуется для прижизненной оценки уровня τ-протеина, α-синуклеина, TGFα и NF-kB у людей пожилого и старческого возраста с целью ранней диагностики БП.



