Известно, что в настоящее время одним из наиболее распространенных подходов для исследования нейрофизиологических механизмов деятельности головного мозга является ранее выдвинутое М.Н. Ливановым представление о функциональном объединении различных структур головного мозга на основе пространственной синхронизации потенциалов ЭЭГ. Отличительной особенностью феномена пространственной синхронизации является сопряженность (когерентность) энергетических и временных параметров потенциалов, отражающих соотношение электрических процессов мозга и динамику их развития в пространственно разнесенных участках центральной нервной системы [1]. Экспериментальное развитие основных положений этой концепции позволило подойти непосредственно к анализу механизмов регуляции процессов, непрерывно сопровождающих аналитико-синтетическую деятельность мозга [2, 3].
С этой точки зрения анализ механизмов регуляции когерентных связей при развитии различного рода функциональных нарушений представляет несомненный интерес. Особого внимания заслуживают нейромодуляторные системы мозга благодаря особенностям ультраструктурной организации и синаптологии нейронов, синтезирующих серотонин (5-НТ) и норадреналин (НА). К настоящему времени накоплено огромное количество экспериментальных фактов, согласно которым МА-эргические системы играют важную роль в формировании и регуляции нейрофизиологических механизмов пластического обеспечения нервных процессов [4].
Цель исследования
Целью настоящего исследования является сравнительный анализ влияния электрической стимуляции различных компонентов МА-эргической системы мозга на регуляцию когерентных связей потенциалов ЭЭГ центральных структур зрительного анализатора в условиях экспериментальной дистрофии сетчатки.
Материал и методы исследования
Эксперименты были проведены в условиях хронических опытов на 11 бодрствующих половозрелых кроликах-самцах весом 2,5–3,0 кг. Суммарные потенциалы регистрировали с помощью монополярных нихромовых макроэлектродов, предварительно вживленных в различные структуры зрительного анализатора по стереотаксическим координатам атласа [5]. Регистрировали потенциалы зрительной коры (ЗрК), верхних бугров четверохолмия (ВБЧ), наружного коленчатого тела (НКТ) до и после формирования экспериментальной дистрофии сетчатки. Экспериментальную дистрофию сетчатки создавали однократным введением 2%-ной монойодуксусной кислоты (МЙУК, 18 мг/кг) в ушную вену по известной методике [6].
К экспериментам приступали спустя 3–4 дня после адаптации животных к экспериментальной установке. С целью контроля функционального состояния сетчатки регистрировали электроетинограмму (ЭРГ) на ритмическую фотостимуляцию с помощью специальных накладных электродов. Электрическую стимуляцию МА-эргических ядер шва (nR) и голубоватого пятна (LС) осуществляли прямоугольными импульсами тока (100–150 Гц; 0,1–0,2 мА; 1,5 мс) в течение 5–6 минут. Регистрацию и статистический анализ потенциалов осуществляли с помощью программного обеспечения «Brainsys» (Россия). ВП анализировали методом синхронного суммирования, усредненные значения коэффициентов когерентности (Coh) вычисляли для стандартных диапазонов ЭЭГ (δ, θ, α, β1 и β2). Достоверность полученных данных определяли с помощью пакета программы ANOVA, по окончании опытов экспериментальных животных подвергали декапитации для верификации подкорковых электродов.
Результаты исследования и их обсуждение
Перед основными экспериментами предварительно были проанализированы когерентные связи ЭЭГ между центральными структурами зрительного анализатора в период спокойного бодрствования экспериментальных животных. Результаты проведенных экспериментов выявили принципиальные различия в распределении коэффициентов Coh между подкорковыми и корково-подкорковыми структурами мозга. Было обнаружено, что в условиях спокойного бодрствования значения коэффициентов Coh между анализируемыми структурами варьируют в достаточно широких пределах. При этом, если сравнительно высокие значения Coh были более характерны между потенциалами ЗрК и НКТ во всем диапазоне исследуемых частот ЭЭГ, то сравнительно слабые когерентные связи были выявлены между подкорковыми структурами анализатора. Следует также отметить, что если для пары ЗрК – НКТ максимальные значения Coh были выявлены в δ и α диапазонах ЭЭГ и находились в пределах 0,6, то между подкорковыми структурами максимальные значения когерентных связей не превышали 0,4 в α и β диапазонах. В отличие от этого для пары ЗрК – ВБЧ в период фоновой активности была характерна стабильная картина распределения значений Coh в пределах 0,5 во всем диапазоне анализируемых частот ЭЭГ (рис. 1).
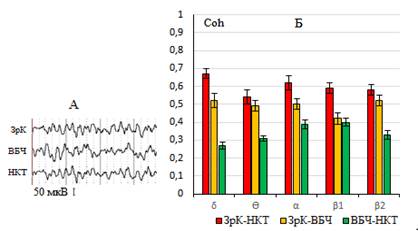
Рис. 1. Распределение когерентных связей между структурами зрительного анализатора в условиях спокойного бодрствования экспериментальных животных. А – фоновая активность ЭЭГ структур анализатора, Б – усредненные значения коэффициентов Coh
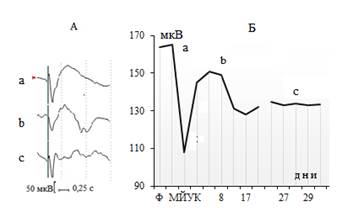
Рис. 2. Изменения суммарной амплитуды ЭРГ на ритмическую фотостимуляцию при развитии экспериментальной дистрофии сетчатки. А – потенциалы ЭРГ, Б – динамика изменения суммарной амплитуды ЭРГ под влиянием МЙУК: а – начальная фаза реакции на МЙУК,
b – фаза восстановления, с – фаза стабилизации амплитуды ЭРГ
Как показали результаты проведенных экспериментов, динамика изменения амплитуды суммарной ЭРГ в ответ на введение МЙУК носит длительный и фазовый характер. При этом начальная фаза реакции на введение препарата наблюдается сразу после инъекции и характеризуется значительным падением амплитуды ЭРГ на ритмическую фотостимуляцию. В дальнейшем отмечаются длительный (в течение 30–35 дней) период постепенного восстановления амплитудных параметров ЭРГ и их стабилизация на уровне 70–75% от фоновых показателей. Представляет интерес и тот факт, что процесс стабилизации носит колебательный характер и сопровождается периодическими изменениями амплитудно-временных параметров основных компонентов ЭРГ (рис. 2).
Анализ эффектов электрической стимуляции различных компонентов МА-эргической нейромодуляторной системы мозга на фоне экспериментальной патологии сетчатки выявил разнонаправленный характер участия нейронов nR и LC в регуляции исследуемых процессов. Так, результаты проведенных экспериментов показали, что электрическая стимуляция НА-эргической системы мозга, как правило, вызывает десинхронизацию ЭЭГ и ослабление когерентных связей между исследуемыми структурами анализатора во всем диапазоне частот. В отличие от этого эффекты стимуляции 5-НТ-эргической системы носили диаметрально противоположный характер и заключались как в увеличении значений усредненных коэффициентов Coh, так и в восстановлении исходного характера их распределения между анализируемыми структурами зрительного анализатора. При этом наблюдается и некоторое перераспределение максимумов показателей Coh между основными частотными диапазонами ЭЭГ. Обращает на себя внимание и тот факт, что эффекты МА-эргических ядер nR и LC выявлялись в период последействия электрической стимуляции, демонстрировали кумулятивный эффект и сохранялись в течение длительного времени (рис. 3).
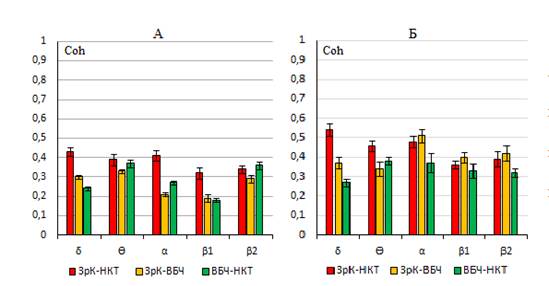
Рис. 3. Усредненные значения Coh между структурами зрительного анализатора на фоне экспериментальной дистрофии сетчатки под влиянием электрической стимуляции nR.
А – распределение коэффициентов Coh в условиях дистрофии сетчатки, Б – эффекты электрической стимуляции нейронов nR
Особый интерес вызывает анализ динамики изменения амплитуды потенциалов сетчатки под влиянием МА-эргических ядер. В частности, было обнаружено, что характер изменения амплитуды ЭРГ коррелирует с направленностью перераспределения когерентных связей между структурами в зависимости от эргичности нейромодуляторной системы. Как показали результаты, амплитуда потенциалов ЭРГ увеличивается или уменьшается в среднем на 10–15 мкВ в зависимости от стимуляции соответственно nR или LC (рис. 4).
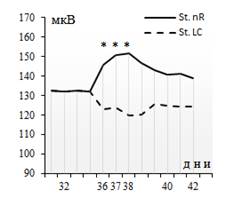
Рис. 4. Сравнительный анализ влияния электрической стимуляции (отмечено звездочками)
МА-эргических ядер nR и LC на амплитуду потенциалов ЭРГ на фоне экспериментальной дистрофии сетчатки
Таким образом, результаты проведенных исследований демонстрируют реципрокный характер участия различных компонентов МА-эргической нейротрансмиссии в регуляции дистантных взаимоотношений центральных структур зрительной системы в условиях экспериментальной дистрофии сетчатки. В отличие от LC, эффекты электрической стимуляции нейронов nR активируют эндогенные механизмы пластичности мозга, в результате которого наблюдается восстановление уровня и характера пространственной синхронизации потенциалов структур анализатора. Одновременно с этим наблюдается и увеличение суммарной амплитуды потенциалов ЭРГ под влиянием электрической стимуляции nR. Усиление реактивных свойств нейронов периферических и центральных структур зрительного анализатора в условиях экспериментальной дистрофии сетчатки при активации 5-НТ-эргической системы мозга было показано ранее и другими авторами [7].
Есть все основания полагать, что направленность и характер наблюдаемых нами эффектов обусловлены особенностями ультраструктурной организации и синаптологии МА-эргических нейронов. Методами электронной микроскопии было обнаружено, что при возбуждении этих нейронов имеет место секреция нейропередатчика не столько в синаптическую щель, сколько в межклеточное пространство посредством огромного количества распределенных вдоль терминалей аксонов варикозных расширений. Благодаря внесинаптической нейротрансмиссии при возбуждении МА-эргических нейронов создаются условия для одновременного воздействия биогенных моноаминов на популяции нейронов в различных участках мозга. Особый интерес представляет тот факт, что внесинаптическая трансмиссия 5-НТ и НА оказывает избирательное действие на Са- и Са-зависимую К-проводимость электровозбудимой мембраны постсинаптических нейронов. При этом соматическая мембрана клетки не обнаруживает десенситизации к действию 5-НТ и НА, и эффекты сохраняются в течение всего времени присутствия нейромодуляторов в межклеточном пространстве [8].
Исходя из изложенного становится очевидным, что наблюдаемые эффекты электрической стимуляции МА-эргических нейромодуляторных центров являются следствием внесинаптического действия моноаминов, благодаря чему одна и та же постсинаптическая мембрана проявляет разнонаправленный характер реакции на 5-НТ или НА. При этом реципрокный характер перераспределения когерентных связей под влиянием 5-НТ- и НА-эргической нейротрансмиссии обусловлен разнонаправленным их действием на одни и те же электроуправляемые ионные каналы и связан с избирательной регуляцией Са-механизмов электровозбудимой мембраны нейронов зрительного анализатора. Учитывая достаточно большую длительность полураспада моноаминов, есть все основания считать, что именно этот механизм нейромодуляции способствует усилению или ослаблению когерентных связей ЭЭГ исследуемых структур, что и наблюдается в период последействия электрической стимуляции МА-эргических ядер. В итоге при активации 5-НТ-эргической системы создаются необходимые условия для восстановления как упорядоченности когерентных связей между анализируемыми структурами зрительной системы мозга, так и амплитудных параметров потенциалов сетчатки.
Следует также отметить, что к настоящему времени в литературе накоплено достаточное количество экспериментальных фактов, подтверждающие значимость пространственной упорядоченности структуры дистантных взаимоотношений потенциалов ЭЭГ для нормального развития нервных процессов [9-11]. В специальных исследованиях было продемонстрировано усиление возбудимости корковых и подкорковых структур головного мозга при более высоком уровне синхронизации и ее снижение при более низком уровне. Экспериментальные наблюдения подобного рода делают обоснованной точку зрения, согласно которой экстремальные значения уровня синхронизации потенциалов структур мозга отражают различные уровни функциональной состояния нервных центров [12].
Вместе с тем необходимо учесть и тот факт, что повышение уровня синхронизации потенциалов ЭЭГ следует рассматривать прежде всего как повышение вероятности информационного взаимодействия между структурами головного мозга в различных экспериментальных ситуациях. Именно этот процесс лежит в основе наблюдаемых в наших экспериментах особенностей регуляции когерентных связей и амплитуды ЭРГ на фоне патологии сетчатки под влиянием электрической стимуляции различных компонентов МА-эргической системы мозга.
Выводы
1. Формирование экспериментальной патологии сетчатки под влиянием МЙУК сопровождается уменьшением суммарной амплитуды ЭРГ и перераспределением когерентных связей между центральными структурами зрительного анализатора.
2. Электрическая стимуляция нейронов дорсальных ядер шва на фоне патологии сетчатки, в отличие от LC, восстанавливает как суммарную амплитуду ЭРГ, так и характер распределения когерентных связей в зрительной системе мозга.



