Нарушение венозного оттока является второй по распространенности сосудистой патологией глазного дна после диабетической ретинопатии. Каждый год в мире у 16,4 млн человек развиваются тромбозы центральной вены сетчатки (ТЦВС), а также ее ветвей. Распространенность ТЦВС составляет 0,8 на 1000 человек [1]. Если в результате тромбоза и его лечения не происходит реканализация вены, то в результате образуются очаги ишемии сетчатки, являющиеся стартом неоваскулогенеза [2–4] и, как следствие, развития таких осложнений, как посттромботическая ретинопатия, вторичная неоваскулярная глаукома, гемофтальм и пр. [5–7]. Макулярный отек, возникающий в результате тромбоза ветвей центральной вены сетчатки, является основной причиной снижения зрения, вплоть до полной его потери [8–10]. Несмотря на большое количество исследований, посвященных терапии данной патологии, до сих пор нет общепринятой схемы лечения. Так, ряд авторов заявляет о клинической эффективности кортикостероидных препаратов при интравитреальном введении (триамцинолона ацетонид), а также ингибиторов сосудистого эндотелиального фактора роста (ранибизумаб, бевацизумаб) [11–13]. Что же касается хирургических методик (шитотомия, радиальная оптическая нейротомия), то в связи с низкой эффективностью они фактически не используются в клинической практике [14–16]. В последнее время в литературе уделяется большое внимание фактору роста эндотелия сосудов (vessel endothelial growth factor, VEGF) при различной патологии [17, 18], который является ключевым в запуске неоангиогенеза, поэтому применение анти-VEGF терапии при тромбозе ветвей вен сетчатки глаза является патогенетически обоснованным и клинически эффективным методом лечения [19–21].
Цель исследования – оценить клиническую эффективность анти-VEGF терапии при центральном тромбозе вен сетчатки.
Материал и методы исследования. Нами проанализирован результат лечения 124 пациентов в возрасте от 23 до 66 лет (средний возраст 54,3±8,9 года), которые находились на амбулаторном и стационарном лечении в офтальмологическом отделении ИНВХ им. В.К. Гусака с 2010 по 2015 гг. В исследование вошли пациенты, поступившие в первые 10 дней заболевания, т.е. в стадию острого тромбоза, и с ишемическим вариантом. Во время сбора анамнеза уделяли внимание наличию сопутствующей патологии: длительно существующей артериальной гипертензии, гипергликемии и гиперхолестеринемии, а также наличию острого нарушения мозгового кровообращения, инфаркта миокарда, тромбофлебита глубоких поверхностных или вен нижних конечностей и др. Нами было сформировано две группы: 1-я группа (n=66) – пациенты, которые получали стандартную терапию в виде местной антикоагулянтной терапии (дексаметазон с гепарином) или плазминоген (диаплазмин) по 5000 ед 2 раза в день № 5–10, дезагреганты (трентал, моксипин). Внутривенно – реополиглюкин 200–400 мл с дексаметазоном 4–8 мг, внутримышечно актовегин 80 мг. При отеке макулы и неоваскуляризации производили лазерную коагуляцию, интравитреальное или субтеноновое введение тримационолона. Помимо лечения центрального тромбоза вен сетчатки, проводили коррекцию сопутствующей патологии. Во 2-ю группу вошли 58 пациентов, которым, помимо стандартной терапии, вводили препарат афлиберцепт интравитреально по 2 мг в 0,05 мл. Раствор афлиберцепта для интравитреальных инъекций вводили однократно в течение пяти первых месяцев, а в дальнейшем переходили на одну инъекцию один раз в два месяца. В период между инъекциями мониторинг не проводился. Через 1 календарный год после начала терапии временной интервал между интравитреальными инъекциями увеличивали в зависимости от анатомических показателей и остроты зрения.
При поступлении всем пациентам выполняли оптическую когерентную томографию, контроль осуществляли через неделю после введения анти-VEGF, через месяц после первичного обращения, далее после каждого введения препарата. В обязательном порядке проводился сравнительный контроль по всем позициям. TGF-α и -β в слёзной жидкости определяли с помощью стандартных наборов согласно инструкции производителя с помощью иммуноферментного анализа. Исследование регионарной гемодинамики выполняли с помощью ультразвуковой допплерографии (УЗДГ) сосудов глаза аппаратом Sequoia 512 («Асuson», США) с датчиком 10 МГц в режимах спектральной допплерографии и цветового допплеровского картирования. Определялись скоростные показатели систолической (Vs) и диастолической (Vd) скорости, а также индексы периферического сопротивления кровотока: пульсационный индекс (PI) и индекс резистентности (RI) в центральной артерии сетчатки (ЦАС), глазной артерии (ГА), верхней глазничной вене (ВГВ) и ЦВС. В группу контроля (для определения нормы изучаемых показателей среди населения) вошли здоровые пациенты, проходившие профилактический осмотр в поликлинике. Когерентную оптическую томографию выполняли на аппарате RTVue-XR 100 с функцией ОКТ-ангиографии Optovue (США).
Учитывая небольшую выборку, для статистической достоверности определяли критерии Шапиро–Уилка (W) и Стьюдента для двух независимых выборок при сравнении с использованием лицензионной программы Statistica 6.0.
Результаты исследования и их обсуждение. У всех пациентов, поступивших в первые 10 дней заболевания, отмечался нормальный уровень TGF-α, а уровень TGF-β повышался не менее чем в 10 раз. Следует отметить, что концентрации TGF-α и TGF-β в слёзной жидкости пациентов с возникшей посттромботической неоваскулярной глаукомой наблюдалось увеличение показателей в 1,7 и 28 раз соответственно (табл. 1). Трансформирующий фактор роста α и особенно β играют ключевую роль в степени рубцевания субретинальной неоваскулярной мембраны.
Таблица 1
Концентрации TGF-α и TGF-β в слёзной жидкости у пациентов с тромбозом ветвей
вен сетчатки глаза
|
Группа |
TGF-α, пкг/мл |
TGF-β, пкг/мл |
|
Норма |
18,4±2,1 |
23,4±3,3 |
|
Тромбоз вен сетчатки |
28,7±4,9* |
646±112* |
|
1-я группа через 4 недели лечения |
24,9±2,4* |
422±85* |
|
2-я группа через 4 недели лечения |
19,8±3,1 |
284±38* |
Примечание: * – разница между нормой и показателем исследуемой группы достоверна (р<0,05)
В 1-й группе со стандартным лечением через 4 недели отмечалось снижение концентрации TGF-α с 28,7±4,9 пкг/мл до 24,9±2,4 пкг/мл, а TGF-β – с 646±112 до 422±85 пкг/мл. Во 2-й группе с применением антиангиогенной терапии TGF-α снизился с 28,7±4,9 пкг/мл до 19,8±3,1 пкг/мл и был в пределах нормы, а TGF-β – с 646±112 до 284±38 пкг/мл.
При ишемическом типе тромбоза ветви центральной вены сетчатки отмечается снижение систолической и диастолической скорости кровотока в ЦАС, ГА и максимальной скорости в ВГВ и ЦВС. При этом Vs по ГА снижалась с 32,8±3,2 см/с (норма) до 29,6±0,6 см/с, Vd по ГА с 9,2±1,8 до 6,7±0,2 см/с (при р<0,05). Индекс RI практически не менялся, а PI повышался с 1,3±0,05 до 2,3±0,4. Vs по ЦАС снижалась с 10,7±0,9 см/с (норма) до 7,9±0,2 см/с, Vd по ГА с 3,1±1,6 до 2,1±0,3 см/с (р<0,05). Индекс RI также практически не менялся, а PI повышался с 1,4±0,07 до 3,2±0,05. При этом Vmax по ВГВ снижалась с 8,4±1,6 до 5,1±1,5 см/с, а по ЦВС – с 4,4±0,68 до 2,8±0,04 см/с (при р<0,05). Вышеописанные факты подтверждают эффективность применения антиангиогенной терапии в комплексном лечении тромбоза вен сетчатки.
При поступлении во время выполнения когерентной томографии в обеих группах отмечался достоверный макулярный отек. Через 1 месяц лечения (табл. 2) в 1-й группе наблюдалось уменьшение отека сетчатки в некоторых полях, что отражено в таблице 2. Через 2 месяца в 1-й группе отмечалось частичное уменьшение отека. Во 2-й группе через 1 месяц после начала анти-VEGF терапии во всех участках сетчатки отмечается выраженное снижение толщины сетчатки на протяжении 2 месяцев после начала лечения.
Таблица 2
Данные когерентной томографии сетчатки в различные сроки исследования
|
Область измерения |
Норма, µm
|
При поступлении
|
1-я группа |
2-я группа |
||
|
Через 1 месяц |
Через 2 месяца |
Через 1 месяц |
Через 2 месяца |
|||
|
Минимальная толщина центральной ямки |
135-215 |
687±34 |
612±29 |
513±31** |
440±25* |
390±26** |
|
Центральная ямка |
168-239 |
396±27 |
640±35* |
582±24 |
452±31* |
387±24 |
|
Височная внутренняя макула |
240-294 |
586±24 |
507±41* |
445±22 |
371±27* |
334±19 |
|
Верхняя внутренняя макула |
243-296 |
320±23 |
588±33* |
473±28** |
401±29* |
370±23** |
|
Носовая внутренняя макула |
240-297 |
587±31 |
547±25 |
412±19 |
396±15* |
376±24 |
|
Нижняя внутренняя макула |
246-297 |
429±22 |
378±24 |
301±27 |
426±22* |
384±27** |
|
Височная внешняя макула |
199-276 |
479±31 |
438±25 |
343±29 |
138±17* |
136±18 |
|
Верхняя внешняя макула |
207-256 |
529±12 |
475±29 |
362±32 |
346±12* |
316±19** |
|
Носовая внешняя макула |
198-274 |
536±24 |
474±22* |
325±37 |
324±35* |
329±28 |
|
Нижняя внешняя макула |
207-256 |
438±28 |
378±18 |
301±26 |
290±21* |
256±22** |
Примечание: * – достоверная разница между изучаемым показателем и данными при поступлении;
** – достоверная разница между показателями 2 и 1 месяцев от начала лечения.
Во 2-й группе через 1 и 2 месяца отмечается более быстрое и эффективное восстановление толщины сетчатки, остроты зрения, что позволило добиться более ранней реабилитации пациентов по сравнению с пациентами 1-й группы. При ОКТ-ангиографии отмечается положительная динамика анти-VEGF терапии: через неделю от начала лечения (рис.) запустевание и разрежение новообразованных сосудов, через 2–3 недели – значительное снижение количества вновь образованных сосудов. Таким образом, основной эффект анти-VEGF терапии заключается в остановке неоангиогенеза, что соответственно ведет к снижению отека сетчатки, восстановлению кровоснабжения и остроты зрения у пациентов с тромбозом ветви центральной вены сетчатки. 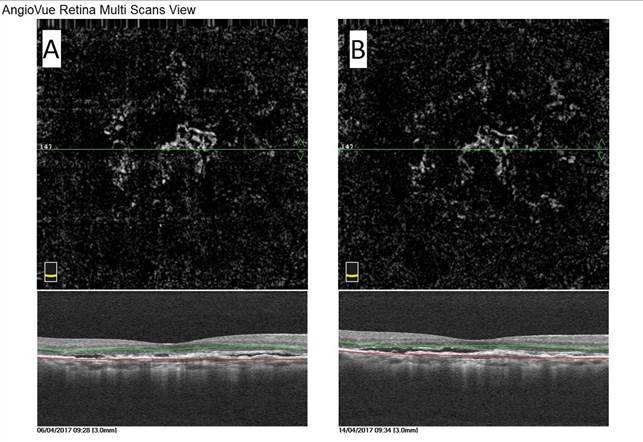
ОКТ-ангиография пациента с тромбозом ветви центральной вены сетчатки до (А) и через 8 суток после анти-VEGF терапии (В). Отмечается положительная динамика в виде частичного запустевания и разрежения новообразованных сосудов
Итак, нами проанализирован результат лечения пациентов с тромбозом ветви центральной вены сетчатки, продемонстрирована эффективность применения анти-VEGF терапии в виде снижения интенсивности неоангиогенеза, макулярного отека, что выразилось в более выраженном восстановлении остроты зрения и снижении инвалидизации пациентов.
Ключевая роль в индукции неоангиогенеза принадлежит избыточной концентрации VEGF в ретинальной ткани. Общим для всех типов интраокулярной неоваскуляризации является неполноценность новообразованных сосудов, заключающаяся в отсутствии эндотелиальной базальной мембраны, вследствие чего в сосудистой стенке имеются множественные фенестры, приводящие к транссудации, экссудации и геморрагии. Подобные изменения характерны и для любого раневого или воспалительного процесса, когда есть нарушение целостности ткани. Вслед за повреждением (альтерацией) следует экссудативная реакция, а далее начинается этап рубцевания — еще один универсальный алгоритм в организме, направленный на восстановление целостности структуры ткани путем интенсивной пролиферации соединительной ткани и сопровождающийся частичной или полной утратой специфической тканевой функции. Рубцевание как на поверхности сетчатки, под ней, так и в самой сетчатке неизбежно сопровождается утратой функции зрения. Тем самым предназначенный для устранения ишемии компенсаторный механизм интраокулярной неоваскуляризации становится губительным с точки зрения функциональной состоятельности органа [22]. В литературе встречаются данные обширных рандомизированных исследований с доказанной эффективностью патогенетической анти-VEGF терапии макулярного отека (интравитреальное введение ранибизумаба), возникшего из-за окклюзии вен сетчатки [23–25]. Однако остается ряд нерешенных вопросов, связанных с дозой вводимого препарата и влиянием различных сопутствующих заболеваний. В ряде случаев у пациентов с гипертоническим ангиосклерозом происходит повышение внутрисосудистого давления за счет нарушения микроциркуляции, что приводит к повреждению гематоретинального барьера и повышению проницаемости сосудов [26, 27]. Длительно неконтролируемая артериальная гипертензия вызывает еще более значимые нарушения в микроциркуляторном русле. Большинство пациентов страдают гипертонической болезнью, что следует учитывать в дальнейших исследованиях [28].
Таким образом, современная антиангиогенная терапия является инвазивной – единственным способом доставки ингибиторов ангиогенеза в безопасных и эффективных дозах в настоящее время служит интравитреальная инъекция. Несмотря на небольшое количество офтальмологических осложнений и побочных эффектов, подавляющее большинство из них обусловлено необходимостью хирургического внедрения внутрь глазного яблока. Решением этой проблемы может стать создание в будущем инсталляционных или других лекарственных форм ингибиторов ангиогенеза. Несмотря на эффективность, антиангиогенная терапия не является радикальным методом лечения. Время действия введенного внутрь глаза ингибитора ангиогенеза ограничено временем его выведения из глазного яблока, после чего патогенетический механизм заболевания нередко возобновляется. Это приводит к необходимости многократного повторения процедуры интравитреального введения антиангиогенного препарата, что увеличивает риск осложнений и создает дополнительное ухудшение качества жизни пациента [29, 30].
Выводы
1. Применение антиангиогенной терапии при тромбозе вен сетчатки по ишемическому типу позволяет быстрее добиться уменьшения толщины сетчатки по сравнению со стандартным методом лечения как в ранние, так и в поздние сроки заболевания.
2. Проведение анти-VEGF терапии приводит к нормализации цитокинового баланса, в частности отмечаются нормализация фракций TGF в слёзной жидкости и нормализация показателей гемодинамики глаза.
3. При изучении патогенеза тромбоза вен сетчатки установлена ключевая роль неоангиогенеза как механизма, запускающего каскад патологических механизмов, в связи с чем применение антиангиогенной терапии является обоснованным.



