В России рак желудка является одной из наиболее часто встречающихся злокачественных опухолей и занимает третье место по количеству летальных исходов от раковых заболеваний, что соответствует общемировым показателям. Так, например, по последним данным, в Восточной Азии заболеваемость раком желудка составляет 24,2 на 100 000 тыс. населения [1; 2]. Несмотря на то что в течение последних 30 лет заболеваемость раком желудка в большинстве развитых стран снижается, общее число ежегодно регистрируемых случаев рака желудка составляет 1 млн, при этом наблюдается более 700 тыс. смертей от данной патологии [3-5]. По прогнозам ведущих специалистов, к концу XXI века злокачественные новообразования органов желудочно-кишечного тракта, в том числе и рак желудка, выйдут на 1 место по заболеваемости и смертности в мире [6; 7].
Высокие показатели смертности и неудовлетворительные результаты лечения подтверждают, что диагностика рака желудка имеет место на поздних стадиях (III–IV клинические стадии), когда наблюдается прорастание опухоли в серозную оболочку желудка и в прилежащие органы, метастазирование в региональные лимфатические узлы и во внутренние органы. Одним из основных методов лечения рака желудка в настоящее время является оперативное лечение (гастрэктомия). В последнее время большое внимание уделяется малоинвазивной хирургии, а именно – лапароскопической гастрэктомии, при которой необходимо выполнять адекватную лимфодиссекцию и которая, вероятнее всего, может стать при определённых условиях заменой открытой хирургии [2].
Высокие показатели выживаемости при раке желудка в Японии обусловлены массовой диспансеризацией и ранней диагностикой как рака желудка, так и предраковых процессов, которым придаётся очень большое значение. Качество ранней диагностики карцином желудка в значительной мере зависит от морфологических исследований гастробиоптатов и материалов эндоскопических резекций слизистой оболочки [8; 9]. При выявлении в исследуемом материале опухолевого процесса выполняются органосохраняющие операции, позволяющие избежать радикальной операции. На сегодняшний день они наиболее оправданы в случаях ранней диагностики предраковых процессов и раннего рака желудка. Данные операции включают резекцию патологического очага единым блоком. Такой подход помогает улучшить прогноз, избежать химиотерапии и инвалидизации больных. Япония занимает I место по выживаемости данной группы больных – 53%, тогда как в других странах этот показатель не превышает 15–20%. В России доля рака желудка, выявленного на IV стадии заболевания, составляет 39,3%, на ранних стадиях – 29,6% от всех зарегистрированных случаев, показатели смертности на первом году после постановки диагноза достигают 48,9% [10].
В настоящее время число случаев рака желудка, диагностированного на ранних стадиях, увеличивается [1]. Известно, что имеются региональные различия по распространённости и клинико-морфологическим особенностям рака желудка. Помимо этого, аденокарциномы желудка традиционно делятся на два гистологических подтипа. Согласно классификации Laurén первый тип карциномы - это кишечный, второй – диффузный. В последние годы с помощью молекулярно-генетических методов получены данные, позволившие предложить новые классификации, учитывающие изменения генома опухолевых клеток. Установили, что рак желудка кишечного и диффузного типа отличаются друг от друга на молекулярном уровне, наиболее разнообразный молекулярный профиль имеет кишечный тип аденокарцином по сравнению с диффузным. В настоящее время проводятся исследования по типированию аденокарцином желудка на наличие маркеров вируса Эпштейна-Барр (EBV), микросателлитной нестабильности (MSI) и других генетических изменений. Очевидно, что лечение и прогноз аденокарцином желудка должны учитывать гетерогенность этих опухолей по патоморфологическим, иммуногистохимическим и молекулярно-биологическим особенностям. В настоящее время в клинической практике используется определение иммуногистохимической экспрессии и амплификации гена HER2/neu в опухолевых клетках при назначении таргетной терапии пациентам с раком желудка. Вероятно, что при развитии опухолей желудка, отличающихся по морфологическим, иммуногистохимическим и молекулярно-генетическим характеристикам, имеют место различные фоновые и предраковые изменения. В связи с этим актуальной и своевременной задачей является анализ как нозологической структуры, гистологических подтипов карцином, так и патоморфологических характеристик предопухолевых изменений, дисплазий и неоплазий в слизистой оболочке желудка.
Целью данной работы является клинико-морфологическая характеристика предопухолевых процессов и карцином желудка по биопсийному и операционному материалу в Калининградской области за период 2016–2018 гг.
Материалы и методы исследования: проведено ретроспективное исследование биопсийного и операционного материала по данным архива патологоанатомического отделения Государственного бюджетного учреждения здравоохранения «Областная клиническая больница Калининградской области» за период с 2016 по 2018 г. Операционный материал фиксировали 10% раствором формалина, парафиновые срезы толщиной 4 мкм окрашивали гематоксилином и эозином, при необходимости – альциановым синим и по Романовскому-Гимзе, реактивом Шиффа в сочетании с альциановым синим, а также – по Маллори и пикрофуксином по Ван Гизону. Морфологическая оценка исследованного материала проведена согласно рекомендациям ВОЗ (2010) и на основе Operative Link for Gastritis Assessment (OLGA, 2008 г.). Статистическая оценка данных проведена с помощью программы Microsoft Excel 2010.
Результаты исследования и их обсуждение
Исследованы материалы 513 гастробиопсий пациентов Калининградской области за период 2016–2018 гг. (рисунок 1). Среди них выявлено 68 случаев карцином (13,3%). При этом в 133 случаях (25,9%) обнаружены метапластические и диспластические процессы в слизистой оболочке желудка. Кишечная метаплазия выявлена у 86 пациентов (16,8%), значительная часть случаев метаплазии выявлена на фоне хронического гастрита – у 41 пациента (47,8%), хронического атрофического гастрита – у 27 больных (31,4%) и, в меньшей степени, в покровно-ямочном эпителии желудка – у 10 пациентов (11,6%).
При исследовании гастробиоптатов 47 больных (9,2%) были выявлены диспластические изменения различной степени, которые чаще всего встречались у пациентов на фоне хронического гастрита – 21 случай (44,7%), хронического атрофического гастрита – 11 наблюдений (23,4%) и в тубуло-виллёзных аденомах желудка, преимущественно в их поверхностных отделах – 8 случаев (17,1%). Среди выявленных диспластических изменений преобладала дисплазия высокой степени – у 40 больных (85,2%), доля дисплазии низкой степени составила 14,8% - 7 случаев (рисунок 2).
Таким образом, в структуре исследованных биоптатов доля верифицированных предопухолевых и неопластических процессов была значительной и составила 248 случаев (48,3%). Полученные данные свидетельствуют о том, что при исследовании ограниченного объёма материала гастробиоптатов возможно не только диагностировать злокачественные опухоли, но и достоверно верифицировать фоновые и предраковые процессы в желудке. Данное исследование является необходимым и достаточно информативным для проведения первичной диагностики как острых, так и хронических заболеваний желудка, фоновых, предраковых процессов и карцином.
В связи с этим актуальной и необходимой задачей является анализ нозологической структуры и патоморфологических характеристик предопухолевых и опухолевых изменений на значительно большем объёме материала, полученного при операциях, проведённых по поводу карцином желудка в Калининградской области. Исследованная выборка включала 145 пациентов, оперированных по поводу злокачественных новообразований желудка, из них число резекций желудка составило 59 случаев (40,7%), гастрэктомий – 86 (59,3%). В изученной группе больных преобладали мужчины – 88 человек (60,7%), число женщин составило 57 (39,3%). Возраст пациентов варьировал от 55 до 70 лет. Распределение злокачественных новообразований по локализации в различных отделах желудка характеризовалось следующими показателями: 1) кардиальный отдел – 14,5%; 2) тело желудка – 49,7%; 3) антральный отдел – 20%; 4) пилорический отдел – 15,8%. Среди всех выявленных злокачественных новообразований желудка основную долю составили аденокарциномы (77,9%).
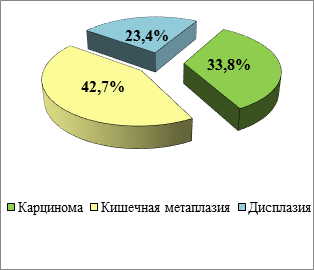
Рис. 1. Распределение предраковых процессов и карцином в слизистой оболочке желудка по данным гастробиоптатов
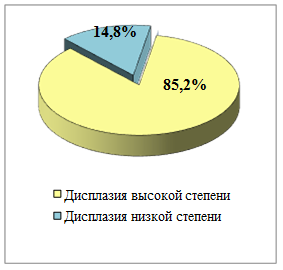
Рис. 2. Соотношение степеней дисплазий, выявленных при исследовании
В структуре аденогенных карцином желудка (113 наблюдений) преобладали низкодифференцированные аденокарциномы G3 - 56 случаев (49,6%), количество умеренно дифференцированных (G2) и высокодифференцированных опухолей (G1) составило 29 (25,7%) и 28 (24,8%) соответственно (рисунок 3). При гистологическом исследовании карцином желудка выявлены очаги слизеобразования – 21 случай (18,6%), фокусы некрозов – в 14 опухолях (12,4%), изъязвления – в 44 случаях (39,9%). При оценке количества аденокарцином в соответствии с глубиной прорастания в стенку желудка (TNV – атлас, 2017 г.) получены следующие показатели: 1) в подслизистую основу – 7 (6,2%, pT1b); 2) в мышечную оболочку – 36 (31,9%, pT2); 3) в субсерозный слой – 17 (15,0%, pT3); 4) за серозную оболочку – 53 (46,9%, pT4а). В 5 случаях (4,4%, pT4b) выявлено прорастание карциномы желудка в пищевод, в 2 наблюдениях (1,8%, pT4b) – в кишечник (рисунок 4).
Одним из наиболее важных морфологических критериев при морфологическом исследовании карцином желудка является оценка опухолевого роста по отношению к нервной ткани. Данный показатель определяет агрессивность опухолевого процесса и влияет на дальнейший прогноз. В исследованной группе аденокарцином желудка выявлено 29 случаев (25,7%) с признаками периневрального и интраневрального роста, преимущественно встречавшегося в низкодифференцированных опухолях. Состояние лимфогенного и кровеносного коллекторов является важным прогностическим показателем при злокачественном росте. В 26 наблюдениях (23,0%), чаще всего при аденокарциномах высокой степени злокачественности, выявлены раковые эмболы в просветах лимфатических и кровеносных сосудов различного калибра.
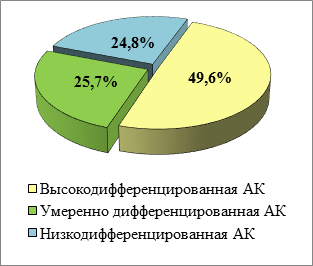
Рис. 3. Соотношение степеней дифференцировки аденокарцином (АК) желудка в операционном материале
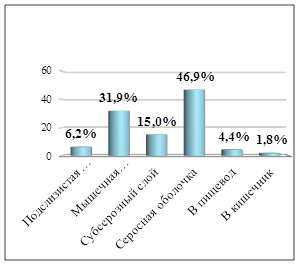
Рис. 4. Уровень инвазии аденокарцином желудка с прорастанием в окружающие ткани и органы в операционном материале
При оценке показателей лимфогенного метастазирования аденокарцином желудка выявили следующие показатели: 1) 60 опухолей (53,1%) метастазировали в лимфатические узлы малой кривизны желудка; 2) в 50 случаях (44,25%) выявлены метастазы в лимфатические узлы большой кривизны, а в 2 наблюдениях (1,8%) в лимфатических узлах имели место саркоидные изменения.
Важными характеристиками неопластического процесса являются оценка фоновых и предопухолевых процессов. Тем не менее в исследованной группе оперированных пациентов со злокачественными новообразованиями желудка (145 больных) в патологоанатомических заключениях соответствующие морфологические изменения (хронический гастрит, тонко- и толстокишечная метаплазия, тубуло-виллезные аденомы с дисплазией III степени) были описаны только в 15,2% случаев. Полученные данные указывают на необходимость морфологической диагностики по операционному материалу не только гистотипа, степени злокачественности и значимых прогностических характеристик карцином желудка, но и в каждом индивидуальном случае – выявления фоновых и предопухолевых процессов в желудке. Данная ценная клиническая информация будет способствовать углублению наших знаний о морфогенезе аденокарцином желудка, пониманию этапов канцерогенеза гетерогенных по генетическим и морфологическим характеристикам эпителиальных неоплазий желудка.
Выводы
1. При исследовании гастробиоптатов желудка установили, что в изученном материале в 48,3% случаев диагностированы предопухолевые процессы и карциномы желудка. В структуре предопухолевых состояний эпителия желудка кишечная метаплазия была диагностирована в 1,8 раза чаще, чем диспластические изменения. Диспластические процессы, выявленные в меньшем количестве наблюдений, включали преимущественно дисплазию высокой степени; доля дисплазии низкой степени была ниже более чем в 5,7 раза. Ограниченный объем материала гастробиоптатов позволяет на первичном этапе диагностики достоверно верифицировать как злокачественные опухоли желудка, так и диспластические процессы, являющиеся этапом морфогенеза в развитии рака желудка.
2. В структуре операционного материала количество гастрэктомий превышало число резекций желудка. Среди оперированных по поводу рака желудка пациентов преобладали мужчины в возрасте от 55 до 70 лет, что соответствует данным литературы в России и зарубежных странах. Наиболее частая локализация карцином – это тело желудка, антральный и пилорический отделы. В структуре аденокарцином желудка значительную долю составили опухоли высокой степени злокачественности, количество умеренно дифференцированных и высокодифференцированных опухолей было ниже в 1,8 и 2 раза соответственно. Чаще всего в исследованном материале имела место инвазия за серозную оболочку, более чем у 75% оперированных пациентов выявлены метастазы в регионарные лимфатические узлы. Прогностически неблагоприятные морфологические признаки - периневральный рост опухоли и наличие опухолевых клеток в просвете лимфатических сосудов, выявлены у 20% и 18% больных соответственно.
3. У значительной доли пациентов рак желудка диагностирован на III–IV стадиях болезни, тогда как число случаев раннего рака характеризовалось относительно низкими показателями. Это свидетельствует о необходимости своевременной диагностики рака и предраковых заболеваний желудка, об актуальности более широкого применения эндоскопического обследования и видеогастроскопии, тщательного морфологического исследования биопсийного материала для выявления предопухолевых процессов с использованием современных иммуногистохимических методов.
4. Фоновые и предопухолевые процессы при карциномах желудка в исследованном операционном материале охарактеризованы в небольшом числе патоморфологических заключений по сравнению с материалом гастробиопсий. В связи с этим для адекватной оценки особенностей предраковых процессов и карцином желудка представляется необходимым более широкое практическое внедрение патоморфологической оценки фоновых и предопухолевых состояний при исследовании более информативного объёма операционного материала. Это сделает возможным детальное изучение морфогенеза и этапов канцерогенеза при развитии рака желудка, будет способствовать улучшению профилактики, ранней диагностики заболевания, выбору адекватного лечения и правильной оценке прогноза дальнейшего течения заболевания.



