Сахарный диабет 1-го типа (СД 1) – метаболическое (обменное) заболевание, характеризующееся гипергликемией, в основе которого лежит деструкция β-клеток, приводящая к абсолютному дефициту инсулина.
Сахарный диабет представляет собой важнейшую медико-социальную проблему во всем мире. Это объясняется его широким распространением, тяжестью поздних осложнений, дороговизной средств диагностики и лечения, которые необходимы больным в течение всей жизни. По данным Росстата на сегодняшний день в мире насчитывается более 400 млн человек, больных СД, и распространенность заболевания продолжает неуклонно расти. На начало 2017 г. общая численность пациентов, страдающих СД, в РФ составила 4,348 млн человек, из них: 4 млн – СД 2-го типа, 255 тыс. – СД 1-го типа и 75 тыс. – СД других типов. По последним данным в Республике Саха (Якутия) с диагнозом СД проживают 21 677 человек, из них: 20 508 – это пациенты с СД 2-го типа, 1099 – больные СД 1-го типа, 70 человек страдают СД других типов [1].
Согласно современным данным в развитии СД 1-го типа принимают участие большое число генов [2], более половины генетических рисков обусловлено участием полиморфных вариантов генов HLA, расположенных на коротком плече хромосомы 6 (6p21). Полагая, что вклад генетических факторов в риск развития СД 1-го типа составляет более 50%, полный вклад полиморфных аллелей локуса HLA может быть оценен более чем 25%.
Определение аллелей HLA помогает в определении риска развития СД 1-го типа. Это особенно полезно в профилактике у пациентов с высокой степенью риска [3]. HLA-типирование также требуется в генетических исследованиях, направленных на определение молекулярной основы СД 1-го типа [4]. Тем не менее высокая стоимость HLA генотипирования является одной из основных проблем, препятствующих проведению масштабных исследований. В связи с этим ведутся исследования по определению HLA аллелей с использованием однонуклеотидных полиморфизмов (SNP) (Walsh E.C. et al., 2003; Leslie S. et al., 2008; Dilthey A.T. et al., 2011; Ferreira R.C. et al., 2012; Barker J.M. etal. 2008; Cao Ngueyen et al., 2013).
В России исследования по определению HLA-аллелей с использованием однонуклеотидных полиморфизмов не проводятся. В связи с этим на сегодняшний день существует необходимость в проведении исследований, направленных на разработку регионально-адаптированного метода HLA-типирования СД 1-го типа с помощью однонуклеотидных полиморфизмов (SNP).
Целью данного исследования являлось выявление ассоциации полиморфных вариантов генов HLA II класса с СД 1-го типа среди якутской популяции.
Материалы и методы исследования
Экспериментальная часть работ по генотипированию полиморфизмов rs3104413, rs2854275, rs9273363 была проведена в лаборатории наследственной патологии отдела молекулярной генетики Якутского научного центра комплексных медицинских проблем (ЯНЦ КМП). Для исследования использованы образцы ДНК из коллекции биоматериала ЯНЦ КМП с применением УНУ «Геном Якутии» (рег. № USU_507512). Выборка состояла из 92 пациентов больницы ФГБНУ «Якутский научный центр комплексных медицинских проблем», ГАУ РС(Я) РБ № 1 НЦМ Педиатрический центр и эндокринологического отделения ГБУ РС (Я) «Якутская городская клиническая больница» г. Якутска. В состав выборки вошли 92 пациента с диагнозом СД 1-го типа в возрасте от 4 лет до 56 лет, проживающих в РС (Я), якутов по этнической принадлежности. По половому признаку пациенты разделились на 44 мужчин (47,8%) и 48 женщин (52,2%). Средний возраст пациентов составил 23,04±0,27 года (от 4 до 56 лет), средний возраст пациентов мужского пола – 20,5±2,3 года (от 5 до 40 лет), женского пола – 25,11±2,59 года (от 4 до 56 лет). Популяционную выборку составили 210 якутов, не страдающих СД 1-го типа. Этническая принадлежность учитывалась до третьего поколения.
Амплификация области гена HLA-DQA1, содержащего однонуклеотидный полиморфизм rs3104413, осуществлялась в процессе ПЦР в реальном времени с использованием пар праймеров и аллельспецифичных зондов для амплификации ДНК, описанных в журнале «NATURE COMMUNICATIONS» (Isabelle Serr et al., 2015). Праймеры и зонды синтезированы компанией ООО «Биотех-Индустрия (Lumiprobe)» (Москва, Россия). Последовательность праймеров: Форвард праймер 5'-CAGCTGAGCACTGAGTAG-3', реверс праймер 5'-GCAGTTGAGAAGTGAGAG-3'. Структура зондов: FAM – Probe rs3104413 LPC [6FAM]CAGCCT[+G]CT[+C]TC[+C]TA[+T]TGG[BHQ1], HEX – Probe rs3104413 LPG [HEX]CAGCCT[+G]CT[+G]TC[+C]TA[+T]TGG[BHQ1].
Амплификация проводилась согласно температурной программе, приведенной ниже (табл. 1).
Таблица 1
Температурная программа амплификации полиморфизма rs3104413
|
№ |
Стадии |
Температура |
Время |
Циклы |
|
1 |
Первая денатурация |
95°С |
0:10 |
1 цикл |
|
2 |
Денатурация |
95°С |
0:30 |
50 циклов |
|
3 |
Отжиг |
55°С |
1:00 |
Измерение сигнала флуоресценции проводилось на втором этапе реакции (55°С – 1:00). Детекция флуоресценции осуществлялась «по конечной точке» согласно протоколу прибора «Real-time CFX 96 Touch» («Biorad», США). Пример распределения облаков генотипов проведения ПЦР и детекции флуоресценции «по конечной точке» представлен на рисунке 1. Соответствие флуоресцентных красителей: аллель C – канал FAM, аллель G – канал HEX.
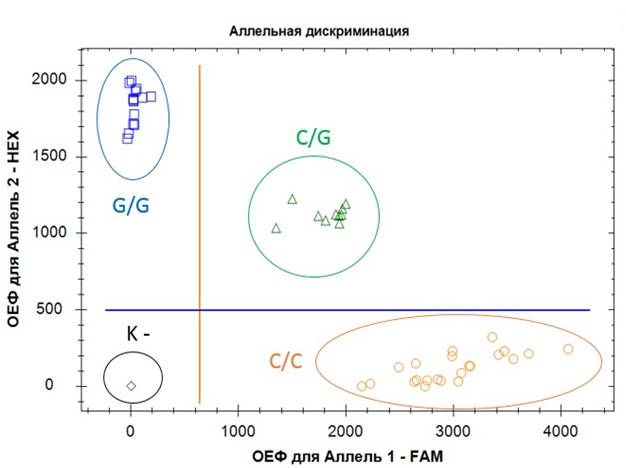
Рис. 1. Распределение облаков генотипов полиморфизма rs3104413 гена HLA-DQA1. Примечание: «К–» – отрицательный контроль, C/C – гомозигота по предковому аллелю C. C/G – гетерозигота, G/G – гомозигота по мутантному аллелю G
Анализ однонуклеотидных полиморфизмов (SNP) rs2854275, rs9273363 проводился с помощью аллельспецифичных праймеров (АС-ПЦР). Праймеры были синтезированы компанией ООО «Сибэнзим» (г. Новосибирск, Россия). В рамках настоящей работы были созданы оригинальные аллельспецифичные праймеры на основе референсного генома hg38/Human по базе UCSC Genome Browser (http://genome.ucsc.edu/index.html). Последовательность праймеров и условия ПЦР представлены в таблице 2.
Таблица 2
Последовательность праймеров и условия АС-ПЦР*
|
Ген/ Антиген |
Метод генотипирования |
Структура праймеров |
tоС отжига праймеров , |
Мутант- ный аллель |
|
rs2854275 |
АС-ПЦР* |
Внутренний форвард праймер: 5’-CTTAACTTTGGTGGCATCTTCTTGTG-3’ Внутренний реверс праймер: 5’- AAGCTGTGGTTCTGGCTCCACATTTA-3’ Наружный форвард праймер: 5’-TAAGAGGGAAGAGCATGAGCTGAGT-3’ Наружный реверс праймер: 5’-TCTTTCAGTCACTGGAAAATGCTTACA-3’ |
64 |
134, 192 п.о.** |
|
rs9273363 |
АС-ПЦР* |
Внутренний форвард праймер: 5’-TGCTTTCAGGGTCATGGCCTTC-3’ Внутренний реверс праймер: 5’-TGGGAGCTTCTGCGAGGTTATGT -3’ Наружный форвард праймер: 5’-TAGTTCTCCACTCTGACCTCATC-3’ Наружный реверс праймер: 5’-GTTATGAGGGAGGTCACTACACA -3’ |
67 |
146, 141 п.о.** |
|
β-globin*** |
АС-ПЦР* (Вутрен-ний контроль) |
F: 5’-CAACTTCATCCACGTTCACC-3’ R: 5’-GAAGAGCCAAGGACAGGTAC-3’ |
57 |
268 п.о.** |
Примечание. * – АС-ПЦР – аллель-специфическая ПЦР, ** – п.о. – пара оснований. *** – Dominquez O et al., 1992; Michelle A.M. et al., 2000; Steffens Nakken et al., 1995
Результаты амплификации и рестрикции фракционировали в 3–4%-ном агарозном геле с бромистым этидием при напряжении 120–300 Вт в течение 30–45 мин. Анализ результатов электрофореза проводили под UV-лучами в гель-документирующем приборе Vilbеr Lourmat (рис. 2, 3).
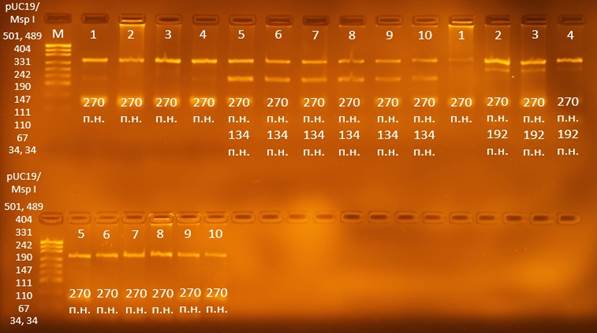
Рис. 2. Электрофореграмма продукта амплификации rs2854275 в 2%-ном агарозном геле Примечание: п.н. – пар нуклеотидов. М – ДНК маркер pUC19/MspI. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 – нумерация образцов. 270 п.н. – внутренний контроль. 192 п.н. – аллель T, 134 п.н. – аллель G
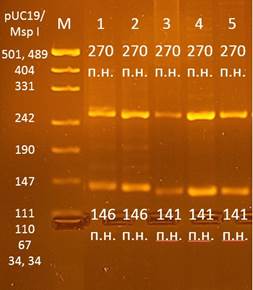
Рис. 3. Электрофореграмма продукта амплификации rs9273363 в 2%-ном агарозном геле Примечание: п.н. – пар нуклеотидов. М – ДНК маркер pUC19/MspI. 1, 2, 3, 4, 5 – нумерация образцов. 270 п.н. – внутренний контроль. 141 п.н. – аллель A, 146 п.н. – аллель C
Статистический анализ полученных результатов медико-генетического исследования был проведен с помощью программы: «Office Microsoft Excel 2010», «Statistica 8.0». Частоты аллелей и генотипов rs3104413, rs2854275 и rs9273363 определяли путем прямого подсчета. Результаты считались значимыми, когда значение «р» было меньше 0,05 (p<0,05).
Результаты исследования и их обсуждение
В результате проведенного анализа установлено, что только для полиморфного варианта rs2854275 в популяции якутов наблюдаемое распределение генотипов соответствовало ожидаемому при равновесии Харди–Вайнберга (РХВ). Отклонение установлено для полиморфного варианта rs3104413 (Х²=65,966, р<0,001), которое характеризовалось уменьшением уровня наблюдаемой гетерозиготности (Но=0,219) по сравнению с ее ожидаемым уровнем (Не=0,498). Для полиморфного варианта rs9273363 (Х² = 134, р<0,001), которое характеризовалось уменьшением уровня наблюдаемой гетерозиготности (Но=0,0) по сравнению с ее ожидаемым уровнем (Не=0,029) (табл. 3).
Таблица 3
Распределение генотипов и аллелей полиморфизмов rs3104413, rs2854275, rs9273363 в популяционной выборке якутов
|
Полимор-физм |
Кол-во человек, n |
Генотип, % |
Распределение аллелей |
Но |
Не |
Х2 |
р |
|||
|
rs3104413 |
210 |
С/С |
C/G |
G/G |
С |
G |
0,219 |
0,498 |
65,966 |
<0,001 |
|
36,2 |
21,9 |
41,9 |
0,471 |
0,529 |
||||||
|
rs2854275 |
122 |
Т/Т |
Т/G |
G/G |
Т |
G |
0,157 |
0,145 |
1,297 |
0,255 |
|
0,0 |
15,7 |
84,3 |
0,079 |
0,921 |
||||||
|
rs9273363 |
134 |
А/А |
А/С |
С/С |
А |
С |
0,0 |
0,029 |
134 |
<0,001 |
|
1,5 |
0,0 |
98,5 |
0,015 |
0,985 |
||||||
Примечание: n – численность выборки, Ho, He – наблюдаемая и ожидаемая гетерозиготность, Х2 по Харди–Вайнбергу, р – уровень достоверности
Согласно базе данных проекта «1000 геномов» для полиморфизма rs3104413 во всех исследованных выборках популяций мира установлены высокая частота мутантного аллеля С (78–92%) и низкая частота предкового аллеля G (8–22%) [5]. В исследованной выборке якутов частота предкового аллеля G была выше и составила 52,9%, тогда как частота мутантного аллеля С характеризовалась более низкими значениями и составила 47,1%, что может быть следствием как недостаточного объема выборки, так и этнической особенности.
Для полиморфизма rs2854275 в исследованной выборке якутов частота предкового аллеля G (92,1%) преобладала над частотой мутантного аллеля Т (7,9%), что сопоставимо с результатами ранее проведенных исследований, в которых отмечаются высокая частота предкового аллеля G (90–97%) и низкая частота мутантного аллеля Т (3–10%) [5].
Полиморфизм rs9273363 у якутов характеризовался преобладанием частоты предкового аллеля С (98,5%) по сравнению с частотой мутантного аллеля А (1,5%), что согласуется с результатами ранее проведенных исследований, в которых отмечаются высокая частота предкового аллеля С (67–91%) и низкая частота мутантного аллеля А (9–33%) [5].
Результаты анализа распределения частот аллелей и генотипов полиморфизмов rs3104413, rs2854275 и rs9273363 среди больных СД 1-го типа и контрольной выборки представлены в таблице 4.
Таблица 4
Частота встречаемости генотипов и аллелей полиморфизмов rs3104413, rs2854275 и rs9273363 в группе больных СД 1-го типа и контрольной выборки
|
Генотипы, аллели |
Больные СД 1-го типа |
Контрольная выборка |
Х2 |
OR (95% CI) для аллелей |
Значимость, p |
|
rs3104413 |
|||||
|
n = 92, абс. (%) |
n = 210, абс.(%) |
||||
|
С/С |
64 (69,6) |
76 (36,2) |
32,099 |
4,036 (2,708-6,017) |
<0,001* |
|
С/G |
16 (17,4) |
46 (21,9) |
|||
|
G/G |
12 (13,0) |
88 (41,9) |
|||
|
С |
144 (0,783) |
198 (0,471) |
49,184 |
<0,001** |
|
|
G |
40 (0,217) |
222 (0,529) |
|||
|
rs2854275 |
|||||
|
n = 92, абс. (%) |
n = 122, абс. (%) |
||||
|
Т/Т |
16 (16,7) |
0 (0,0) |
88,7 |
13,8 (7,48-25,46) |
<0,001* |
|
G/T |
52 (56,3) |
14 (11,5) |
|||
|
G/G |
24 (27,1) |
108 (88,5) |
|||
|
T |
84 (44,8) |
14 (5,7) |
92,41 |
<0,001** |
|
|
G |
100 (55,2) |
230 (94,3) |
|||
|
rs9273363 |
|||||
|
n = 20, абс.(%) |
n = 134, абс.(%) |
||||
|
А/А |
4 (14,3) |
2 (1,5) |
138,89 |
76,15 (24,89-233,02) |
<0,001* |
|
А/С |
22 (78,6) |
0 (0,0) |
|||
|
С/С |
2 (7,1) |
132 (98,5) |
|||
|
А |
30 (53,6) |
4 (1,5) |
128,28 |
<0,001** |
|
|
С |
26 (46,4) |
264 (98,5) |
|||
Примечание. Достигнутый уровень значимости при сравнении распределения генотипов (*) и частоты аллелей (**) в группах сравнения 1 и 2. n – численность выборок, Х2 с поправкой Йейтса.
Анализ распределения генотипов показал, что наиболее распространенным генотипом по полиморфизму rs3104413 в группе больных СД 1-го типа является С/С (69,6%), тогда как в контрольной группе чаще встречался гомозиготный вариант G/G (41,1%). В ходе исследования установлено, что преобладающим аллелем полиморфизма rs3104413 в популяции якутов является аллель G (52,9%), при том что в ранее исследованных выборках популяций мира установлено преобладание частоты мутантного аллеля С (78–92%) [5]. Таким образом, мутантный аллель С для якутов может использоваться в качестве маркера повышенного риска развития СД 1 (OR – 4,036; 95% CI: 2,71–6,02; р<0,001).
Выявлено, что самым распространенным генотипом полиморфного варианта rs2854275 в группе контроля является гомозиготный генотип G/G (88,5%), а в группе больных СД 1-го типа – генотип G/Т (56,3%). Анализ отношения шансов показал, что частота встречаемости аллеля Т в группе людей с СД 1-го типа статистически достоверно выше (44,8%), чем среди людей, не страдающих сахарным диабетом 1-го типа (5,7%), что позволяет считать носительство аллеля Т предрасполагающим фактором к развитию СД 1-го типа (OR= 13,8; 95% CI: 7,48–25,46; р<0,001).
Полиморфный вариант rs9273363 характеризовался достоверно низкой частотой аллеля А (1,5%) в группе здоровых индивидов по сравнению с группой больных СД 1-го типа (53,6%). Отношение шансов (OR) риска развития заболевания для носителей аллеля А составило 76,15 (95% CI:24,89–233,02; р<0,001).
Результаты анализа распределения частот генотипов rs3104413 в сочетании с генотипами полиморфизмов rs2854275, rs9273363 среди больных СД 1-го типа и контрольной выборки представлены в таблице 5.
Таблица 5
Частота встречаемости генотипов полиморфизмов rs3104413, rs2854275, rs9273363 среди больных СД 1-го типа и контрольной выборки
|
Вариант сочетания генотипов, № |
rs3104413 |
rs2854275 |
rs9273363 |
Частота в группе СД 1-го типа, абс. (%) |
Частота в контрольной группе, абс. (%) |
RR (95% CI) |
р |
|
1 |
С/С |
T/T |
– |
14 (15,2) |
0 |
3,692 (3,055 – 4,463) |
<0,001 |
|
2 |
С/С |
G/G |
– |
8 (8,7) |
68 (32,4) |
0,283 (0,144 – 0,557) |
<0,001 |
|
3 |
С/С |
G/T |
– |
42 (45,7) |
8 (3,8) |
4,234 (3,212 – 5,58) |
<0,001 |
|
4 |
G/G |
– |
А/С |
12 (13) |
0 |
3,625 (3,008 – 4,368) |
<0,001 |
|
5 |
G/G |
– |
C/C |
0 |
88 (41,9) |
0,000 |
<0,001 |
|
6 |
С/G |
G/G |
А/А |
2 (2,2) |
0 |
3,333 (2,804 – 3,962) |
0.170 |
|
7 |
С/G |
G/G |
А/С |
6 (6,5) |
0 |
3,442 (2,881 – 4,113) |
0.002 |
|
8 |
С/G |
G/G |
C/C |
0 |
40 (19) |
0,000 |
<0,001 |
|
9 |
С/G |
G/T |
C/C |
2 (2,2) |
4 (1,9) |
1,096 (0,349 – 3,444) |
0.769 |
|
10 |
С/G |
G/T |
А/С |
4 (4,3) |
0 |
3,386 (2,842 – 4,036) |
0.013 |
|
11 |
С/G |
G/T |
А/А |
2 (2,2) |
2 (1) |
1,656 (0,612 – 4,478) |
0.759 |
Всего выявлено 11 вариантов сочетаний генотипов полиморфизмов rs3104413, rs2854275, rs9273363. В группе больных с СД 1-го типа наиболее часто встречались варианты № 3, 1 и 4, тогда как в группе контроля чаще отмечались № 5, 2 и 8.
Заключение
Наиболее высокими показателями относительного риска среди сочетаний генотипов являлись С/С полиморфизма rs3104413 в сочетании с гетерозиготным генотипом G/T полиморфизма rs2854275 – RR = 4,234 (р<0,001); генотип С/С полиморфизма rs3104413 в сочетании с генотипом Т/Т полиморфизма rs2854275 – RR = 3,692 (р<0,001); генотип G/G полиморфизма rs3104413 в сочетании с генотипом А/С полиморфизма rs9273363 – RR = 3,625 (р<0,001).
Таким образом, полученные данные могут быть использованы в качестве биологических предикторов развития СД 1-го типа с целью проведения своевременных персонализированных профилактических мероприятий.
Исследование было проведено в рамках НИР Изучение генетической структуры и груза наследственной патологии популяций Республики Саха (Якутия).



