Алгоритмы общеклинических исследований и инструментальной диагностики при острой абдоминальной хирургической патологии прописаны в Клинических рекомендациях РФ и стандартах диагностики и оказания медицинской помощи данной группе ургентных пациентов [1-3] и, как правило, обеспечивают высокую вероятность правильного диагноза. При затруднениях в дифференциальной диагностике выполняются более сложные инструментальные исследования и подключаются врачи смежных специальностей [1; 4; 5]. Некоторые сложные и трудоемкие диагностические процедуры требуют подготовки больного и на практике являются недоступными части лечебных учреждений, поэтому сохраняет актуальность поиск более простых лабораторных методов диагностики острой абдоминальной патологии [3; 5]. Многие диагностические и прогностические шкалы включают в число исследуемых параметров гематологические и биохимические показатели крови [1; 3; 4]. Если речь идет об острых заболеваниях желудочно-кишечного тракта (ЖКТ), логичным является анализ кала [1; 6], прежде всего на скрытую кровь, кишечную инфекцию или инвазию [5; 6]. Вместе с тем возможности фекальных маркеров острого и хронического воспаления кишечника еще до конца не раскрыты.
Одними из первых фекальных маркеров диагностики воспаления кишечника стали описанные на рубеже тысячелетий кальпротектин и лактоферрин [5; 7]. Считается, что их концентрация в фекалиях пропорциональна концентрации лейкоцитов, подвергшихся перевариванию в химусе [8; 9]. По причине расщепления протеолитическими ферментами слизистой кишечника и микрофлоры толстого кишечника в каловых массах отсутствуют и другие важные белковые маркеры, несущие информацию о состоянии определенных отделов кишечника (за исключением самых дистальных отделов кишки) [9; 10].
В последние годы повышенный интерес к фекальным биомолекулам типа лактоферрина (ЛФ), резистентным к действию кишечных протеаз и отражающим степень воспаления в слизистой кишечника, появился не только у гастроэнтерологов, но и у абдоминальных хирургов.
Сывороточный ЛФ – это давно и хорошо изученный ферропротеин из группы белков острой фазы, который продуцируют нейтрофилы и макрофаги, а секреторный ЛФ – клетки эпителия. Как и другие белки семейства трансферринов, ЛФ принимает участвует в организме в транспорте и метаболизме железа, но может связывать и другие двух- и трехвалентные катионы металлов [9]. Именно из-за способности связывать ионы металлов ЛФ проявляет бактериостатическую и бактерицидную активность, а также антиоксидантные и мембраностабилизирующие свойства и относится к факторам неспецифической защиты [8; 9]. Кроме того, макромолекула ЛФ обладает участками связывания для бактериальных эндотоксинов, цитотоксинов, липополисахаридов, гепарина и других макромолекул. Как иммунотропный белок, ЛФ участвует в регуляции клеточного и гуморального звена иммунитета, воздействуя через рецепторы иммунокомпетентных клеток, интерлейкины и систему комплемента [10; 11].
Концентрации сывороточного ЛФ повышаются как при локальных, так и при генерализованных деструктивно-воспалительных процессах (сепсис, пневмонии, панкреатит, онкологические процессы), а определение повышенных уровней ЛФ в сыворотке крови является надежным тестом воспалительного процесса любой этиологии [9; 10]. Получены данные, что высокие локальные уровни ЛФ удерживают нейтрофилы в воспалительном очаге и приводят к гнойному расплавлению тканей и развитию абсцессов.
Тест на сывороточный ЛФ в абдоминальной хирургии показал свою информативность в дифференциальной диагностике атипично протекающих форм воспалительных заболеваний ЖКТ и гепато-билиарной зоны (панкреатит, холецистит) [4; 11; 12]. Диагностическое значение фекального ЛФ в абдоминальной хирургии исследовано пока недостаточно [9; 10].
Цель исследования – изучить клинико-диагностическое значение лактоферрина при некоторых острых и хронических воспалительных заболеваниях кишечника.
Материалы и методы исследования. Концентрации лактоферрина (ЛФ) исследовались в образцах сывороток крови и экстрактов фекалий 154 больных в возрасте от 20 до 76 лет, при поступлении в хирургическое и гастроэнтерологическое отделения городской клинической больнице № 3 им. С.М. Кирова г. Астрахани в период с 2016 по 2018 год.
По результатам оперативного лечения пациенты были распределены на следующие группы: 17 больных с неосложненным острым аппендицитом (ОА), 10 – с гангренозно-перфоративным аппендицитом, осложненным распространенным гнойным аппендикулярным перитонитом (АП), 16 – с перфорацией язвы желудка и двенадцатиперстной кишки (ПЯЖ), 19 больных – с ущемленными паховыми грыжами (УГ) и 14 – с острой кишечной непроходимостью (ОКН), в том числе 6 – со странгуляционной тонкокишечной непроходимостью и 8 – с обтурационной толстокишечной непроходимостью опухолевого генеза. Кроме того, в исследование включены 3 больных с сосудистой патологией, поступивших и обследовавшихся дежурным хирургом в приемном отделении и впоследствии с диагностированным компенсированным и субкомпенсированным мезентериальным тромбозом кишечника.
Отдельной исследуемой группой являлись 14 больных гастроэнтерологического отделения с хроническими заболеваниями кишечника, из них 6 – с неспецифическим язвенным колитом (НЯК) и 8 – с болезнью Крона (БК).
Контрольной группой служили образцы сывороток крови и кала 16 пациентов в возрасте 18-55 лет, поступивших в плановом порядке для оперативного лечения неущемленных вентральных грыж, по результатам обследования соматически здоровых. Все диагнозы были верифицированы клинически и гистологически.
Кровь пациентов собиралась обычной венепункцией кубитальной вены в вакутайнеры и сыворотка отделялась от форменных элементов центрифугированием. Концентрации ЛФ в сыворотках крови и фекальных экстрактах определяли с помощью набора реагентов для ИФА ЗАО «Вектор-Бест» г. Новосибирск, чувствительность метода 20 нг/мл.
Образцы оформленного кала (примерно 0,1 г, соответствующий внутреннему объему пластикового наконечника шприца) разводили в чашке Петри ампулой физиологического раствора (изотонического раствора хлорида натрия − 10 мл), а жидких фекалий в объеме 0,1 мл (втянутых в наконечник шприца) − кратковременным перемешиванием с физиологическим раствором в шприце на 10 мл. Фекальные экстракты в объеме 100 мкл по возможности в течение 3 часов использовались для иммуноферментного анализа на лактоферрин или подвергались замораживанию в пробирках Эппендорфа.
Результаты обработаны методами описательной статистики с помощью прикладных пакетов программ Statistica, Ехсel и представлены в виде средних значений и их ошибок (М+m), медианы (Ме), 5 и 95 процентилей (Pc05-Pc95). Достоверность различий между группами оценивали по U-критерию Манна–Уитни. Достоверными считали различия при рU < 0,05.
Результаты исследований и их обсуждение. Результаты параллельного определения средних величин, медианы и крайних значений концентрации лактоферрина (ЛФ) в сыворотке крови и фекалиях у пациентов хирургического и гастроэнтерологического отделений представлены в таблице.
При катаральном ОА средние сывороточные концентрации ЛФ по сравнению с пациентами из контрольной группы (вентральные грыжи) увеличивались незначительно (до 119%). При поступлении пациентов с ОА, у которых диагностирован распространенный гнойный перитонит (группа АП), уровни ЛФ были достоверно выше контроля (p<0,05) в 3 раза (табл.).
По сравнению с плановыми больными с неущемленными грыжами, у пациентов с ущемленными паховыми грыжами средние концентрации ЛФ в сыворотках крови при поступлении возрастали до уровней осложненных форм ОА (в среднем в 2,9 раза). Примерно такое же повышение средних уровней ЛФ относительно нормы наблюдалось у больных со странгуляционной и обтурационной ОКН (соответственно в 2,6 и 2,8 раза) и у пациентов гастроэнтерологического отделения с неспецифическим язвенным колитом (НЯК) и болезнью Крона (БК): также соответственно в 2,6 и 2,8 раза (табл.).
Концентрация лактоферрина в сыворотке крови и экстрактах фекалий у больных с острыми и хроническими заболеваниями ЖКТ (M±m, Ме, Pc05-Pc95)
|
Нозология, число пациентов в группе |
Лактоферрин сывороточный нг/мл, в % к контролю |
Лактоферрин фекальный нг/г кала в % к контролю |
Отношение ЛФфек/ЛФсыв мл/г |
|
Контроль (вентральные грыжи) n=16 |
1040±189 990 (100-2900) |
4600±450 4600 (200-7500) |
4,646 |
|
О. аппендицит неосложненный n=17 |
1240±224 119% 1090 (200-4100) |
14300±1120* 310,9% 14300 (7800-22400) |
11,532 |
|
Аппендикулярный перитонит n=10 |
3160±630* 303,8% 2800 (950-6720) |
32600±7360* 708,7% 28100 (8400-72600) |
10,316 |
|
Ущемленные паховые грыжи n=19 |
2990±332* 287,5% 2600 (960-6720) |
23300±3120* 506,5% 23000 (3700-54700) |
7,793 |
|
Перфоративная язва желудка и ДПК n=16 |
1890±296 181,7% 1560 (610-5050) |
26900±3900* 584,8% 24100 (7600-63500) |
14,233 |
|
Острая кишечная непроходимость (ОКН), n=14 в том числе: |
2740±501* 263,5% 2435 (730-7610) |
32500±6080* 706,5% 26800 (5700-83600) |
11,861 |
|
Острая странгуляционная тонкокишечная непроходимость n=8 |
2860±771* 263,5% 2435 (730-7610) |
23600±6940* 512,1% 17500 (5700-66000) |
8,252 |
|
Острая обтурационная толстокишечная непроходимость n=6 |
2590±636* 275,0% 2385 (840-5100) |
40900±6530* 889,1% 39300 (2110-62700) |
15,792 |
|
Субкомпенсированный мезотромбоз кишечника n=3 |
1920±589 184,6% 1810 (960-2990) |
13500±4560* 293,5% 11500 (6800-22200) |
7,031 |
|
Неспецифический язвенный колит (НЯК) n=6 |
2690±503* 258,7% 2690 (1030-4410) |
59900±9270* 1267% 61850 (25600-90900) |
22,268 |
|
Болезнь Крона (БК) n=8 |
2900±459* 278,8% 2630 (1300-5250) |
63900±7240* 1389% 61650 (35700-97700) |
22,034 |
Примечание: * – достоверные различия по сравнению с контрольной группой (p < 0,05).
Недостоверное повышение сывороточных уровней ЛФ обнаружено при поступлении в приемное отделение больных с перфорацией язвы желудка и двенадцатиперстной кишки (ДПК) и трех больных, у которых диагностирован тромбоз мезентериальных сосудов (в обоих случаях уровни ЛФ в 1,8 раза выше контрольных цифр). Следует отметить, что в последующие дни после поступления и оперативного лечения больных этих двух групп происходило дальнейшее достоверное нарастание в их крови уровней ЛФ.
В фекалиях пациентов всех групп обнаружены статистически достоверно (p < 0,05) повышенные средние концентрации ЛФ по сравнению с контрольной группой (табл.): в 3-7 раз выше при острых хирургических заболеваниях ЖКТ (рис.). Но максимальное увеличение уровней фекального ЛФ обнаружено у пациентов гастроэнтерологического отделения при обострении НЯК и БК (в 12,7 и 13,9 раза соответственно).
Следовательно, определение уровня фекального ЛФ является более чувствительным тестом для диагностики заболеваний ЖКТ, чем измерение его уровня в сыворотке крови.
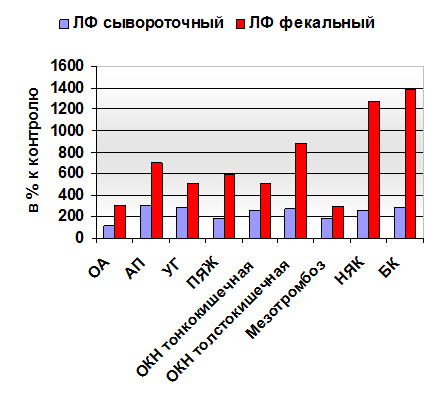
Диаграмма уровней ЛФ в крови и фекалиях больных с катаральным острым аппендицитом (ОА), аппендикулярным перитонитом (АП), ущемленными паховыми грыжами (УГ), перфорацией язвы желудка (ПЯЖ), острой тонко- и толстокишечной непроходимостью (ОКН), мезентериальным тромбозом и хроническими заболеваниями кишечника: неспецифическим язвенным колитом (НЯК) и болезнью Крона (БК)
При этом уровни фекального ЛФ при острой хирургической патологии повышаются до одинаковых величин как при патологии, локализующейся в проксимальных отделах кишечника (ПЯЖ), так и в дистальных отделах толстой кишки (ОКН). То есть уровень фекального ЛФ зависит не от степени тяжести воспалительного процесса в кишечнике, а от его продолжительности. Этот тезис подтверждается сверхвысокими концентрациями фекального ЛФ при хронических воспалительных заболеваниях кишечника (ХВЗК).
Анализируя отношение ЛФфек/ЛФсыв (табл.), мы обнаружили, что его величина менее 5 мл сыворотки крови на г кала соответствует норме (пациенты с неосложненными вентральными грыжами), величина ниже 10 мл/г встречается при поступлении у больных с ущемленными паховыми грыжами, а также с тромбозом кишечника и тонкокишечной странгуляционной непроходимостью. Все острые воспалительные процессы в кишечнике достоверно повышали отношение фекального ЛФ к сывороточному ЛФ (табл.) более чем в 10 раз.
Заключение
Выбор в качестве индикатора острого аппендицита фекального лактоферрина объясняется тем, что воспалительный процесс в кишечнике сопровождается не только общим лейкоцитозом, но и локальным увеличением их содержания в очаге воспаления в кишечнике. Однако определение лейкоцитов в фекалиях бессмысленно из-за их лизиса протеолитическими ферментами кишечной микрофлоры.
Лактоферрин, уровень которого полностью коррелирует с уровнем лейкоцитов в крови, является белком, устойчивым к протеолизу в кишечнике, благодаря чему находит применение для дифференциальной диагностики хронических воспалительных и невоспалительных заболеваний кишечника (таких, как неспецифический язвенный колит и болезнь Крона) или в качестве онкомаркера начальных стадий колоректального рака.
Высокие концентрации фекального ЛФ обнаруживаются при многих острых хирургических заболеваниях ЖКТ, но никогда при поступлении больных с абдоминальной хирургической патологией не достигают сверхвысоких концентраций фекального ЛФ, встречающихся только при хронических воспалительных заболеваниях кишечника (ХВЗК). Следовательно, уровень фекального ЛФ зависит не от степени тяжести воспалительного процесса в кишечнике, а от его продолжительности.
Полученные результаты позволяют предполагать, что тест на фекальный ЛФ может найти применение как инструмент для дифференциальной диагностики острого аппендицита и другой острой патологии органов брюшной полости и забрюшинного пространства.



