Антибактериальные препараты с момента их внедрения в широкую медицинскую практику существенно повлияли на структуру заболеваемости и достоверно снизили летальность от инфекционных болезней. В 1960–1970-х гг. существовало предположение, что применение антибактериальных средств в конце концов приведет к значительному сокращению случаев осложнений и снижению смертности, связанных с инфекционными заболеваниями. Однако по мере появления новых классов антибиотиков постоянно развиваются и новые механизмы резистентности микроорганизмов [1]. По данным экспертов, в настоящее время на различных стадиях исследований и разработок (Research & Development, R&D) находится около 200 антибактериальных средств. При этом большинство изучаемых антимикробных препаратов действуют только на грамположительные бактерии [2].
За последние 20 лет многие большие фармацевтические компании, например Pfizer, Eli Lilly and Company и Bristol-Myers Squibb, сократили число разработок или закрыли проекты по созданию новых антибиотиков. Это объясняется тем, что все большее количество микроорганизмов адаптируется к антимикробным препаратам [3]. В настоящее время имеется острая необходимость в новых антибактериальных препаратах. Однако, несмотря на это, ситуация с введением в практику препаратов этой группы год от года ухудшается – количество вводимых в практику антибиотиков падает [4]. Возможным решением этой проблемы может стать поиск таких препаратов, к которым у бактерий не развивается механизм резистентности.
Антимикробные пептиды (АМП), содержащиеся в нейтрофилах человека и животных, являются важными факторами системы врожденного иммунитета, обеспечивающими противоинфекционную защиту [5]. Изучение антимикробных пептидов разных видов животных важно для развития фундаментальных знаний о молекулярных механизмах иммунных реакций, а также для получения информации о новых структурах пептидов, которые в дальнейшем могут быть использованы в качестве моделей для создания антибиотических препаратов нового поколения. Эти новые лекарственные средства перспективны для решения проблем, связанных с устойчивостью патогенных микроорганизмов к применяемым в клинике антибиотикам [6].
Клетки крови в разбавленных суспензиях весьма чувствительны к ультразвуковому воздействию и начинают разрушаться при интенсивности 0,3 Вт/см2, совпадающей с порогом кавитации в воде. Для разрушения клеток эффективен низкочастотный ультразвук. Регулируя условия ультразвукового воздействия – меняя частоту, мощность и время, можно получить конечный продукт с заданными свойствами [7].
Известно, что человеческие лейкоциты обеспечивают защиту нашего организма от различных инфекционных агентов. Целью данного исследования является получение субстанции, обладающей антимикробным и противовирусным действием путем разрушения лейкоцитарных клеток человека. Полученная субстанция может стать основой для создания новых лекарственных препаратов широкого спектра действия.
Материалы и методы исследования
В качестве объекта исследования были использованы донорские лейкоциты человека, проверенные на отсутствие гемотрансмиссивных инфекций: HBsАg к вирусу гепатита В, антитела к вирусу гепатита С и ВИЧ, сифилиса. Для получения пептидов из человеческих лейкоцитов осуществляли ультразвуковое воздействие на клетки. Цитолиз лейкоцитов осуществляли с использованием ультразвукового процессора UP50H (Helischer Ultrasonics, Германия). Под воздействием ультразвука на лейкоцитарную суспензию происходило разрушение клеток. Полученную гомогенную непрозрачную суспензию освобождали от клеточных остатков центрифугированием в течение 3 мин при скорости 1300 об/мин и температуре 6°С.
Для определения молекулярного состава лейкоцитарных полипептидов, полученных после обработки ультразвуком, проведен анализ высокоэффективной жидкостной хроматографии (ВЭЖХ). Содержание пептидных соединений контролировали в растворе комплекса с концентрацией 1 мг/мл по сухому веществу. Идентификацию молекулярных масс пептидов проводили на хроматографе фирмы Knauer c использованием колонки Superdex 10.
В качестве маркеров молекулярного веса использованы молекулы, указанные в таблице 1.
Таблица 1
Молекулярная масса молекул, использованных для калибровки хроматографической колонки
|
Название молекулы |
Молекулярный вес, кДа |
|
Aprotinin |
6,5 |
|
Riboniclease |
13,7 |
|
Carbonic Anhydrase |
29,0 |
|
Ovalbumin |
43,0 |
|
Conalbumin |
75,0 |
|
Aldolase |
158,0 |
|
Ferritin |
440,0 |
Определение биологической активности лейкоцитарного лизата проводили методом серийных разведений в бульоне согласно Методическим указаниям (МУК) 4.2.1890-04 Определение чувствительности микроорганизмов к антибактериальным препаратам. Для изучения антибактериальных свойств полученного полипептидного комплекса использовали штаммы Staphylococcus cohnii 3165 и Escherichia coli ATCC 25922. Оценка антибактериальной активности исследуемых лизатов проведена под руководством к.м.н., зав. лабораторией биохимии развития микроорганизмов, доцента Института экологии и генетики микроорганизмов Уральского отделения Российской академии наук В.П. Коробова. Для оценки антибактериальной активности в подготовленные 96-луночные планшеты для иммунологических исследований проводили инокуляцию приготовленной суспензии исследуемого микроорганизма. Далее планшеты инкубировали при температуре 37°С. Учет результатов проводили визуально, сравнивая рост микроорганизма в присутствии лейкоцитарного лизата с ростом культуры без него. За минимальную подавляющую концентрацию принимали минимальную концентрацию, обеспечивающую полное подавление видимого роста исследуемого штамма. Определение противовирусной активности проводили согласно Общей фармакопейной статье (ОФС) Биологические методы испытания препаратов интерферона с использованием культур клеток путем сравнения протективного действия полученного пептидного комплекса с аналогичным действием международного стандартного образца (МСО) или соответствующего стандартного образца, откалиброванного в Международных единицах (МЕ) по соответствующему международному стандарту.
Полученные цифровые экспериментальные данные обработаны методом вариационной статистики с использованием t-критерия Стьюдента. Вычисления и построение диаграмм, отражающих динамику изученных показателей, совершали с поддержкой программы Microsoft Excel XP. Применен текстовый процессор Microsoft Word XP.
Результаты исследования и их обсуждение
Лейкоцитарные лизаты, полученные с помощью ультразвуковой (УЗ) деструкции, были подвергнуты очистке, позволяющей освободиться от балластов и основной массы высокомолекулярных белков. Очищенный таким способом супернатант разделяли на фракции с помощью ВЭЖХ (рис. 1, табл. 2).
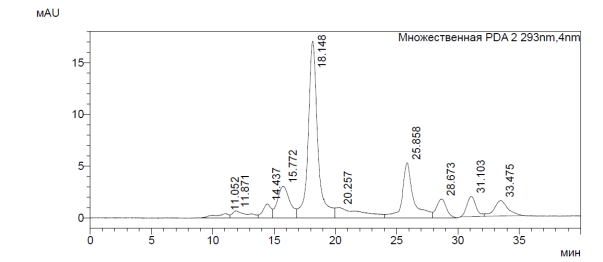
Рис. 1. Результаты ВЭЖХ лейкоцитарных полипептидов
Таблица 2
Молекулярный состав лейкоцитарных пептидов
|
Процентное содержание пептидов от общего числа |
Молекулярная масса, кДа |
|
3,644 |
440 |
|
9,806 |
От 440 до 158 |
|
43,583 |
75 |
|
26,155 |
От 43 до 29 |
|
16,812 |
Менее 6,5 |
Анализ сигналов представленных изображений позволил предположить наличие во фракциях пептидных составляющих и высокомолекулярных молекул. Следует отметить, что около половины от всего состава (43,583%) составили белковые молекулы со средней молекулярной массой 75 кДа и 42,967% с молекулярной массой от 43 до 6,5 кДа. Содержание в смеси молекул с массой 75 кДа и выше свидетельствует о необходимости проведения более тонкой очистки с сопутствующим подбором сорбционного материала. Только 16,8% составили фракции пептидных составляющих с молекулярной массой менее 6,5 кДа.
Было получено и проанализировано на наличие антибактериальной активности 5 образцов УЗ лизата лейкоцитов (табл. 3).
Таблица 3
Определение антибактериальной активности лейкоцитарного лизата
|
№ образца |
Титр антибактериальной активности, мг/мл* |
|
|
St. cohnii |
E. coli |
|
|
1 |
0,0547 |
0,875 |
|
2 |
0,0547 |
0,875 |
|
3 |
0,0273 |
0,219 |
|
4 |
0,1094 |
0,875 |
|
5 |
0,0547 |
0,437 |
|
M±m** |
0,060±0,015 |
0,656±0,155 |
Примечание. * – необходимая концентрация пептидного комплекса, при которой прекращается рост тестовых штаммов.
** – Число степеней свободы (f) равно 4. Парный t-критерий Стьюдента равен 4,098. Критическое значение t-критерия Стьюдента при данном числе степеней свободы составляет 2,776. tнабл > tкрит, изменения признака статистически значимы.
При использовании в качестве тестовых микроорганизмов St. cohnii (грамположительные) и E. coli (грамотрицательные) наблюдали достоверную оценку антибактериальной активности лейкоцитарного лизата методом микротитрования на 96-луночных планшетах. Таким образом, УЗ-лизат лейкоцитов более эффективно тормозит рост грамм (+) бактерий, подобных St. Cohnii, в сравнении с грамм (-) бактериями, такими как E. coli (0,060 мг/мл и 0,656 мг/мл соответственно).
Результаты изучения противовирусной активности УЗ-лизата лейкоцитов представлены на рисунке 2.
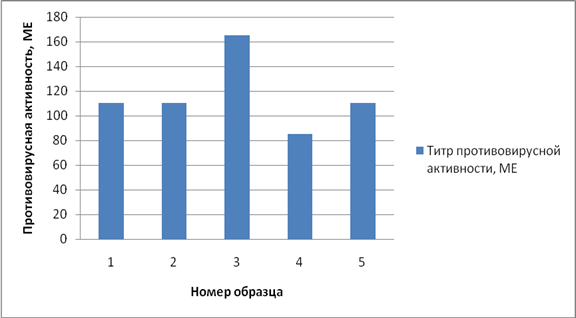
Рис. 2. Уровень противовирусной активности исследуемого лейкоцитарного лизата
Из данных, представленных на рисунке 2, можно сделать вывод, что полученный лейкоцитарный лизат обладал противовирусной активностью, которая варьировала в пределах от 85 до 165 МЕ. Согласно литературным данным даже незначительные дозы препаратов человеческого лейкоцитарного интерферона с противовирусной активностью 128 МЕ при неоднократном введении людям разных возрастных групп были эффективны до 69% в зависимости от возраста участников. Известно, что применение лейкоцитарного интерферона с низкой активностью (32 МЕ) в лечебно-профилактических целях позволило снизить заболеваемость детей в 3,9 раза по сравнению с контрольной группой, получавшей плацебо. А использование препарата перорально с суточной дозой от 75 до 200 МЕ в течение от 120 до 300 дней дает положительный эффект при лечении больных хроническим вирусным гепатитом типа В [8].
Таким образом, полученный нами лейкоцитарный лизат обладал антибактериальной активностью в отношении грамположительных и грамотрицательных микроорганизмов и противовирусной активностью до 165 МЕ и может служить основой лекарственных средств для профилактики бактериальных и вирусных инфекций.
Заключение
Данное исследование показало, что одним из способов получения белковых фракций лейкоцитов может являться ультразвуковая деструкция клеток. Полученный лейкоцитарный лизат содержал в своем составе как высоко-, так и низкомолекулярные соединения. Этот факт говорит о необходимости доработки технологии получения низкомолекулярных пептидов из лейкоцитов человека. Присутствие в составе лейкоцитарного лизата высокомолекулярных соединений свидетельствует о целесообразности проведения более тонкой очистки полученной субстанции от балластных белков. Полученные экспериментальные данные показали, что лейкоцитарный лизат, полученный с помощью физического разрушения клеток, обладал антибактериальной и противовирусной активностью, что может служить основой для создания комплексного препарата, направленного на профилактику и лечение бактериальных и вирусных инфекций различной этиологии.



