Создание и апробация новых материалов для заполнения дефектов костей и стимуляции репаративного процесса в случае замедленного остеогенеза является актуальным направлением практической медицины [1-3]. В настоящее время наряду с разработкой искусственных имплантатов отмечается возобновление интереса к использованию биогенных, и в частности ксеногенных, материалов на основе костного матрикса [2; 4; 5].
Данный подход обеспечивает хорошую биосовместимость и последующую элиминацию имплантатов с замещением их органотипической костью [1], обеспечивая адекватные локальные условия для клеточных источников репаративного остеогистогенеза [5; 6].
В то же время остеопластические свойства имплантационных материалов на основе костного матрикса могут быть значительно улучшены при их сочетании с механически прочными металлоконструкциями и биологически активными веществами [7-9].
Ранее нами были представлены предварительные экспериментальные исследования по разработке остеопластических материалов на основе ксеногенного костного матрикса, трехмерных конструкций никелида титана и композиции на основе аллогенной плазмы крови и биологически активных веществ [9].
Целью настоящей работы явилась рентгенологическая характеристика влияния данных материалов и их компонентов на формообразование в области его подкожной (гетеротопической) и внутрикостной (ортотопической) имплантации экспериментальным животным.
Материалы и методы исследования
Контролируемое нерандомизированное исследование было выполнено на 64 животных (половозрелые крысы линии Вистар) с использованием экспериментальных моделей гетеротопической подкожной и ортотопической внутрикостной имплантации [9]. Проведение исследований было одобрено экспертным комитетом по этике ФГБУ «Российский научный центр «Восстановительная травматология и ортопедия» им. академика Г.А. Илизарова» Минздрава России (протокол № 3 (35) от 9.12.2013).
Все эксперименты были разделены на 4 группы и 16 серий в зависимости от экспериментальной модели и состава имплантационного материала (табл. 1, 2). В каждой экспериментальной серии состав подкожных имплантатов слева и справа различался, что обозначено в таблицах как «слева (л)», «справа (п)», а в тексте сокращениями – 1п, 1л, 2п, 2л и т.д. Непосредственно перед использованием образцы материалов инкубировали при комнатной температуре не менее 15 минут с равным объемом растворов, представляющих собой компоненты или сочетания компонентов остеоиндуцирующей композиции [10]. Сроки наблюдения во всех экспериментальных группах составляли 28 и 84 суток – краткосрочный и среднесрочный периоды соответственно.
Рентгенологическое исследование выполнено с использованием аппарата Premium Vet (Sedecal, Испания). Снимки тела животных в области имплантации получали в дорсо-вентральной и латеральной проекциях до операции, после имплантации материала и по окончании эксперимента.
Таблица 1
Состав образцов материалов* для гетеротопической подкожной имплантации
|
Группа экспериментов |
Серия |
Кол-во животных |
Состав имплантационных материалов |
|
|
Слева (л) |
Справа (п) |
|||
|
1 |
1 |
4 |
МКМ + ФР |
МКМ + ГЛ |
|
2 |
4 |
МКМ + АК |
МКМ + АК + ГЛ |
|
|
3 |
4 |
МКМ + ПЛ |
МКМ + ПЛ + ГЛ |
|
|
4 |
4 |
МКМ + ПЛ + АК |
МКМ + ПЛ + АК + ГЛ |
|
|
2 |
5 |
4 |
TiNi + ФР |
TiNi + ГЛ |
|
6 |
4 |
TiNi + АК |
TiNi + АК + ГЛ |
|
|
7 |
4 |
TiNi + ПЛ |
TiNi + ПЛ + ГЛ |
|
|
8 |
4 |
TiNi + ПЛ + АК |
TiNi + ПЛ + АК +ГЛ |
|
|
3 |
9 |
4 |
МКМ + TiNi + ФР |
МКМ + TiNi + ГЛ |
|
10 |
4 |
МКМ + TiNi + АК |
МКМ + TiNi + АК + ГЛ |
|
|
11 |
4 |
МКМ + TiNi + ПЛ |
МКМ + TiNi + ПЛ +ГЛ |
|
|
12 |
4 |
МКМ + TiNi + ПЛ +АК |
МКМ + TiNi + ПЛ +АК + ГЛ |
|
Таблица 2
Состав образцов материалов* для ортотопической внутрикостной имплантации
|
Группа экспериментов |
Серия |
Кол-во животных |
Состав имплантационных материалов |
|
|
Слева (л) |
Справа (п) |
|||
|
4 |
13 |
4 |
TiNi+ФР |
Zero (ФР) |
|
14 |
4 |
МКМ+TiNi+ФР |
МКМ+ФР |
|
|
15 |
4 |
МКМ+TiNi+ПЛ |
МКМ+ПЛ |
|
|
16 |
4 |
МКМ+TiNi+АК+ГЛ+ПЛ |
МКМ+TiNi+АК+ПЛ |
|
* МКМ – минерализованный костный матрикс, ФР – 0,9% раствор натрия хлорида, ГЛ – глюкоза, АК – аскорбиновая кислота, ПЛ – аллогенная плазма крови, TiNi – никелид титана.
Изучение и интерпретацию рентгеновских снимков производили при помощи негатоскопа «Н-48» (Россия). Оцифровку рентгенограмм осуществляли фотоаппаратом Nikon D5100 (Nikon, Япония), содержание рентгеноплотных компонентов в области имплантации анализировали на аппаратно-программном комплексе «ВидеоТесТ» («ВидеоТесТ», Россия). Параметром оценки являлась средняя интенсивность теней имплантатов, а также мягких тканей и фона изображений рентгенограмм. Полученные цифровые данные использовали для расчета средней оптической плотности (СОП) [11; 12]. Статистический анализ данных выполняли в программе AtteStat 13.1 (Россия). Для построения диаграммы использовали выборочные значения медиан. Межгрупповые различия оценивали с применением критерия Манна-Уитни для независимых выборок при уровне значимости рu < 0,05.
Результаты исследования и их обсуждение
Анализ результатов рентгенологического исследования при гетеротопической имплантации экспериментальных материалов показал, что образцы не мигрировали на протяжении всего периода эксперимента. На рентгенограммах, полученных в день выполнения операции, тени в области имплантации материалов на основе МКМ диаметром 7-10 мм имели округлую форму, четкие контуры, различную степень неоднородности. Рентгеноплотные тени конструкций никелида титана размером 2×5 мм имели четкие ровные контуры и сохраняли форму на протяжении всего эксперимента. Динамика показателей средней оптической плотности (СОП) на изображениях рентгенограмм в области имплантации образцов материалов представлена на диаграмме (рис. 1), статистическая значимость внутри- и межгрупповых отличий показателя СОП отражена в таблице 3.
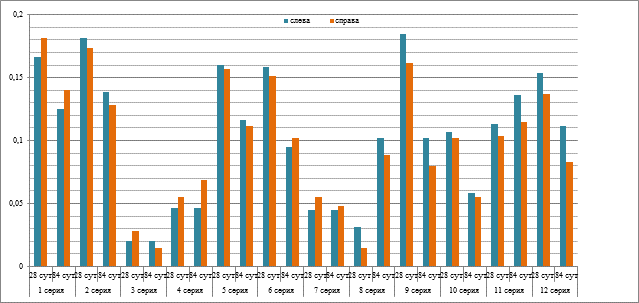
Рис. 1. Динамика показателей средней оптической плотности (СОП) теней на рентгенологических изображениях области гетеротопической имплантации материалов
Таблица 3
Статистическая значимость внутри- и межгрупповых отличий показателя СОП при гетеротопической имплантации экспериментальных материалов (р < 0,05)
|
Серия |
Срок эксперимента (сут) |
pu 28-84 внутригрупповой* |
pu межгрупповой# |
|||
|
слева (л) |
справа (п) |
слева (л) |
справа (п) |
серия сравнения (28-84 сут) |
||
|
1 |
28 |
0,074 |
0,036 |
1 |
0,431 |
1л |
|
84 |
1 |
0,431 |
||||
|
2 |
28 |
0,005 |
0,0136 |
0,958 |
0,958 |
|
|
84 |
0,958 |
0,462 |
||||
|
3 |
28 |
0,031 |
0,529 |
0,001 |
0,007 |
|
|
84 |
0,001 |
0,007 |
||||
|
4 |
28 |
0,189 |
0,713 |
0,001 |
0,001 |
|
|
84 |
0,001 |
0,001 |
||||
|
5 |
28 |
0,002 |
0,294 |
1 |
0,599 |
5л |
|
84 |
1 |
0,875 |
||||
|
6 |
28 |
0,001 |
0,009 |
0,753 |
0,753 |
|
|
84 |
0,318 |
0,141 |
||||
|
7 |
28 |
0,462 |
0,916 |
0,001 |
0,0001 |
|
|
84 |
0,001 |
0,002 |
||||
|
8 |
28 |
0,001 |
0,005 |
0,001 |
0,001 |
|
|
84 |
0,0357 |
0,1893 |
||||
|
9 |
28 |
0,001 |
0,003 |
1 |
0,172 |
9л |
|
84 |
1 |
0,599 |
||||
|
10 |
28 |
0,016 |
0,005 |
0,003 |
0,003 |
|
|
84 |
0,207 |
0,115 |
||||
|
11 |
28 |
0,318 |
0,431 |
0,001 |
0,003 |
|
|
84 |
0,036 |
0,027 |
||||
|
12 |
28 |
0,001 |
0,0587 |
0,027 |
0,401 |
|
|
84 |
0,916 |
0,270 |
||||
* - уровень значимости различий для разных сроков одной серии экспериментов;
# - уровень значимости различий между разными сериями для одного срока экспериментов; полужирным шрифтом выделены значения рu <0,05.
Анализ результатов расчета СОП теней имплантатов показал, что в сериях 1, 2, 5, 6, 9 и 12 к 28-м суткам отмечались наибольшие значения данного показателя, которые значимо изменялись к 84-м суткам эксперимента для 1п, 2л, 3л, 5л, 6, 8, 9, 12л. Наименьшие показатели СОП теней имплантатов были определены у животных серии 3. Сравнение значений СОП при имплантации МКМ и TiNi в сочетании с ФР (серии 1л, 5л, 9л) с СОП в сериях, где инкубацию проводили с биологически активными препаратами, выявило достоверные межгрупповые отличия – рост либо снижение значений показателя в сериях 3, 4, 7, 8, 10 и 11 (табл. 3).
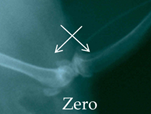
При ортотопической внутрикостной имплантации различных образцов экспериментальных материалов через 28 и 84 суток эксперимента у животных 4-й группы опытов наблюдалась разнородная рентгенологическая картина, однако в пределах каждой серии она была сходной. В серии 13п (без заполнения дефекта) на рентгенограммах, выполненных в день операции, в области дистального метафиза бедренной кости и проксимального метафиза большой берцовой кости визуализировались дефекты в виде просветления округлой формы с ровными четкими контурами.
|
|
|
|
|
|
а |
б |
в |
г |
|
|
|
|
|
|
д |
е |
ж |
з |
|
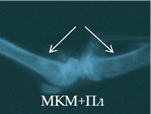
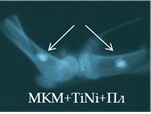
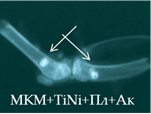
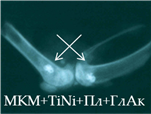
Рис. 2. Рентгенологическая картина области моделирования костных дефектов через 84 суток после имплантации остеопластических материалов. Расположение области моделирования дефекта (а) и имплантационных материалов (б-з) указано стрелками |
|||
На 28-е сутки после операции область дефекта обнаруживалась в виде участка округлой формы с размытыми краями, заполненного гомогенными тенями слабой интенсивности. К 84-м суткам эксперимента область дефекта слабо визуализировалась (рис. 2а).
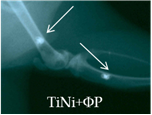
В серии 13л на 28-е сутки эксперимента трехмерные конструкции TiNi визуализировались на фоне участка просветления овальной формы, превосходящего по размеру первоначальный дефект. К 84-м суткам эксперимента область моделирования дефекта заполняли гомогенные тени слабой и средней интенсивности (рис. 2б). Высокоинтенсивные тени проволоки TiNi были смещены из области первоначального размещения в полость диафиза оперированной кости.
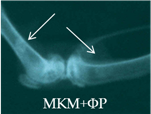
В серии 14п вплоть до 28-х суток эксперимента имплантированные фрагменты МКМ+ФР прослеживались в виде гомогенных теней средней интенсивности с неровным четким контуром. К 84-м суткам имплантированный материал имел неоднородную структуру, неровный размытый контур, среднюю интенсивность теней (рис. 2в). Отмечалось смещение имплантатов в полость диафиза.
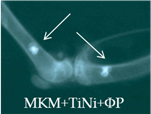
На 28-е сутки после имплантации фрагментов МКМ с ФР, армированных проволокой из TiNi (серия 14л), между отчетливыми витками проволоки прослеживались тени слабой интенсивности. К 84-м суткам интенсивность теней МКМ между витками металлоконструкции не увеличивалась, а вокруг имплантатов определялась зона просветления (рис. 2г). Смещение имплантатов было отмечено и в этой серии экспериментов.
При имплантации МКМ после инкубации с плазмой (серия 15п) на 28-е сутки в зоне имплантации определялись тени средней плотности, однородной структуры, округлой формы с ровными нечеткими краями. К 84-м суткам тени и контуры теней имплантата теряли четкость и изменяли форму (рис. 2д). Смещение имплантатов было незначительным.
В серии 15л с имплантацией МКМ+TiNi+ПЛ интенсивность теней МКМ между петель проволоки возрастала до средней и высокой с 28-х по 84-е сутки эксперимента (рис. 2е) при небольшом смещении материала из области операции.
В серии 16п (МКМ+TiNi+АК+ПЛ) на 28-е сутки после имплантации между петель проволоки визуализировались тени низкой и средней интенсивности. К 84-м суткам отмечалось увеличение плотности теней в промежутках между элементами металлоимплантата (рис. 2ж), смещение материалов из области имплантации было минимальным.
В серии 16л при имплантации материала, сочетающего все использованные компоненты (МКМ+TiNi+АК+ГЛ+ПЛ), на 28-е и 84-е сутки эксперимента наблюдалось равномерное заполнение зоны дефекта гетерогенными тенями высокой интенсивности с четкими контурами без смещения из зоны имплантации (рис. 2з). Согласно результатам проведенного ранее предварительного исследования, этот эффект был обусловлен сопряжением процессов остеокластической резорбции и остеоиндукции на поверхности минерализованного костного матрикса – как в экспериментах по гетеротопической, так и ортотопической имплантации [9].
Заключение
Таким образом, результаты выполненного исследования демонстрируют формообразующее влияние остеопластического композиционного материала на основе ксеногенного костного матрикса, трехмерных конструкций никелида титана, аллогенной плазмы крови и биологически активных веществ аскорбиновой кислоты и глюкозы на заживление дефекта метафизов трубчатых костей крыс в результате синергичного взаимодействия его компонентов. Полученные данные отражают совокупную степень биодеградируемости материалов и выраженности продуктивной реакции тканей на их имплантацию.