Лечение онкологических заболеваний головного мозга - одна из задач современной высокотехнологичной медицины. В мировой практике бор-нейтронозахватная терапия (БНЗТ) рассматривается как перспективная экспериментальная методика для лечения глиобластомы головного мозга [1; 2]. Основой методики является селективное накопление в опухолевых клетках нерадиоактивного изотопа бор-10 и последующее облучение нейтронами. В качестве препаратов адресной доставки бора в опухоль используют L-p-борфенилаланин (ВРА) и боркаптат (BSH). В результате поглощения нейтрона бором происходит ядерная реакция с большим выделением энергии в опухолевой клетке, что приводит к ее гибели [3; 4].
Цель исследования – в клиническом эксперименте in vivo проанализировать действие БНЗТ на рост онкологической опухоли у животных.
Материал и методы исследования
Исследование выполнено на базе Центра генетических ресурсов лабораторных животных, SPF-вивария Института цитологии и генетики СО РАН. Все эксперименты на животных были одобрены межинститутской комиссией по биоэтике и соответствуют принципам Руководства по уходу и использованию лабораторных животных, изданного US NIH (№ 85-23, пересмотрено в 1985 г.).
Создание опухолевого ортотопического ксенотрансплантата у животного. Клеточную линию U87 – линию глиобластомы человека - культивировали на среде DMEM-F12 («Биолот», Россия) с добавлением 10% фетальной бычьей сыворотки (Gibco, США) и гентамицина 50 мкг/мл («Белмедпрепараты», Республика Беларусь) в СО2-инкубаторе при температуре 37 °С с дотацией 5% СО2. В качестве экспериментальной модели использовали 8-недельных иммунодефицитных самцов мышей линии SCID. Была проведена интракраниальная инокуляция 500 тыс. клеток линии U87 с последующим МРТ-контролем (томограф «BioSpec 117/16USR») для подтверждения наличия опухоли и измерения её размеров.
Создание опухолевого гетеротопического ксенотрансплантата у животного. Группе 8-недельных самцов мышиной линии Nu/J подкожно введено 10 млн клеток линии U87. Объем опухоли контролировали, измеряя длину и ширину образования.
В качестве агентов адресной доставки бора использовали борфенилаланин (BPA) и боркаптат (BSH), обогащенные изотопом 10В (Katchem, Чехия). Раствор BPA готовили из расчета 350 мг/кг массы тела. Для растворения препарата использовали D-фруктозу в молярном избытке. Концентрация бора в растворе составила 4,2 мг/мл. Препарат вводили в ретроорбитальный синус по 2,5 мкл/г за 2 ч до облучения. Раствор BSH изготавливали на 0,9% физиологическом растворе из расчета 100 мг/кг. Концентрация 10В в растворе составила 17 мг/мл. Препарат вводили в ретроорбитальный синус по 4 мкл/г за 1,5 ч до облучения.
Облучение мышей с внутримозговыми опухолевыми трансплантатами. БНЗТ проведена на 24-е сут. после инокуляции опухолевых клеток. Мышей распределили в четыре группы по шесть животных в каждой. Группа 1 получила БНЗТ с BPA, группа 2 – БНЗТ с BSH, группа 3 была облучена эпитепловыми нейтронами без препаратов бора, группа 4 – группа контроля. Все группы наркотизированы внутрибрюшинным введением домитора и золетила. Животных транспортировали в пенопластовом теплоизолирующем контейнере. Облучение проведено на ускорительном источнике эпитепловых нейтронов Института ядерной физики СО РАН [5], на котором было изучено влияние нейтронного излучения на клеточные культуры, инкубированные в среде бора [6]. Мыши были уложены радиально головами к центру в специальный контейнер, закрывающий тело животного слоем литиевого полиэтилена. Животные контрольной группы на время облучения остались в пенопластовом контейнере с адекватным доступом кислорода и температурой окружающей среды. Для облучаемых мышей были также созданы оптимальные температурные условия. Суммарное время облучения составило 2 ч 46 мин. Во время эксперимента мониторировали следующие параметры: ток и энергию пучка протонов, плотность потока нейтронов. Проводили дозиметрию, основанную на активации золота. Суммарный интеграл тока составил 5,46 мА/час. Согласно расчетам, группа БНЗТ с BSH получила дозу 28,8 Гр-экв, группа БНЗТ с ВРА – 12,2 Гр-экв, а группа, облученная нейтронами, – 4,7 Гр-экв. Наведенная радиоактивность составила 4 мк Зв/час.
Облучение мышей с подкожными опухолевыми трансплантатами. Животных распределили на две группы согласно объемам опухолевых образований: 1-я группа прошла БНЗТ с BSH, 2-я группа контрольная. Облучение провели на 20-е сут. после подкожного введения опухолевых клеток. Мышей поместили в пластиковые контейнеры, по два животных в каждый. Четыре контейнера расположили квадратом со стороной 20 см на крутящейся подставке. Между мишенью и контейнерами был размещен цилиндр из оргстекла диаметром 200 мм и толщиной 36 мм, обеспечен адекватный доступ воздуха и оптимальные температурные условия. Суммарное время облучения составило 2 ч 46 мин. Суммарный интеграл тока составил 3,48 мА/ч. Доза, полученная нормальной тканью, составила 3,2-4,0 Гр-экв, доза в опухоли – 5,0-6,0 Гр-экв.
Наблюдение терапевтического ответа и анализ результатов у животных с внутримозговыми опухолевыми ксенотрансплантатами проводили ежедневно, осмотр животных и сбор данных о каждом включал в себя оценку активности, наличие парезов, координацию, вес. Оценку размеров опухоли проводили с помощью Т2-взвешенных изображений методом TurboRARE (Rapid Imaging with Refocused Echoes). Параметры импульсной последовательности метода: TE = 33 мс, TR = 1 500 мс; параметры изображения: размер 2,5 ×2,5 см, матрица 512× 512 пикселей, размер пикселя 0,45 × 0,45 мкм; толщина среза – 0,5 мм; расстояние между срезами – 0,5 мм; количество срезов – 15; ориентация срезов аксиальная, общее время сканирования – 3 мин. Пример МРТ-исследования мыши с внутримозговым опухолевым трансплантатом представлен на рисунке 1.
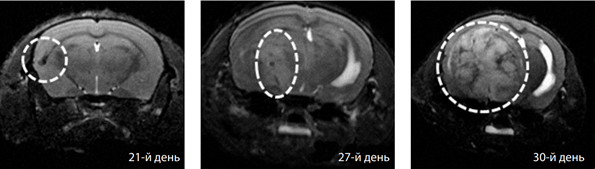
Рис. 1. МРТ-визуализация динамики роста внутримозговой опухоли U87: Т2-взвешенные изображения, корональная проекция, 21, 27, 30-й день после имплантации опухоли,
МРТ-признаки прогрессивного роста опухоли
Статистическую обработку данных проводили c помощью программного обеспечения Microsoft Excel 2010. Категориальные переменные выражали в процентах. Сравнительный анализ значений в опытных и контрольных группах выполняли при помощи теста Манна – Уитни. Принятый порог значимости р = 0,05.
Результаты исследования и их обсуждение
Исследование in vivo показало, что выживаемость животных увеличивалась на 30% по сравнению с контрольной группой, согласно критерию Манна – Уитни, с препаратом BSH (рис. 2).
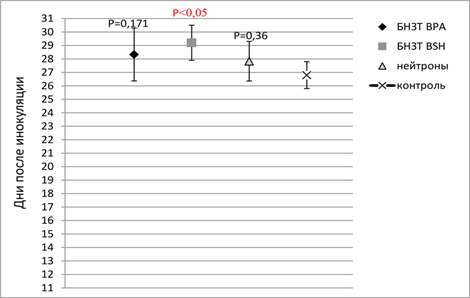
Рис. 2. Средняя продолжительность жизни в группах после проведения бор-нейтронозахватной терапии с BSH и ВРА
Экспериментальные данные исследования также продемонстрировали, что изменение объема опухолей происходит на 30-й день. Так, средний объем в группах БНЗТ меньше, чем в группе облучения без препаратов бора (рис. 3).
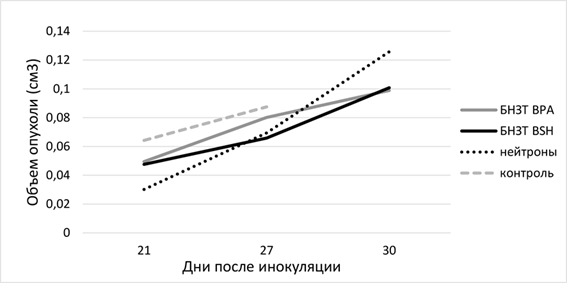
Рис. 3. Динамика роста размеров опухолей в четырех группах
Обобщение экспериментальных данных позволило вычислить скорость гибели животных в группах. В целом группы животных с препаратами бора, а также только облученные нейтронами живут на 2 дня дольше, чем животные контрольной группы (рис. 4).
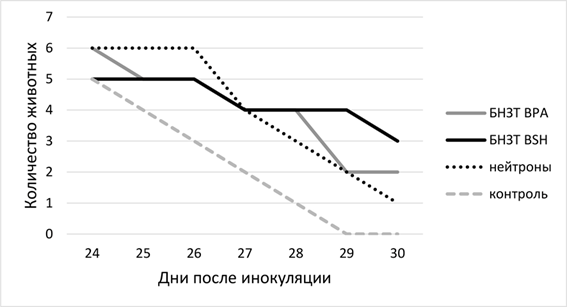
Рис. 4. Скорость гибели животных в экспериментальных группах
Оценка терапевтического ответа и анализ результатов у животных с подкожными опухолевыми ксенотрансплантатами. Наблюдение терапевтического эффекта БНЗТ показало, что опухоли у мышей из группы контроля растут значительно быстрее по сравнению с группой БНЗТ. На 4-е сут. после облучения отмечается резкое уменьшение опухолевого очага в группе БНЗТ (рис. 5).
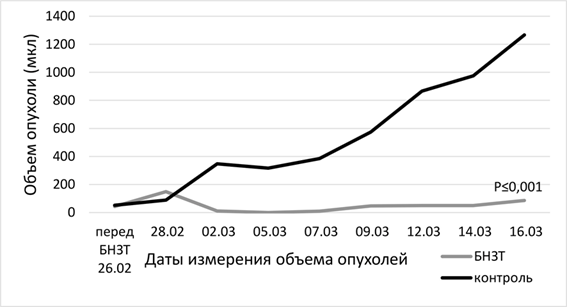
Рис. 5. Динамика объемов опухолей у мышей линии Nu/J с подкожно имплантированной U87
Результаты наблюдения за эффектом БНЗТ представлены на рисунке 6. На фотографиях А, В, Д – внешний вид мыши до БНЗТ, с опухолью до 100 мкл в объеме. На фотографиях Б, Г, Е - через 23 дня после БНЗТ объем опухоли не превышает 200 мкл. На фотографии Ж – внешний вид мыши из группы контроля с опухолью объемом 52 мкл. На фотографии Е представлен внешний вид животного без введения BSH через 23 дня после облучения: хорошо визуализируется крупная подкожная опухоль объемом 1449 мкл, с выраженной сосудистой сетью.
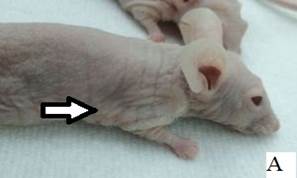

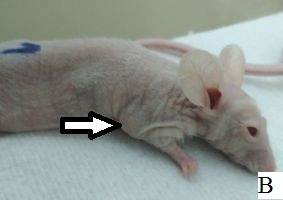

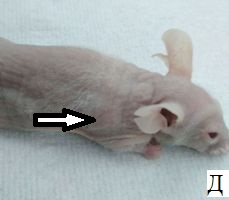

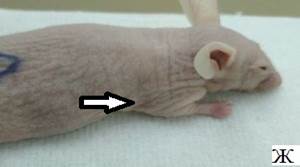
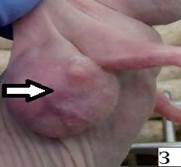
Рис. 6. Внешний вид мыши линии Nu/J с подкожной опухолью U87: А, В, Д, Ж - до облучения; Б, Г, Е, З – через 23 дня после облучения (пояснения в тексте)
Несмотря на существующие технологии, радикальность оперативного лечения, комбинацию лучевой терапии и химиотерапии, медиана выживаемости пациентов с глиобластомой составляет около 15 мес. [7]. В клинических исследованиях по БНЗТ учувствовало около двух тысяч пациентов по всему миру. Имеющиеся в настоящее время результаты демонстрируют положительное влияние такой терапии на выживаемость пациентов с рецидивирующими и вновь диагностированными глиобластомами. По данным Kageji с соавт. [8], медиана выживаемости пациентов, получивших БНЗТ в комбинации со стандартными видами терапии, составила 19,5 месяцев, а двух-, трех-, и пятилетняя выживаемость – 31,8, 22,7, и 9,1% соответственно. В исследовании Yamamoto с соавт. [9] по БНЗТ первично диагностированной глиобластомы медиана выживаемости составила 25,7 мес. Однако необходимы дальнейшие исследования для установления оптимальных терапевтических протоколов, разработки нейтронных источников на основе ускорителей, которые могут упростить размещение устройства для БНЗТ в клинических учреждениях и привести к более широкому применению этого метода [10].
Разработанный в Институте ядерной физики им. Г.И. Будкера СО РАН источник эпитепловых нейтронов на основе ускорителя отвечает требованиям БНЗТ [5]. Проведенные на источнике исследования показали относительную безопасность и терапевтическую эффективность пучка [2; 6]. Однако, учитывая оригинальность установки, необходимо проведение дальнейших широкомасштабных исследований как in vitro, так и in vivo для изучения биологических эффектов. Это позволит транслировать полученные данные в научную среду и будет способствовать внедрению метода в клиническую практику. Наиболее информативными, в том числе с точки зрения доказательности, являются эксперименты по созданию модели человеческой опухоли в организме лабораторного животного. Успешную трансплантацию опухолей человека можно осуществлять мышам и крысам с мутацией nu [11].
Моделирование эффектов нейтронозахватной терапии у животных до последнего времени проводилось на ядерных реакторах с использованием в качестве агентов доставки бора препаратов BSH и BPA. Первые эксперименты с BSH как агента доставки бора для БНЗТ были проведены в 1967 г. [12]. Потенциал этого препарата оценен у мышей с имплантированной подкожной опухолью клеточной линии мышиной эпендимобластомы. Суммарная доза BSH колебалась от 140 до 175 мг бора на грамм массы тела. В 1968 г. Hatanaka [13] и его коллеги инициировали исследование терапии мышей с имплантированной C57BL метилхолантрен-индуцированной саркомой. Переменные дозы BSH были введены интраперитонеально, животные разделены согласно времени и предполагаемой дозе нейтронного излучения. Исследования показали, что у 7 из 13 мышей после сеанса БНЗТ не было доказательств роста опухоли или связанной с лечением токсичности. На основе этих исследований Hatanaka инициировал клиническое испытание у больных с глиомами высокой степени злокачественности. Также проводились эксперименты комбинации БНЗТ с дистанционной лучевой терапией на крысах с имплантированной глиомой F98 [14].
Исследования по эффективности нейтронозахватной терапии проводили и в России. Так, в МИФИ исследования проведены на собаках в возрасте от 9 до 15 лет с гистологически подтвержденным диагнозом меланомы слизистой оболочки ротовой полости. В качестве препаратов использовали Дипентаст и BPA [15]. В группе ГНЗТ в 70% случаев достигнута полная регрессия опухоли в течение 30–45 дней, у 14% животных возникали рецидивы через 1 мес.; продолжительность жизни составила 4–6 мес., тогда как в группе БНЗТ в 95% случаев зафиксирована полная регрессия опухоли, у 20% испытуемых возникали рецидивы через 3–4 мес., продолжительность жизни составила 8 мес. В группе гамма-терапии у 90% собак через 1 мес. после проведения лечения возникали рецидивы, через 2–3 мес. — метастазы; продолжительность жизни 3 мес.
Нами успешно отработана методика по созданию опухолевого ортотопического и гетеротопического ксенотрансплантата у иммунодефицитных мышей с использованием клеточной линии глиобластомы человека U87. Результаты наших исследований по БНЗТ in vivo на новаторском ускорителе показали два момента. Во-первых, БНЗТ уменьшает, а в некоторых случаях – останавливает рост опухоли. Во-вторых, средняя продолжительность жизни в экспериментальных группах после проведенной БНЗТ с BSH выше, чем с BPA и в контрольной группе.
Заключение
Клинический эксперимент in vivo на ускорительном источнике эпитепловых нейтронов в Институте ядерной физики СО РАН подтвердил безопасность и результативность лечения глиобластомы человека с использованием методики БНЗТ. Общие результаты исследования, полученные на экспериментальных опухолевых моделях объемом до 100 мкл, дают основания для разработки программы исследований in vivo с подкожными опухолями объемом до 500 мкл. Проведенное исследование позволило наблюдать тенденцию к уменьшению или приостановке роста образования в группе БНЗТ. Это подтверждает перспективность метода лечения и способа генерации нейтронов. Считаем, что требуются дальнейшие исследования с вовлечением большего количества животных в группы.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-29-01007.



