Низкоинтенсивное лазерное излучение в настоящее время становится все более востребованным инструментом для стимуляции регенераторных процессов, в том числе для стимуляции репаративного остеогенеза [1,2]. Это связано с тем, что сфокусированные световые волны, проходя через ткани, вызывают локальное воздействие в фокальной области пучка стимулируя остеобластогенез из мезенхимальных клеток и дифференцировку остеобластов в области костной раны [3,4]. Широкий диапазон параметров лазерного излучения позволяет проводить настройки для различного воздействия на ткани организма. Эффекты, вызываемые потоком фотонов лазерного света, при воздействии на организм человека могут быть различными – фотохимический, фототермический, фотодинамический и т.д. – и напрямую зависят от параметров излучения [5]. Сегодня широкое применение в медицине получили лазеры с непрерывным излучением, которое приводит к локальному нагреванию и разрушению ткани в фокусе по типу термической абляции. Исследования современных ученых по изучению эффектов воздействия импульсного лазерного излучения на живые ткани показали, что такой тип воздействия существенно снижает возможность ожога и коагуляционного некроза. Особенный научный интерес вызывает применение лазерного излучения в ультракороткоимпульсном диапазоне (наносекундном, фемтосекундном), где высокая мощность в импульсе позволяет глубже проникать в ткани без биодеструктивного нагрева [6-8]. Разрушение патологических тканей в этом случае достигается, в том числе, за счет взаимодействия лазерного излучения с кислородом в тканях без теплового эффекта с выделением активных форм кислорода (синглетной, триплетной) в фокусе воздействия [9]. Наносекундное импульсное излучение способствует суммированию энергии световых фотонов на разных уровнях и заселению тканей активными формами кислорода [10]. Кроме этого, низкоинтенсивное лазерное излучение в определенных диапазонах длин волн обладает в ультракороткоимпульсном режиме, молекулярно-мембранным стимулирующим действием за счет эффектов фотоокситерапии [11].
Лазерное устройство, с заданными параметрами, разработано и сконструировано на основе технической документации с основным излучателем с длиной волны, соответствующей максимуму поглощения кислорода в тканях и наносекундной частотой импульсного излучения, исследовательской группой кафедры хирургии полости рта МГМСУ им. А.И. Евдокимова [12]. Новые медицинские технологии с применением роботизированной хирургии также разрабатываются учеными разных стран. Компактные размеры нового лазерного устройства позволят встраивать его в роботические медицинские устройства для проведения лазерной прецизионной хирургии челюстно-лицевой области [13, 14].
Исследования, проведенные ранее на биохимических и биологических жидкостях in vitro, показывают высокую эффективность генерации синглетного кислорода при использовании нового лазерного устройства [8, 9, 11, 12]. Интерес представляет изучение на доклиническом этапе влияния лазерного излучения нового устройства на репаративный остеогенез челюстей в экспериментальном исследовании с использованием современных технологий иммуногистохимического анализа.
Цель исследования: оценить влияние низкоэнергетической наносекундной лазерной терапии на ремоделирование костной ткани челюстных костей в экспериментальном исследовании in vivo с помощью иммуногистохимического анализа.
Материалы и методы исследования
Исследования на экспериментальных животных проводились в соответствии с Директивой ЕС 86/609/ECC и Конвенцией Совета Европы по защите позвоночных животных, используемых для экспериментальных и других научных целей (1986).
В эксперименте использовали половозрелых крыс-самцов линии Вистар, распределенных на 2 группы – основную и контрольную. Перед началом лечения животным проводили обезболивание наркозную анестезию с использованием Рометара/ксилы 4-6 мг/кг внутримышечно, затем через 20 мин в/м введение Золетил-100 (5-10 мг/кг), что обеспечивало анальгезию и релаксацию в течение 30-40 мин. После проведения внутримышечного наркоза моделировали медиальное перемещение первого моляра нижней челюсти с помощью ортодонтической пружины с силой сжатия 40 Н/см2 по методике Kawasaki, K. Shimizu N. (2000) [15] для чего один конец пружины был закреплен к первому моляру нижней челюсти лигатурной проволокой, другой - к центральному резцу с помощью композиционного материала (рисунок 1).
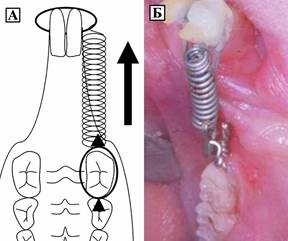
Рис.1. Схема (А) и клиническая картина (Б) наложения пружины для моделирования перемещения первого моляра
После фиксации пружины в основной группе на следующие сутки начинали терапию с применением нового лазерного устройства со следующими параметрами: длина волны 1270±5 нм, режим излучения – импульсный наносекундный с частотой следования импульсов 200 нс и паузы 200 нс, экспозиция излучения – 6 мин, диаметр световода -400 мкм, фокусное расстояние -3 мм. Процедуру лазерного воздействия проводили в течение 7 дней с помощью облучения зоны с медиальной стороны и дистальной стороны первого моляра с оральной и щечной поверхности по 1,5 мин попеременно. Данные параметры позволяют проводить лазерное воздействие со средней суммарной мощностью 200 мДж/см2 на каждый облучаемый сегмент. После этого делали перерыв в проведении процедур с применением лазера на 7 суток, затем в течение 7 дней лазерное воздействие повторяли с теми же параметрами. В контрольной группе никакой дополнительной терапии не проводили. Для получения репрезентативных данных животных выводили из эксперимента на 7, 14 и 21-е сутки с помощью эвтаназии с использованием 5 мг препарата Рометар/ксила для угнетения дыхания. Проводили декапитацию с помощью костных кусачек, затем с помощью фрезы отделяли фрагмент с нижним моляром, отступя в каждую сторону на 10 мм, полученные фрагменты фиксировали в забуференном 10% растворе формалина в течение 2-х суток при температуре 4ºС. С помощью препарата Биодек R (Италия) полученные фрагменты подвергали декальцинации, затем заливали в парафин. Гистологические срезы толщиной 3 мкм, изготовленные с помощью роторного микротома НМ355S (Thermo Scientific, Германия), помещали на покрытые специальные адгезивом предметные стекла для иммуногистохимических исследований. Эндогенную пероксидазу в депарафинированных срезах блокировали 3% перекисью водорода. Для иммуногистохимического исследования в качестве первичных использовали поликлональные антикроличьи антитела к ММР-9 (Lab Vision, США, в разведении 1:100). Матриксные металлопротеиназы (ММP) относятся к семейству цинк-зависимых металлопротеиназ, функция которых связана с обменом соединительнотканного и костного матрикса в норме и при патологии. Они участвуют в миграции клеток, расщеплении белков внеклеточного матрикса (коллагена и других), активации цитокинов, ростовых факторов и адгезивных молекул, формировании их растворимых форм, способствующих усилению или ингибированию биологических эффектов. MMP-9 принимает участие в процессах воспаления, ремоделирования ткани и репарации, мобилизации матрикссвязанных факторов роста и процессинга цитокинов.
Постановку иммуногистохимических реакций осуществляли после высокотемпературного восстановления антигенных детерминант в PT-модуле для термической обработки парафиновых срезов (Thermo Scientific, Великобритания) осуществляли в аутостейнере Thermo Scientific, (Великобритания) согласно протоколу, прилагаемому фирмой-изготовителем. Для визуализации реакций применяли готовую тест-систему с универсальными вторичными антителами, мечеными хромогеном (3,3'-диаминобензидином) – Histophine (Nichirei Corp., Япония). Учитывали два негативных контроля (на специфичность реакции и отсутствие активной эндогенной пероксидазы) и один внутренний позитивный на специфичность реакции. Иммуногистохимическое исследование проводили на кафедре патологической анатомии МГМСУ им. А.И. Евдокимова (заведующий кафедрой – Заслуженный врач Российской Федерации, проф. О.В.Зайратьянц).
Изучение результатов иммуногистохимической реакции в альвеолярной кости проводили с обеих сторон от первого моляра (зуба, на который производилось воздействие пружины) – со стороны давления и со стороны растяжения. Для количественной оценки иммуногистохимических реакций использовали рутинный полуколичественный метод. Учитывали выраженность экспрессии ММР-9 в баллах: отсутствие (0 баллов), слабую (1 балл), умеренную (2 балла) и выраженную (3 балла). Подсчет проводили в 10-и случайным образом отобранных полях зрения при увеличении микроскопа х400. Результаты обрабатывали статистически с использованием программного обеспечения MS Office Excel и Statistica for Windows 10.0, представляли в виде среднего значения ± стандартное квадратическое отклонение (М ± σ). Количественные данные в группах анализировали с помощью непараметрической метода Манна-Уитни (Mann-Whitny) для малых выборок. Величина критического уровня значимости принималась равной 0,05, т.е. различия признавались статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
Результаты иммуногистохимического исследования костной и мягких тканей со стороны давления на 7 сутки наблюдения показали в основной группе умеренную и выраженную экспрессию ММР-9 в стенках сосудов, фибробластах, макрофагах, цементобластах, остеобластах, остеокластах и экстрацеллюлярном матриксе периодонтальной связки, особенно в участках резорбции альвеолярной костной ткани (рисунок 2А). В контрольной группе экспрессия ММР-9 в тех же клетках и структурах была слабой или умеренной (рисунок 2Г). На 14 сутки в основной группе со стороны давления отмечалась еще более выраженная экспрессия ММР-9 как в стенках сосудов, фибробластах, макрофагах, остеокластах, так и в экстрацеллюлярном матриксе периодонтальной связки в участках резорбции альвеолярной костной ткани (рисунок 2Б). В контрольной группе на данном этапе наблюдения по-прежнему отмечалась слабая экспрессия ММР-9 (рисунок 2Д). На 21 сутки наблюдения со стороны давления в основной группе сохранялась выраженная экспрессия ММР-9 во всех структурах пародонта (рисунок 2В). В контрольной группе со стороны давления на 21 сутки отмечалась лишь умеренная экспрессия ММР-9 (рисунок 2Е). Со стороны растяжения на всех этапах наблюдения результаты иммуногистохимической оценки экспрессии матриксной металлопротеиназы ММР-9 были практически идентичны результатам полученным при оценке иммуногистохимических препаратов на стороне давления.
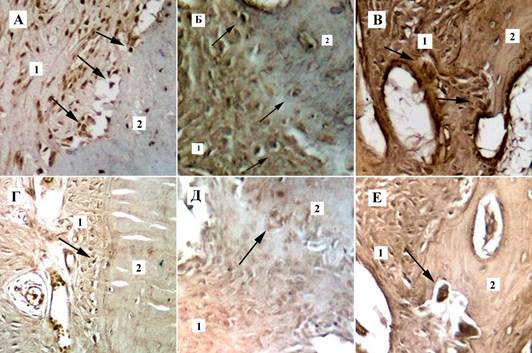
Рис. 2. Экспрессия матриксной металлопротеиназы ММР-9 в тканях пародонта на этапах наблюдения со стороны давления на костную ткань. Верхний ряд – основная группа. Нижний ряд – группа сравнения: А, Г – 7 сутки наблюдения; Б, Д - 14 сутки наблюдения; В,Е - 21 сутки наблюдения: 1 – периодонтальная связка, 2 – альвеолярная кость, стрелками указана экспрессия ММР-9 в остеокластах. Непрямой иммуногистохимический метод с антителами к ММР-9, х 400
Результаты морфометрического исследования показали, что практически на всех этапах наблюдения со стороны давления экспрессия матриксной металлопротеиназы ММР-9 в стенках сосудов, фибробластах, макрофагах, остеокластах, экстрацеллюлярном матриксе периодонтальной связки в участках резорбции альвеолярной костной ткани выражена больше в основной группе с применением лазерной биостимуляции репаративного остеогенеза на 20-25% по сравнению с группой контроля при статистически достоверной разнице между всеми показателями групп, а также внутри групп в разные сроки эксперимента (p=0,0005).
Выраженность экспрессии ММР-9 в различных клетках и экстрацеллюлярном матриксе периодонтальной связки со стороны давления на этапах эксперимента
|
Группа |
Сутки эксперимента |
||
|
7 |
14 |
21 |
|
|
Основная |
2,7±0,38 |
2,8±0,13 |
2,9±0,07 |
|
Контрольная |
2,1±0,72 |
2,1±0,63 |
2,3±0,48 |
Заключение
Результаты экспериментального исследования при перемещении зубов у животных in vivo по оценке влияния низкоэнергетической наносекундной лазерной терапии на ремоделирование костной ткани челюстных костей с помощью иммуногистохимического анализа показали, что воздействие лазерного излучения нового диодного лазерного устройства с длиной волны 1265±10 нм и возможностью излучения в импульсном наносекундном режиме с генерацией активных форм кислорода в тканях, способствует стимуляции экспрессии матриксной металлопротеиназы ММР-9 во всех структурах пародонта, включая стенки сосудов, фибробласты, макрофаги, остеобласты, остеокласты, экстрацеллюлярный матрикс периодонтальной связки. Экспрессия ММР-9 возрастает по сравнению с контрольной группой на 20-25% как со стороны давления на альвеолярную кость, так и со стороны растяжения. Увеличение экспрессии ММР-9 свидетельствует об ускорении ремоделирования костной ткани и репартивного остеогенеза под действием лазерного излучения.
Полученные данные доказывают возможность стимуляции репаративных процессов в костной ткани челюстей и пародонте под действием наносекундной низкоэнергетической лазерной терапии, что, несомненно, свидетельствует о перспективах новой лазерной технологии для применения в клинической практике с целью ускорения реабилитации пациентов при проведении костнопластической хирургии челюстно-лицевой области, а также гнатологической хирургии и ортодонтическом перемещении зубов в челюстных костях.



